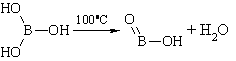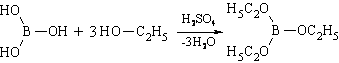Борная кислота
| Борная кислота | |
|---|---|
 | |
 | |
| Систематическое наименование | Ортоборная кислота |
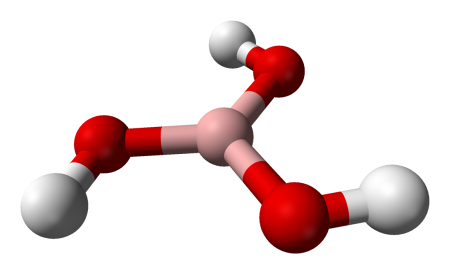
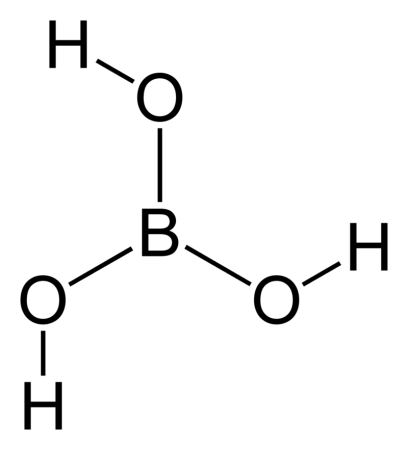
| Хим. формула | H3BO3 |
| Состояние | твёрдое |
| Молярная масса | 61,83 г/моль |
| Плотность | 1,435 (15 °C) |
| Т. плав. | 170.9 °C, 444 K, 340 °F |
| Т. кип. | 300 °C, 573 K, 572 °F °C |
| pKa | 9,24 (I), 12,74 (II), 13,80 (III) |
| Растворимость в воде | |
| ГОСТ | ГОСТ 9656-75 ГОСТ 18704-78 |
| Рег. номер CAS | 10043-35-3 |
| PubChem | 7628 |
| Рег. номер EINECS | 233-139-2 |
| SMILES | |
| Кодекс Алиментариус | E284 |
| RTECS | ED4550000 |
| ChEBI | 33118 |
| ChemSpider | 7346 |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
Борная кислота (ортоборная кислота или лат. acidum Boricum ) — слабая, одноосновная кислота Льюиса, часто используемая в качестве инсектицида, антисептика, огнезащитного состава, поглотителя нейтронов или предшественника для получения иных химических составов. Имеет химическую формулу H3BO3 (или B(OH)3).
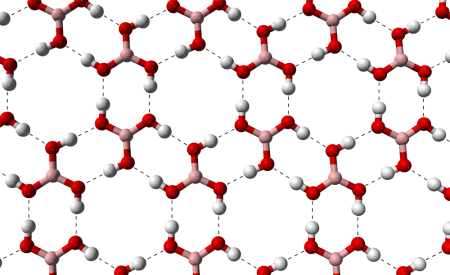
Бесцветное кристаллическое вещество в виде чешуек без запаха, имеет слоистую триклинную решётку, в которой молекулы кислоты соединены водородными связями в плоские слои, слои соединены между собой межмолекулярными связями, длина которых составляет 272 пм. Расстояние между соседними слоями — 318 пм.
Метаборная кислота (HBO2) также представляет собой бесцветные кристаллы. Она существует в трёх модификациях — наиболее устойчивой γ-HBO2 с кубической решёткой, β-HBO2 с моноклинной решёткой и α-HBO2 с ромбической решёткой.
При нагревании ортоборная кислота теряет воду и сначала переходит в метаборную кислоту, затем в тетраборную H2B4O7. При дальнейшем нагревании обезвоживается до борного ангидрида.
Водные растворы борной кислоты являются смесью полиборных кислот общей формулы H3m-2nВmO3m-n. В природе встречается в виде минерала сассолина.
Содержание
- 1 Нахождение в природе
- 2 Получение
- 3 Свойства
- 4 Борная кислота в медицине
- 5 Применение
Нахождение в природе
В природе свободная борная кислота встречается в виде минерала сассолина, в горячих источниках и минеральных водах.
Получение
Борная кислота может быть получена путём смешения буры (Тетрабората натрия) с минеральной кислотой, например, соляной:
Также является продуктом гидролиза диборана или тригалогенидов бора:
B2H6 + 6H2O → 2H3BO3 + 6H2 BCl3 + 3H2O → H3BO3 + 3HCl 
Борная кислота ОСЧ
Свойства
Борная кислота проявляет очень слабые кислотные свойства. Она сравнительно мало растворима в воде. Её кислотные свойства обусловлены не отщеплением протона H + , а присоединением гидроксильного аниона:
Она легко вытесняется из растворов своих солей большинством других кислот. Соли её, называемые боратами, производятся обычно от различных полиборных кислот, чаще всего — тетраборной H2B4O7, которая является значительно более сильной кислотой, чем ортоборная.
Очень слабые признаки амфотерности B(OH)3 проявляет, образуя малоустойчивый гидросульфат бора В(HSO4)3.
При нейтрализации ортоборной кислоты щелочами в водных растворах не образуются ортобораты, содержащие ион (BO3) 3− , поскольку ортобораты гидролизуются практически полностью, вследствие слишком малой константы образования [В(ОН)4] − . В растворе образуются тетрабораты, метабораты или соли других полиборных кислот:
Мета- и тетрабораты гидролизуются, но в меньшей степени (реакции, обратные приведённым).
В подкисленных водных растворах боратов устанавливаются следующие равновесия:
При нагревании борная кислота растворяет оксиды металлов, образуя соли.
Со спиртами в присутствии концентрированной серной кислоты образует эфиры:
Образование борнометилового эфира В(OCH3)3 является качественной реакцией на H3BO3 и соли борных кислот, при поджигании борнометиловый эфир горит красивым ярко-зеленым пламенем.
Борная кислота в медицине
Борный спирт (лат. Solutio Acidi borici spirituosa ) — раствор борной кислоты в этиловом спирте (как правило, в 70 % этаноле).
Спиртовые растворы борной кислоты в концентрации 0,5 %, 1 %, 2 %, 3 %, 5 % готовятся на 70 % этиловом спирте и применяются в качестве антисептика и как противозудное средство при обтирании здоровых участков кожи вокруг очагов пиодермии, а также в качестве ушных капель.
Борная кислота может быть опасна только при бесконтрольном приёме внутрь. Опасная концентрация в организме человека (а особенно ребёнка) может возникнуть при регулярном применении. Смертельная доза при отравлении через рот для взрослого человека составляет 15-20 г, для детей — 4-5 г.
Борная кислота применяется в медицине с 60-х годов XIX века как антисептическое средство, не раздражающее ран и не имеющее вкуса, запаха и цвета. В современной медицине противомикробная эффективность борной кислоты считается низкой.
Использование борной кислоты в качестве антисептического средства для детей, а также беременных и кормящих женщин было запрещено 2 февраля 1987 года Министерством здравоохранения СССР по рекомендации Фармакологического комитета с формулировкой: «…запретить использование борной кислоты в качестве антисептического средства у детей грудного возраста, а также у женщин в период беременности и лактации в связи с её низкой активностью и высокой токсичностью».
Тема №3 Протолитическое равновесие в водных растворах слабых кислот, слабых оснований и солей
ПРОТОЛИТИЧЕСКОЕ РАВНОВЕСИЕ В ВОДНЫХ РАСТВОРАХ СЛАБЫХ КИСЛОТ, СЛАБЫХ ОСНОВАНИй И СОЛЕЙ
Типовые задачи по данной теме
1. Расчет степени ионизации и концентрации ионов в водных
растворах слабых электролитов.
2. Расчет рН водных растворов слабых кислот и оснований.
3. Расчет концентрации слабых кислот и оснований по
величине рН раствора.
4. Расчет рН водных растворов солей.
Основные теоретические положения
Кислотно-основные реакции — это частный случай равновесия в гомогенной системе, поэтому расчеты равновесных концентраций компонентов реакции базируются на законе действующих масс и условии материального баланса.
Кислотно-основные реакции осуществляются за счет переноса протона от кислоты к основанию. Согласно протолитической теории Бренстеда-Лоури кислота – это вещество, являющееся донором протонов, а основание — акцептором протонов. Вещества, способные и отдавать, и принимать протоны, называются амфолитами.
Кислоты могут быть молекулярными (HNO2, HCN, H2CO3), катионными (H3O+, NH4+, Al(H2O)63+) и анионными (HC2O4-, HCO3-, H2PO4-).
Основания могут быть молекулярными (NH3, CH3NH2), катионными (AlOH(H2O)5)2+, BaOH+) и анионными (CN-, CO32-, OH-).
Амфолиты могут быть нейтральными (H2O, NH2CH2COOH) и заряженными (HCO3-, HC2O4-, HS-, H2PO4-, AlOH(H2O)52+).
Растворы слабых кислот
Сила слабой монопротонной (одноосновной) кислоты НАn, ионизация которой в водном растворе протекает согласно уравнению
НАn + Н2О 
характеризуется константой кислотности Ка(НАn) или силовым показателем рКа(НАn):

При записи уравнения (1) в виде Н3О+ + Аn- 

Константа кислотности Ка(НАn) и константа протонирования Кн(Аn–) имеют постоянные значения при постоянной температуре и любой ионной силе раствора.
Обозначим молярную концентрацию слабой монопротонной кислоты НАn, ионизация которой в водном растворе описывается уравнением (1), через Са, а степень ее ионизации как αа. С учетом того, что в растворах слабых электролитов концентрация ионов мала, будем считать активности ионов равными их концентрациям (Ic = 0, f(An–) = f(H3O+) = 1).
Если кислота НАn не является очень слабой (Ка(НАn) > 10–6), а ее раствор не очень разбавленным (Са(НАn) > 10–4 моль/л), то конкурирующей реакцией автопротолиза воды можно пренебречь.
Тогда при подстановке значений
в формулу (2) получим формулу (4), связывающую Ка, Са и αа:

Если для раствора кислоты НАn отношение Са/Ка ≥ 400, то степень ее ионизации меньше или равна 5% (αа ≤ 0,05, 1 – α ≈ 1). В этом случае [HAn] = Са, Ка = Са αа2 и справедливы соотношения (5-7):

а(Н3О+) = 
pH = – 

Если для раствора кислоты НАn отношение Са/Ка 0,05, 1–α ≠ 1). В этом случае [НАn] ≠ Са и после преобразования формулы (4) получим соотношения (8,9):

а(Н3О+) = [H3O+] =Саαа= 
Выражения (5-9) справедливы для растворов средних солей, образованных остатками слабых оснований (NH4Cl, CuCl2, FeCl3 и т. п.) и для слабых полипротонных кислот (Н3PO4, H2SO3 и т. п.), для которых Ka(HmAn) » Ka(Hm-1An-).
Растворы слабых оснований
Сила слабого основания Аn-, ионизация которого в водном растворе описывается уравнением:
Аn — + Н2О 

Как было показано выше, для характеристики силы основания Аn — может использоваться константа протонирования Кн(Аn-):
Кн(Аn-) =
Аналогично предыдущим рассуждениям легко получить формулы для вычисления степени ионизации, равновесных концентраций и рН растворов слабых оснований.
Для слабого однокислотного основания Аn — с молярной концентрацией Сb и степенью ионизации αb ≤ 0,05 (Cb/Kb ≥ 400) в случае, когда ионизацией воды можно пренебречь, получаем:

a(OH-) = [OH-] = [HAn] = αbCb = 
рН = 14 — рОН = 14 – 
Если αb > 0,05 (Cb/Kb 400, то αа 5% и для расчета αа и рН воспользуемся формулами (8,9):

=
рН = – lg [H3O+] = – lg 2,33·10-2 = 1,63
Пример 3. Рассчитайте степень ионизации аммиака, концентрацию ионов аммония и оксония и рН 0,100 моль/л водного раствора аммиака.
Решение: Ионизация аммиака в водном растворе описывается уравнением:
NH3(b) + HOH = NH4+(a) + OH-
Константа основности Кb равна:

Так как Cb/Kb = 0,100/1,76·10-5 > 400, то степень ионизации аммиака αb
Ионизация борной кислоты уравнение реакции
ЛП неорганической природы
SHAPE \* MERGEFORMAT
Acidum boricum – Кислота борная
Описание. Белые блестящие, слегка жирные на ощупь чешуйки или мелкий кристаллический порошок без запаха. Летуч с парами воды и спирта. При продолжительном нагревании (до 100°С) теряет часть воды, переходя в метаборную кислоту ( HBO 2 ), при более сильном нагревании образуется стекловидная масса ( H 2 B 4 O 7 ), которая при дальнейшем нагревании, вспучиваясь, теряет всю воду и переходит в борный ангидрид ( B 2 O 3 ) бурого цвета. Водный раствор имеет слабокислую реакцию.
Растворимость. Растворим в 25 ч. воды, в 4 ч. кипящей воды, в 25ч. спирта, медленно в 7 частях глицерина.
Получение. Из природных минералов: ашарит ( Mg 2 B 2 O 5 ∙ H 2 O ), сассолин ( H 3 BO 3 ), бура ( Na 2 B 4 O 7 ∙10 H 2 O ), борокальций ( CaB 4 O 7 ∙10 H 2 O ):
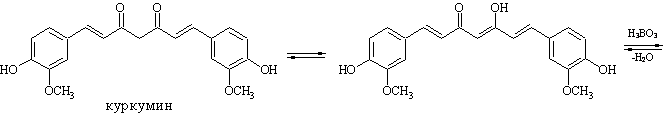
1. Реакция с куркумином (ГФ Х). Куркумовая бумага, смоченная раствором препарата и раствором соляной кислоты, окрашивается при высушивании в розовый или буровато-красный цвет, переходящий от смачивания раствором аммиака в зеленовато-черный:
SHAPE \* MERGEFORMAT
SHAPE \* MERGEFORMAT
Недопустимо присутствие Fe , Mo , W (образуют комплексы подобного цвета).
2. Образование борноэтилового эфира (ГФ Х) , горящего пламенем с зеленой каймой:
Примеси. Допустимые: мышьяк, хлориды, сульфаты, железо, тяжелые металлы, кальций.
Количественное определение (ГФ Х). Прямая алкалиметрия.
Титрант – NaOH , индикатор – фенолфталеин, среда – глицерин.
f экв ( H 3 BO 3 )=1, 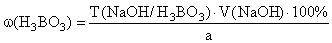
http://pandia.ru/text/80/167/16767.php
http://nesterovdmitriy.narod.ru/03-Nauchnaya_Deyat/pharm_chem/Ac_boricum.htm