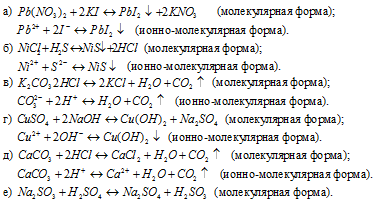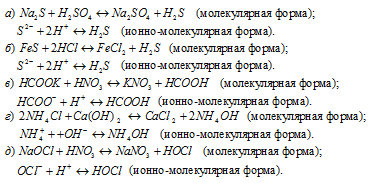Гидролиз бромида алюминия
AlBr3 — соль образованная слабым основанием и сильной кислотой, поэтому реакция гидролиза протекает по катиону.
Первая стадия (ступень) гидролиза
Молекулярное уравнение
AlBr3 + HOH ⇄ AlOHBr2 + HBr
Полное ионное уравнение
Al 3+ + 3Br — + HOH ⇄ AlOH 2+ + 2Br — + H + + Br —
Сокращенное (краткое) ионное уравнение
Al 3+ + HOH ⇄ AlOH 2+ + H +
Вторая стадия (ступень) гидролиза
Молекулярное уравнение
AlOHBr2 + HOH ⇄ Al(OH)2Br + HBr
Полное ионное уравнение
AlOH 2+ + 2Br — + HOH ⇄ Al(OH)2 + + Br — + H + + Br —
Сокращенное (краткое) ионное уравнение
AlOH 2+ + HOH ⇄ Al(OH)2 + + H +
Третья стадия (ступень) гидролиза
Молекулярное уравнение
Al(OH)2Br + HOH ⇄ Al(OH)3 + HBr
Полное ионное уравнение
Al(OH)2 + + Br — + HOH ⇄ Al(OH)3 + H + + Br —
Сокращенное (краткое) ионное уравнение
Al(OH)2 + + HOH ⇄ Al(OH)3 + H +
Среда и pH раствора бромида алюминия
В результате гидролиза образовались ионы водорода (H + ), поэтому раствор имеет кислую среду (pH
ПОМОГИТЕ ПОЖАЛУЙСТА Написать в ионно — молекулярной форме уравнения реакций, приводящих к образованию малодиссоциированных соединений : а) AlBr3 + AgNO3 ; б) Na2SO3 + H2SO4?
Химия | 10 — 11 классы
ПОМОГИТЕ ПОЖАЛУЙСТА Написать в ионно — молекулярной форме уравнения реакций, приводящих к образованию малодиссоциированных соединений : а) AlBr3 + AgNO3 ; б) Na2SO3 + H2SO4.
AlBr3 + 3 AgNO3 — > Al(NO3)3 + 3AgBr
Al( + 3) + 3Br( — ) + 3Ag( + ) + 3NO3( — ) — > Al( + 3) + 3NO3( — ) + 3AgBr
3Ag( + ) + 3Br( — ) — > 3AgBr
Na2SO3 + H2SO4 — > Na2SO4 + SO2 + H2O
2Na( + ) + SO3( — 2) + 2H( + ) + SO4( — 2) — > 2Na( + ) + SO4( — 2) + SO2 + H2O
SO3( — 2) + 2H( + ) — > SO2 + H2O.
Напишите уравнение реакций ионного обмена приводящих к образованию бромида серебраиодида серебра?
Напишите уравнение реакций ионного обмена приводящих к образованию бромида серебра
Дописать схему реакции и написать уравнение в молекулярной и ионной формах NaCl + AgNO3 -?
Дописать схему реакции и написать уравнение в молекулярной и ионной формах NaCl + AgNO3 -.
Написать в молекулярной и ионно — молекулярной формах уравнение реакции :Ba(NO₃)₂ + Cr₂(SO₄)₃?
Написать в молекулярной и ионно — молекулярной формах уравнение реакции :
Написать ионно — молекулярные реакции между соединениями : Хлоридом натрия и нитратом свинца?
Написать ионно — молекулярные реакции между соединениями : Хлоридом натрия и нитратом свинца.
Закончить уравнение реакций и написать ионно — молекулярные уравнения реакции образования менее растворимых соединений, чем исходные Zn(NO3)2 + Na2S?
Закончить уравнение реакций и написать ионно — молекулярные уравнения реакции образования менее растворимых соединений, чем исходные Zn(NO3)2 + Na2S.
Написать в ионно — молекулярной форме уравнение реакции NiCl2 + H2S?
Написать в ионно — молекулярной форме уравнение реакции NiCl2 + H2S.
Пожалуйста очень очень подробно.
Укажите суммы всех коэффициентов в молекулярном, полном ионно — молекулярном и кратком ионно — молекулярном уравнениях реакции гидроксида калия с сероводородной кислотой, приводящей к образованию суль?
Укажите суммы всех коэффициентов в молекулярном, полном ионно — молекулярном и кратком ионно — молекулярном уравнениях реакции гидроксида калия с сероводородной кислотой, приводящей к образованию сульфита.
Составить молекулярные, полные ионные и сокращённые ионные уравнения HCl + AgNO₃ ; BaCl₂ + CuSO₄?
Составить молекулярные, полные ионные и сокращённые ионные уравнения HCl + AgNO₃ ; BaCl₂ + CuSO₄.
K2SO3 + HCL как написать молекулярное и ионно — молекулярное уравнение к этой реакции?
K2SO3 + HCL как написать молекулярное и ионно — молекулярное уравнение к этой реакции?
NaSO + HSO — NaSO + SO + S + HO степень окисления?
NaSO + HSO — NaSO + SO + S + HO степень окисления.
Вы находитесь на странице вопроса ПОМОГИТЕ ПОЖАЛУЙСТА Написать в ионно — молекулярной форме уравнения реакций, приводящих к образованию малодиссоциированных соединений : а) AlBr3 + AgNO3 ; б) Na2SO3 + H2SO4? из категории Химия. Уровень сложности вопроса рассчитан на учащихся 10 — 11 классов. На странице можно узнать правильный ответ, сверить его со своим вариантом и обсудить возможные версии с другими пользователями сайта посредством обратной связи. Если ответ вызывает сомнения или покажется вам неполным, для проверки найдите ответы на аналогичные вопросы по теме в этой же категории, или создайте новый вопрос, используя ключевые слова: введите вопрос в поисковую строку, нажав кнопку в верхней части страницы.
PH = — lg[H⁺] Поскольку серная кислота — сильная, то она практически полностью диссоциирует на ионы : H₂SO₄ = 2 H⁺ + SO₄²⁻ Как видно из уравнения, концентрация ионов H⁺ в два раза выше концентрации кислоты, взятой для растворения : [H⁺] = 2 * С(H₂SO₄..
Масса раствора = 180 + 20 = 200 процентная концентрация, т е W% = 20 / 200 * 100% = 10% ответ : 10%.
Решение находится на фото.
M (Al2(SO4)3) = m(p — pa) * ω(Al2(SO4)3) / 100% = 68, 4 г * 0, 08 = 5, 472гn (Al2(SO4)3) = m / M = 5, 472 г / 342 г / моль = 0, 016 моль 0, 016 моль х3 BaCl2 + Al2(SO4)3 = 2 AlCl3 + 3 BaSO4↓ 1 моль 3 мольх = 0, 048мольm (BaSO4) = n * M = 0, 048 моль ..
A(Lu) = 175 A(Pa) = 231 A(Ag) = 108 A(Co) = 59 A(K) = 39 Ответ : 1. Лютеций 2. Протактиний.
1, 2 1 — Lu = 174. 967 2 — Pa = 231. 036.
Любое целое число является также натуральным числом.
Стержень в лабораторном штативе необходим для того, чтобы закреплять так называемые «Муфты» — приспособления (часто в виде кольца), которые держат пробирки.
1. Это качественная реакция на многоатомные спирты. Получается ярко — синий раствор. 2. (Фото) 3. Реакция серебряного зеркала (образуется карбоновая кислота и серебро в осадок) 4. Синие окрашивание(качественная реакция на крахмал) 5. Реакция сер..
Ему приснился сон и в этом сне он увидел эту таблицу.
Cоставление ионно-молекулярных форм уравнений реакций
Задача 580.
Написать в ионно-молекулярной форме уравнения реакций, приводящих к образованию малорастворимых осадков или газов: 
Решение:
Так как реакция протекает с образованием сернистой кислоты – слабого электролита и при этом не выпадает осадок и не выделяется газ, то, по условию задачи, ионно-молекулярное уравнение не пишем.
Задача 581.
Написать в ионно-молекулярной форме уравнения реакций, приводящих к образованию малодиссoциированных соединений: 
Решение:
Задача 582.
Написать в ионно-молекулярной форме уравнения реакций нейтрализации: 
Указать, какие из этих реакций протекают обратимо, а какие необратимо.
Решение:
а) 2HCl + Ba(OH)2 ⇔ BaCl2 + 2H2O (молекулярная форма);
2H + + 2OH — ⇔ 2H 2 O (ионно-молекулярная форма).
Реакция протекает до конца, так как в реакцию вступают сильные электролиты соляная кислота и гидроксид бария образуется слабый электролит вода.
б) HF + KOH ⇔ KF + H2O (молекулярная форма);
H + + OH — ⇔ H2O (ионно-молекулярная форма).
В реакции участвуют два слабых электролита фтороводород и вода, согласно принципу Ле Шателье, равновесие реакции будет смещено в сторону более слабого электролита, т.е. вправо в сторону образования воды. Реакция обратима.
в) Fe(OH)3 + 3HNO3 ⇔ Fe(NO3)3 + 3H2O (молекулярная форма);
3H + + 3OH — ⇔ 3H2O (ионно-молекулярная форма).
В реакции участвуют слабое малорастворимое основание и сильная кислота, равновесие будет смещено в сторону образования более слабого электролита воды. Реакция будет протекать до конца.
г) CH3COOH + NH4OH ⇔ CH3COONH4 + H2O (молекулярная форма);
H + + OH — ⇔ H2O (ионно-молекулярная форма).
Реакция обратима, так как в реакции участвуют три слабых электролита уксусная кислота, гидроксид аммония и вода. Согласно принципу Ле Шателье равновесие системы будет смещено в сторону образования самого слабого электролита, вправо, в сторону образования воды.
д) HNO2 + NH4OH ⇔ NH4NO2 + H2O (молекулярная форма);
H + + OH — ⇔ H2O (ионно-молекулярная форма).
Реакция обратима, так как в реакции участвуют три слабых электролита уксусная кислота, гидроксид аммония и вода. Согласно принципу Ле Шателье равновесие системы будет смещено в сторону образования самого слабого электролита, вправо, в сторону образования воды.
е) H2S + 2NH4OH ⇔ (NH4)2S + 2H2O (молекулярная форма);
2H + + 2OH — ⇔ 2H2O (ионно-молекулярная форма).
Реакция обратима, так как в реакции участвуют три слабых электролита сероводородная кислота, гидроксид аммония и вода. Согласно принципу Ле Шателье равновесие системы будет смещено в сторону образования самого слабого электролита, вправо, в сторону образования воды.
Таким образом, реакции нейтрализации, в которых участвуют слабые кислоты или основания, — обратимы, т.е. могут протекать как в прямом так и в обратном направлении.
http://himia.my-dict.ru/q/6483010_pomogite-pozalujsta-napisat-v-ionno-molekularnoj/
http://buzani.ru/zadachi/khimiya-glinka/1194-ionno-molekulyarnaya-forma-uravneniya-zadachi-610