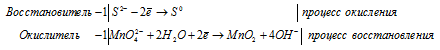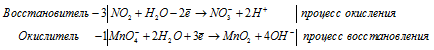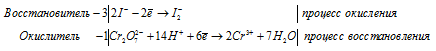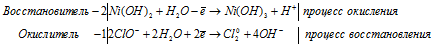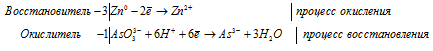Составление уравнений в ионно-молекулярной форме
S 2 — + MnO4 2- + 2H2O = MnO2 + S 0 + 4OH —
После приведения членов обеих частей уравнения, получим:
Уравнение в ионно-молекулярной форме:
4K + + S 2- + MnO4 2- + 2H2O = S + MnO2 + 4K + + 4OH — .
После приведения членов обеих частей уравнения, получим:
Уравнение в ионно-молекулярной форме:
После приведения членов обеих частей уравнения, получим:
Для уравнивания добавим в уравнение 1 моль K2SO4, получим:
Уравнение в ионно-молекулярной форме:
После приведения членов обеих частей уравнения, получим:
Уравнение в ионно-молекулярной форме:
3Zn 0 + AsO3 3- + 6H + = 3Zn 2+ + As 3- + 3H2O.
После приведения членов обеих частей уравнения, получим:
Дихромат калия
| Дихромат калия | |
|---|---|
 | |
| Систематическое наименование | Дихромат калия |
| Традиционные названия | Бихромат калия, двухромовокислый калий, хромпик |
| Хим. формула | K2Cr2O7 |
| Состояние | оранжевые кристаллы |
| Молярная масса | 294,19 г/моль |
| Плотность | 2,676 г/см³ |
| Т. плав. | 396 °C |
| Т. кип. | 500 °C |
| Т. разл. | 500 °C |
| Энтальпия образования | −2033 кДж/моль |
| Растворимость в воде | 4,9 г/100 мл |
| Координационная геометрия | Тетраэдральная |
| Кристаллическая структура | Триклинная |
| ГОСТ | ГОСТ 2652-78 |
| Рег. номер CAS | 7778-50-9 |
| PubChem | 24502 |
| Рег. номер EINECS | 231-906-6 |
| SMILES | |
| Рег. номер EC | 231-906-6 |
| RTECS | HX7680000 |
| ChEBI | 53444 |
| ChemSpider | 22910 |
| ЛД50 | 25 мг/кг (крысы, орально) |
| Токсичность | высокотоксичен, канцероген, мутаген, аллерген, сильный окислитель |
| Пиктограммы СГС |      |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
Дихромат калия (двухромовокислый калий, бихромат калия, техн. хромпик) — неорганическое соединение, калиевая соль дихромовой кислоты с химической формулой K2Cr2O7, имеет вид оранжевых кристаллов. Обладает сильными окислительными свойствами, в связи с чем широко применяется в химии, фотографии, пиротехнике и различных областях промышленности. Высокотоксичен и канцерогенен.
Иногда хромпиком также называют дихромат натрия (Na2Cr2O7).
Содержание
- 1 Физические и химические свойства
- 2 Получение
- 3 Применение
- 4 Безопасность
Физические и химические свойства
Оранжевые кристаллы с температурой плавления 396 °C. Разлагается при нагреве выше 500 °C. Растворим в воде (г / 100 г): 4,6 (0 °C), 15,1 (25 °C), 37,7 (50 °C), незначительно растворим в этаноле. Сильный окислитель.
В кислой среде восстанавливается до солей хрома (III). Например, он окисляет галогенид-ионы галогенводородных кислот до свободных галогенов:
Также в кислой среде при pH 3,0—3,5 обладает способностью окислять металлическое серебро:
6Ag + Cr2O7 2− + 14H + ⟶ 6Ag + + 2Cr 3 + + 7H2O
Кристаллический дихромат калия при нагревании с серой и углеродом восстанавливается до оксида хрома (III):
Водные растворы дихромата калия обладают дубящими свойствами, в частности, задубливают желатину.
Получение
Получают действием хлорида калия на дихромат натрия:
2KCl + Na2Cr2O7 ⟶ K2Cr2O7 + 2NaCl
Применение
Применяется при производстве красителей, при дублении кож и овчин, как окислитель в спичечной промышленности, пиротехнике, фотографии, живописи. Раствор хромпика в серной кислоте (т. н. хромовую смесь) применяют для мытья стеклянной посуды в лабораториях. В лабораторной практике используется в качестве окислителя, в том числе в аналитической химии (хроматометрия).
В чёрно-белой фотографии применяется в качестве отбеливателя для удаления металлического серебра из эмульсии. Не применяется в цветной фотографии, так как для отбеливания требует кислой среды, а при pH ⩽ 4 красители, образовавшиеся в эмульсии при цветном проявлении, обесцвечиваются. Вместо этого в цветной фотографии для отбеливания используются составы на основе гексацианоферрата III калия и железной соли трилона Б.
Безопасность
Высокотоксичен, канцерогенен, аллерген, брызги его раствора разрушают кожные покровы, дыхательные пути и хрящевые ткани. Среди соединений шестивалентного хрома наиболее токсичен. ПДК составляет 0,01 мг/м³ (в пересчёте на CrO3). При работе с дихроматом калия необходимо применять защиту органов дыхания и кожи.
Ионно молекулярное уравнение k2cr2o7 koh
Напишите уравнения полуреакций, ионные и молекулярные уравнения реакций, соответствующих заданным превращениям
KClO3 + MnO2 + KOH ® MnO42–, Cl–
Na3AsO3 + K2Cr2O7 + H2SO4 ® AsO43–, Cr3+
Информация
Посетители, находящиеся в группе Гости, не могут оставлять комментарии к данной публикации.
http://chem.ru/dihromat-kalija.html
http://znaniya.site/himiya/2403652.html