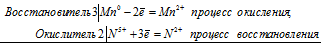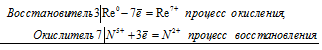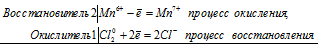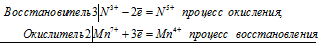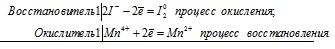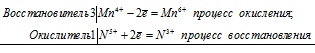Химические свойства марганца
Задание 417
Марганец окисляется азотной кислотой до низшей степени окисления, а рений приобретает высшую степень окисления. Какие соединения при этом получаются? Составьте электронные и молекулярные уравнения соответствующих реакций.
Решение:
а) Марганец взаимодействует с азотной кислотой с образованием нитрата марганца (II) оксида азота (II)
3Mn 0 + 2N 5+ = 3Mn 2+ + 2N 2+
б) Рений окисляется азотной кислотой до высшей степени окисления. При этом образуются рениевая кислота HReO4 и оксид азота (II) NO:
3Re 0 + 7N 5+ = 3Re 2+ + 7N 2+
Задание 418
Хлор окисляет манганат калия К2MnO4. Какое соединение при этом получается? Как меняется окраска раствора в результате этой реакции? Составьте электронные и молекулярное уравнения реакции.
Решение:
При окислении хлором манганата калия образуются перманганат калия и хлорид калия:
2Mn 6+ + Сl2 0 = 2Mn 7+ + 2Cl —
Манганат-ионы MnO4 2- окрашивают раствор в ярко-зелёный цвет, перманганат-ионы MnO4 — в красно-фиолетовый. Поэтому при окислении манганата калия хлором раствор изменяет окраску с ярко-зелёного на красно-фиолетовый цвет.
Задание 419
Как меняется степень окисления марганца при восстановлении КМпО4 в кислой, нейтральной и щелочной средах? Составьте электронные и молекулярное уравнения реакций между КМпО4 и KNO2 в нейтральной среде.
Решение:
Степень окисления марганца при восстановлении КМпО4 в кислой, нейтральной и щелочной средах меняется следующим образом: в кислой среде марганец уменьшает свою степень окисления от +7 до +2 (перманганат-ион MnO4 — превращается в ион Mn 2+ ); в нейтральной среде марганец уменьшает свою степень окисления от +7 до +4 (ион MnO4- восстанавливается до MnO2); в щелочной среде марганец уменьшает свою степень окисления от +7 до +6 (ион MnO4 — превращается в ион MnO4 2- ).
Электронные и молекулярное уравнения реакций между КМпО4 и KNO2 в нейтральной среде:
2Mn 7+ + 3N 3+ = 2Mn 4+ + 3N 5+
Задание 420
На основании электронных уравнений составьте уравнение реакции получения манганата калия K2MnO4 сплавлением оксида марганца (IV) с хлоратом калия КСlО3 в присутствии гидроксида калия. Окислитель восстанавливается максимально, приобретая низшую степень окисления.
Решение:
При сплавлении MnO2 со щёлочью ) с хлоратом калия КСlО3 в присутствии гидроксида калия образуются манганат калия, хлорид калия и вода:
3Mn 4+ + Сl 5+ = 3Mn 6+ + Cl —
Задание 421
Почему оксид марганца (IV) может проявлять и окислительные, и восстанвительные свойства? Исходя из электронных уравнений, составьте уравнения реакций:
а)МnО2 + КI + Н2SO4 = ; б)МnO2 + КNO3 + КОН = .
Решение:
Марганец в MnO2 находится в своей промежуточной степени окисления +4, поэтому в окислительно-восстановительных реакциях атом марганца в оксиде марганца (IV) может как увеличивать свою степень окисления, т.е. проявлять свойства восстановителя, так и уменьшать свою степень окисления – проявлять свойства окислителя.
а)МnО2 + КI + Н2SO4 =
Mn 4+ + 2I — = Mn 2+ + I2 0
б)МnO2 + КNO3 + КОН = .
Mn 4+ + N 5+ = Mn 6+ + N 3+
Задание 422
Для получения хлора в лаборатории смешивают оксид марганца (IV) с хлоридом натрия в присутствии концентрированной серной кислоты. Составьте электронные и молекулярное уравнения этой реакции.
Решение:
Уравнение реакции получения хлора в лаборатории
Гидролиз нитрата марганца (II)
Mn(NO3)2 — соль образованная слабым основанием и сильной кислотой, поэтому реакция гидролиза протекает по катиону.
Первая стадия (ступень) гидролиза
Полное ионное уравнение
Mn 2+ + 2NO3 — + HOH ⇄ MnOH + + NO3 — + H + + NO3 —
Сокращенное (краткое) ионное уравнение
Mn 2+ + HOH ⇄ MnOH + + H +
Вторая стадия (ступень) гидролиза
Молекулярное уравнение
MnOHNO3 + HOH ⇄ Mn(OH)2 + HNO3
Полное ионное уравнение
MnOH + + NO3 — + HOH ⇄ Mn(OH)2 + H + + NO3 —
Сокращенное (краткое) ионное уравнение
MnOH + + HOH ⇄ Mn(OH)2 + H +
Среда и pH раствора нитрата марганца (II)
В результате гидролиза образовались ионы водорода (H + ), поэтому раствор имеет кислую среду (pH
Acetyl
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH — | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | — | — | Н | Н | Н | |
| F — | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | — | Н | Р | Р |
| Cl — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | — | — | — | Н | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | — | Н | ? | Н | Н | ? | М | М | — | Н | ? | ? |
| HSO3 — | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Р | Р |
| HSO4 — | Р | Р | Р | Р | Р | Р | Р | Р | — | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р |
| NO2 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO — | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | Р | — | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
| Растворимые (>1%) | Нерастворимые ( Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую: 8(906)72 3-11-5 2 Скопируйте эту ссылку, чтобы разместить результат запроса » » на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Если вы считаете, что результат запроса » » содержит ошибку, нажмите на кнопку «Отправить». Этим вы поможете сделать сайт лучше. К сожалению, регистрация на сайте пока недоступна. На сайте есть сноски двух типов: Подсказки — помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация — такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Здесь вы можете выбрать параметры отображения органических соединений. источники: http://chemer.ru/services/hydrolysis/salts/Mn(NO3)2 http://acetyl.ru/o/nmn11n1o32.php |