Составьте молекулярное и ионные уравнения реакции гидролиза нитрита натрия.
Ваш ответ
решение вопроса
Похожие вопросы
- Все категории
- экономические 43,297
- гуманитарные 33,622
- юридические 17,900
- школьный раздел 607,223
- разное 16,830
Популярное на сайте:
Как быстро выучить стихотворение наизусть? Запоминание стихов является стандартным заданием во многих школах.
Как научится читать по диагонали? Скорость чтения зависит от скорости восприятия каждого отдельного слова в тексте.
Как быстро и эффективно исправить почерк? Люди часто предполагают, что каллиграфия и почерк являются синонимами, но это не так.
Как научится говорить грамотно и правильно? Общение на хорошем, уверенном и естественном русском языке является достижимой целью.
Гидролиз нитрита натрия
NaNO2 — соль образованная сильным основанием и слабой кислотой, поэтому реакция гидролиза протекает по аниону.
Молекулярное уравнение
NaNO2 + HOH ⇄ HNO2 + NaOH
Полное ионное уравнение
Na + + NO2 — + HOH ⇄ HNO2 + Na + + OH —
Сокращенное (краткое) ионное уравнение
NO2 — + HOH ⇄ HNO2 + OH —
Среда и pH раствора нитрита натрия
В результате гидролиза образовались гидроксид-ионы (OH — ), поэтому раствор имеет щелочную среду (pH > 7).
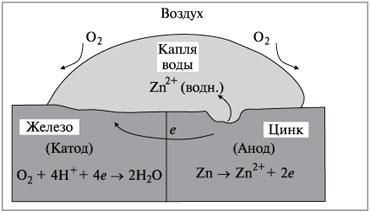
Схема оцинкованного железа(1)
Задание 285.Составьте молекулярное и ионно-молекулярное уравнение гидролиза NaNO2 и Fe(NO3)3.Указать область рН растворов.
Ответ. NaNO2— нитрит натрия — соль, образованная сильным основанием (NaOH) и слабой кислотой (HNO2), подвергается гидролизу по аниону. Реакция среды щелочная (pH > 7).
NaNO2+ HOH 
Ионное уравнение гидролиза: Na + + NO2 — +HOH 
NO2 — +HOH 
Fe(NO3)3— нитрат железа (III)- соль, образованная слабым трехкислотным основанием и сильной кислотой. Гидролиз происходит по катиону, рН 
Fe(NO3)3+ HOH 
Fe 3+ + HOH 
FeОН(NO3)2 + HOH 
Fe ОН 2+ + HOH 
Fe(ОН)2 NO3 + HOH 
Fe(ОН)2 + + HOH 
Задание 310. Плотность раствора с массовой долей гидроксида натрия 10 % равна 1,1 г/мл. Сколько граммов NaOH потребуется для приготовления этого раствора объемом 40 мл? Какова его молярная концентрация?
| w(NaOH) =10% r = 1,1 г/мл V(р-ра)=40 мл |
| Найти:m(NaOH)-? СМ -? |
Массовая доля растворенного вещества–отношение массы растворенного вещества mв к общей массе раствора mр-ра: w = (mв/ mр-ра)•100% (1)
Найдем массу раствора: m(р-ра)= r • V=1,1•40=44 г, найдем массу гидроксида натрия в этом растворе, используя формулу (1)
m(NaOH)= w• mр—ра=44•0,1=4,4г. Найдем молярную концентрацию: С=n/V. n(NaOH)=m/M=4,4/40=0,11моль, тогда с=0,11/(40•10 -3 )=2,75 моль/л.
Молярную концентрацию можно найти и следующим образом.
Для перехода от молярной к процентной концентрации используем формулу 

СМ = 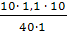
Задание335. Чему равно давление насыщенного пара над 14% -ным водным раствором карбамида СО(NН2)2 при 100 0 С?
Ответ.Закон Рауля гласит, что парциальное давление насыщенного пара компонента раствора прямо пропорционально его мольной доле в растворе, причем коэффициент пропорциональности равен давлению насыщенного пара над чистым компонентом. Р = Хi *Р 0 , где Р парциальное давление компонента, Хi – мольная доля компонента, Р 0 – давление пара чистого компонента . Поскольку сумма мольных долей всех компонентов раствора равна единице, для бинарного раствора, состоящего из компонентов А и В легко получить следующее соотношение, также являющееся формулировкой первого закона Рауля:
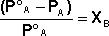
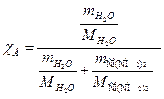

если Р°=101325Па, тогда
Р= 
1.Ахметов Н.С.Общая и неорганическая химия. — М.: Высшая школа, 1998.
2.Воробьева О.И., Тамм Н.С. Вопросы и упражнения и задачи по неорганической химии. М.: Из-во Моск.ун-та, 1985.
3.Глинка Н.Л. Общая химия. –Л.: Химия, 1977
4. Спицын В.И., Мартыненко Л.И. Неорганическая химия: В 2 т. — М.: Изд-во МГУ, 1994.
http://chemer.ru/services/hydrolysis/salts/NaNO2
http://megaobuchalka.ru/4/23995.html