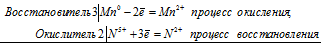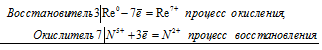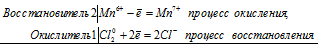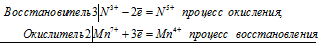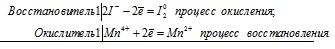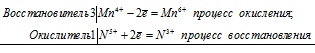Гидролиз нитрата марганца (II)
Mn(NO3)2 — соль образованная слабым основанием и сильной кислотой, поэтому реакция гидролиза протекает по катиону.
Первая стадия (ступень) гидролиза
Полное ионное уравнение
Mn 2+ + 2NO3 — + HOH ⇄ MnOH + + NO3 — + H + + NO3 —
Сокращенное (краткое) ионное уравнение
Mn 2+ + HOH ⇄ MnOH + + H +
Вторая стадия (ступень) гидролиза
Полное ионное уравнение
MnOH + + NO3 — + HOH ⇄ Mn(OH)2 + H + + NO3 —
Сокращенное (краткое) ионное уравнение
MnOH + + HOH ⇄ Mn(OH)2 + H +
Среда и pH раствора нитрата марганца (II)
В результате гидролиза образовались ионы водорода (H + ), поэтому раствор имеет кислую среду (pH
Химические свойства марганца
Задание 417
Марганец окисляется азотной кислотой до низшей степени окисления, а рений приобретает высшую степень окисления. Какие соединения при этом получаются? Составьте электронные и молекулярные уравнения соответствующих реакций.
Решение:
а) Марганец взаимодействует с азотной кислотой с образованием нитрата марганца (II) оксида азота (II)
3Mn 0 + 2N 5+ = 3Mn 2+ + 2N 2+
б) Рений окисляется азотной кислотой до высшей степени окисления. При этом образуются рениевая кислота HReO4 и оксид азота (II) NO:
3Re 0 + 7N 5+ = 3Re 2+ + 7N 2+
Задание 418
Хлор окисляет манганат калия К2MnO4. Какое соединение при этом получается? Как меняется окраска раствора в результате этой реакции? Составьте электронные и молекулярное уравнения реакции.
Решение:
При окислении хлором манганата калия образуются перманганат калия и хлорид калия:
2Mn 6+ + Сl2 0 = 2Mn 7+ + 2Cl —
Манганат-ионы MnO4 2- окрашивают раствор в ярко-зелёный цвет, перманганат-ионы MnO4 — в красно-фиолетовый. Поэтому при окислении манганата калия хлором раствор изменяет окраску с ярко-зелёного на красно-фиолетовый цвет.
Задание 419
Как меняется степень окисления марганца при восстановлении КМпО4 в кислой, нейтральной и щелочной средах? Составьте электронные и молекулярное уравнения реакций между КМпО4 и KNO2 в нейтральной среде.
Решение:
Степень окисления марганца при восстановлении КМпО4 в кислой, нейтральной и щелочной средах меняется следующим образом: в кислой среде марганец уменьшает свою степень окисления от +7 до +2 (перманганат-ион MnO4 — превращается в ион Mn 2+ ); в нейтральной среде марганец уменьшает свою степень окисления от +7 до +4 (ион MnO4- восстанавливается до MnO2); в щелочной среде марганец уменьшает свою степень окисления от +7 до +6 (ион MnO4 — превращается в ион MnO4 2- ).
Электронные и молекулярное уравнения реакций между КМпО4 и KNO2 в нейтральной среде:
2Mn 7+ + 3N 3+ = 2Mn 4+ + 3N 5+
Задание 420
На основании электронных уравнений составьте уравнение реакции получения манганата калия K2MnO4 сплавлением оксида марганца (IV) с хлоратом калия КСlО3 в присутствии гидроксида калия. Окислитель восстанавливается максимально, приобретая низшую степень окисления.
Решение:
При сплавлении MnO2 со щёлочью ) с хлоратом калия КСlО3 в присутствии гидроксида калия образуются манганат калия, хлорид калия и вода:
3Mn 4+ + Сl 5+ = 3Mn 6+ + Cl —
Задание 421
Почему оксид марганца (IV) может проявлять и окислительные, и восстанвительные свойства? Исходя из электронных уравнений, составьте уравнения реакций:
а)МnО2 + КI + Н2SO4 = ; б)МnO2 + КNO3 + КОН = .
Решение:
Марганец в MnO2 находится в своей промежуточной степени окисления +4, поэтому в окислительно-восстановительных реакциях атом марганца в оксиде марганца (IV) может как увеличивать свою степень окисления, т.е. проявлять свойства восстановителя, так и уменьшать свою степень окисления – проявлять свойства окислителя.
а)МnО2 + КI + Н2SO4 =
Mn 4+ + 2I — = Mn 2+ + I2 0
б)МnO2 + КNO3 + КОН = .
Mn 4+ + N 5+ = Mn 6+ + N 3+
Задание 422
Для получения хлора в лаборатории смешивают оксид марганца (IV) с хлоридом натрия в присутствии концентрированной серной кислоты. Составьте электронные и молекулярное уравнения этой реакции.
Решение:
Уравнение реакции получения хлора в лаборатории
Напишите молекулярные и ионно-молекулярные уравнения гидролиза следующих солей и укажите реакцию среды раствора: Mn (NO3)2; Na3PO3; (NH4)2CO3.
| 🎓 Заказ №: 22170 |
| ⟾ Тип работы: Задача |
| 📕 Предмет: Химия |
| ✅ Статус: Выполнен (Проверен преподавателем) |
| 🔥 Цена: 153 руб. |
👉 Как получить работу? Ответ: Напишите мне в whatsapp и я вышлю вам форму оплаты, после оплаты вышлю решение.
➕ Как снизить цену? Ответ: Соберите как можно больше задач, чем больше тем дешевле, например от 10 задач цена снижается до 50 руб.
➕ Вы можете помочь с разными работами? Ответ: Да! Если вы не нашли готовую работу, я смогу вам помочь в срок 1-3 дня, присылайте работы в whatsapp и я их изучу и помогу вам.
⚡ Условие + 37% решения:
Напишите молекулярные и ионно-молекулярные уравнения гидролиза следующих солей и укажите реакцию среды раствора: Mn (NO3)2; Na3PO3; (NH4)2CO3.
Решение: 1) Нитрат марганца (II) Mn(NO3)2 – соль слабого многокислотного основания Mn(OH)2 и сильной кислоты HNО3. Гидролиз протекает по аниону по первой ступени. Молекулярное и ионно-молекулярное уравнения гидролиза имеют вид Mn(NО3)2 + Н2О = (MnOH)NО3 + НNO3;
Научись сам решать задачи изучив химию на этой странице:
|
Услуги:
|
Готовые задачи по химии которые сегодня купили:




















































Образовательный сайт для студентов и школьников
Копирование материалов сайта возможно только с указанием активной ссылки «www.lfirmal.com» в качестве источника.
© Фирмаль Людмила Анатольевна — официальный сайт преподавателя математического факультета Дальневосточного государственного физико-технического института
http://buzani.ru/zadachi/khimiya-shimanovich/994-svojstva-margantsa-zadaniya-417-422
http://lfirmal.com/%D0%9D%D0%B0%D0%BF%D0%B8%D1%88%D0%B8%D1%82%D0%B5-%D0%BC%D0%BE%D0%BB%D0%B5%D0%BA%D1%83%D0%BB%D1%8F%D1%80%D0%BD%D1%8B%D0%B5-%D0%B8-%D0%B8%D0%BE%D0%BD%D0%BD%D0%BE-%D0%BC%D0%BE%D0%BB%D0%B5%D0%BA%D1%83-13/