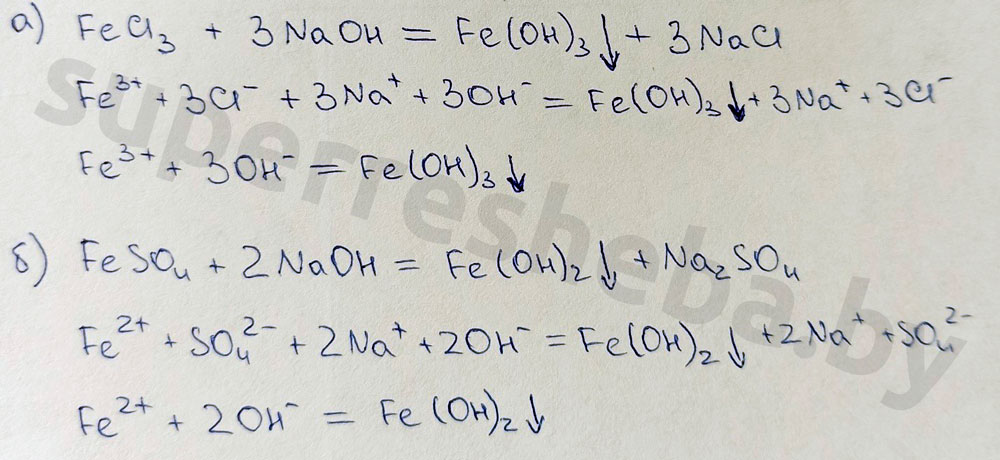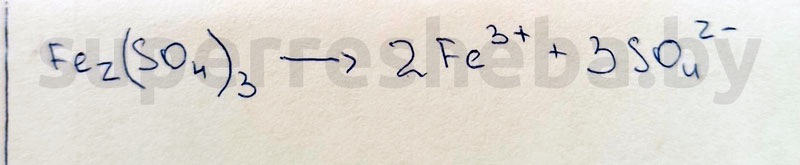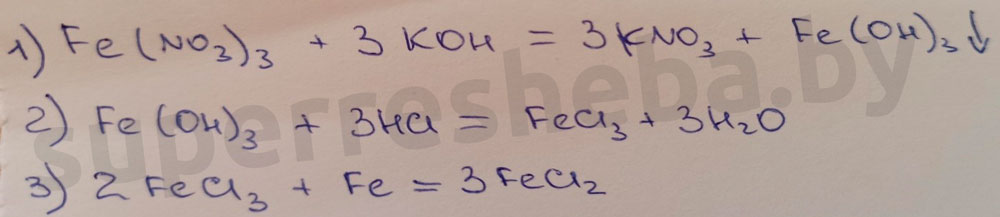Ионно молекулярные уравнения реакций с железом
Реакции с образованием малорастворимых веществ (осадков).
Составим молекулярное и ионно-молекулярные уравнения реакции между растворами хлорида железа(III) и гидроксида натрия.
1. Запишем молекулярное уравнение и подберем коэффициенты:
2. Найдем вещество, которое вызывает протекание реакции. Это Fe(OH)3. Ставим знак осадка ↓:
3. Укажем силу основания и растворимость солей:
растворимая сильное осадок растворимая
соль основание соль
4. Запишем полное ионно-молекулярное уравнение (в виде ионов представляем растворимые соли и сильное основание):
Fe 3+ + 3Cl – + 3Na + + 3OH – = Fe(OH)3↓ + 3Na + + 3Cl –
5. Подчеркнем формулы, не участвующие в реакции (это формулы одинаковых ионов в обеих частях уравнения):
Fe 3+ + 3Cl – + 3Na + + 3OH – = Fe(OH)3↓ + 3Na + + 3Cl –
6. Исключим подчеркнутые формулы и получим сокращенное ионно-молекулярное уравнение:
Сокращенное ионно-молекулярное показывает, что сущность реакции сводится к взаимодействию ионов Fe 3+ и OH – , в результате чего образуется осадок гидроксида железа(III) Fe(OH)3.
Реакции с образованием слабодиссоциирующих веществ (слабых электролитов).
Составим молекулярное и ионно-молекулярные уравнения реакции между растворами азотной кислоты и гидроксида калия.
сильная сильное растворимая слабый
кислота основание соль электролит
Полное молекулярно-ионное уравнение:
H + + NO 3 – + K + + OH – = K + NO 3 – + H2O
Сокращенное ионно-молекулярное уравнение:
Реакции с образованием газообразных веществ.
Составим молекулярное и ионно-молекулярные уравнения реакции между растворами сульфида натрия и серной кислоты.
растворимая сильная растворимая газ
соль кислота соль
Полное молекулярно-ионное уравнение:
2Na + + S 2 – + 2H + + SO 4 2 – = 2Na + + SO 4 2 – + H2S↑
Сокращенное ионно-молекулярное уравнение:
Разберем процессы, протекающие при сливании растворов нитрата калия и хлорида натрия.
растворимая растворимая растворимая растворимая
соль соль соль соль
Полное молекулярно-ионное уравнение:
K + + NO3 – + Na + + Cl – ⇄ K + + Cl – + Na + + NO3 –
В данном случае сокращенное ионно-молекулярное уравнение написать нельзя: согласно теории электролитической диссоциации, реакция не протекает. Если такой раствор выпарить, то получим смесь четырех солей: KNO3, NaCl, KCl, NaNO3.
Схемы превращений веществ. Составление уравнений реакций превращений железа
Задание 237.
Составьте уравнения реакций, которые надо провести для осуществления следующих превращений:
Fe → FeSO4 → Fe(OH)2 → Fe(OH)3 → FeCl3
Решение:
Уравнения реакций, которые надо провести для осуществления следующих превращений:
Задание 429 (ш)
Составьте молекулярные и ионно-молекулярные уравнения реакций, которые надо провести для осуществления превращений:
Fe → FeCl2 → Fe(CN)2 → К4[Fe(CN)6] → К3[Fe(CN)6]
К окислительно-восстановительным реакциям составьте электронные уравнения.
Решение:
Молекулярные и ионно-молекулярные уравнения реакций, которые надо провести для осуществления превращений: Fe → FeCl2 → Fe(CN)2 → К4[Fe(CN)6] → К3[Fe(CN)6]
а) Fe + 2HCl = FeCl2 + H2↑ (молекулярная форма);
Fe + 2H + = Fe 2+ + H2 0 (ионно-молекулярная форма).
б) FeCl2 + 2KCN = Fe(CN)2↓ + 2KCl (молекулярная форма);
Fe 2+ + 2CN — = Fe(CN)2↓ (ионно-молекулярная форма).
в) В избытке цианида калия осадок Fe(CN)2 растворяется вследствие образования комплексного соединения К4[Fe(CN)6]:
Fe(CN)2 + 4KCN → К4[Fe(CN)6] (молекулярная форма);
Fe(CN)2 + 4CN — → [Fe(CN)6] 4- (ионно-молекулярная форма).
г) При действии хлора или брома на раствор жёлтой кровяной соли анион [Fe(CN)6] 4- превращается в анион [Fe(CN)6] 3- :
Данная реакция является окислительно-восстановительной, так как атом железа увеличивает свою степень окисления от +2 до +3, т. е. проявляет свойства восстановителя; атомы хлора уменьшают свою степень окисления от 0 до -1, т. е. проявляют свойства окислителя:
Лаб. 13
Составьте уравнение химических реакций обнаружения ионов железа в молекулярном и ионном виде:
Составьте уравнения химических реакций в молекулярном виде, назовите продукты реакций.
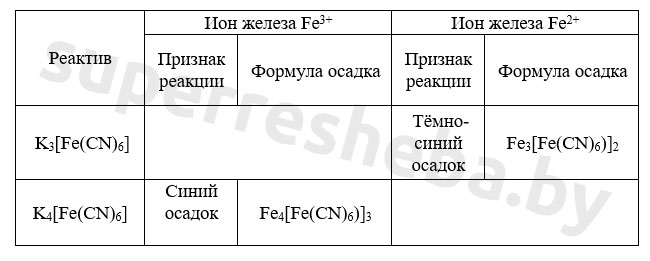
В результате качественных реакций на ионы железа со щелочью мы наблюдаем выпадение бурого осадка гидроксида железа (III) и белого осадка гидроксида железа (II). А в результате реакций с гексацианоферратами калия образуются осадки синего цвета: турнбулева синь и берлинская лазурь. Все реакции протекают в растворе или расплаве.
1. Составьте уравнение электролитической диссоциации сульфата железа (III).
2. Укажите возможные степени окисления железа и приведите формулы соответствующих веществ.
+6 – H2FeO4 (в свободном виде не существует)
3. Как доказать качественный состав сульфата железа (II). Составьте уравнения химических реакций
4. Составьте уравнения химических реакций для осуществления превращений F e ( N O 3 ) 3 → F e ( O H ) 3 → F e C l 3 → F e C l 2 . \mathrm
5. В пробирки с растворами солей по каплям добавили гидроксид натрия до появления признаков реакции. Заполните таблицу, указав признаки возможных реакций.
http://buzani.ru/zadachi/obshchaya-khimiya/871-uravneniya-reaktsij-prevrashchenij-zheleza-zadanie-237
http://superresheba.by/resh/54061