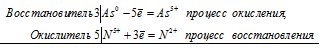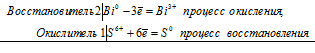Степени окисления мышьяка, сурьмы и висмута
Задание 379
Какую степень окисления проявляют мышьяк, сурьма и висмут? Какая степень окисления является более характерной для каждого из них? Составьте электронные и молекулярные уравнения реакций: а) мышьяка с концентрированной азотной кислотой; б) висмута с концентрированной серной кислотой.
Решение:
Мышьяк, сурьма и висмут имеют конфигурацию внешнего электронного слоя …ns 2 p 3 , поэтому могут проявлять степень окисления -3, +3 и +5. Для мышьяка характерными степенями окисления являются -3, +3, +5(AsH3, As2O3, H3AsO4). Для сурьмы характерными степенями являются +3, +5(SbCl3, Sb2O5). Для висмута характерной степенью окисления является +3 [соли Bi 3+ , особенно Bi(NO3)3].
а) реакция мышьяка с концентрированной азотной кислотой:
3As 0 + 5N 5+ = 3As 5+ + 5N 3+
б) реакция висмута с концентрированной серной кислотой:
2Bi 0 + S 6+ = 2Bi 3+ + S 0
Задание 383
К раствору, содержащему SbCl3 и ВiСI3, добавили избыток раствора гидроксида калия. Напишите молекулярные и ионно-молекулярные уравнения происходящих реакций. Какое вещество находится в осадке?
Решение:
Уравнения реакций КОН с SbCl3 и ВiСI3
Если к растворам, содержащих SbCl3 и ВiСI3, прилить избыток раствора гидроксида калия, то произойдёт образование осадков соответствующих гидроксидов сурьмы и висмута, а также хлорида калия:
а) 3КОН + SbCl3 = Sb(OH)3 ↓ + 3KCl (молекулярная форма);
Sb 3+ + 3OH — = Sb(OH)3 ↓ (ионно-молекулярная форма);
б) 3КОН + ВiСI3 = Bi(OH)3 ↓ + 3KCl (молекулярная форма);
Bi 3+ + 3OH- = Bi(OH)3 ↓ (ионно-молекулярная форма)
Так как КОН взят в избытке, то амфотерный гидроксид сурьмы (III) Sb(OH)3 будет растворяться в избытке КОН с образованием комплексного иона [Sb(OH)6] 3- :
Суммировав уравнение (а) и (в) получим:
г) SbCl3 + 6KOH = K3[Sb(OH)6] + 3KCl (молекулярная форма);
д) Sb 3+ + 3OH — = [Sb(OH)6]3— (ионно-молекулярная форма)
Таким образом, при действии на растворы SbCl3 и ВiСI3 избытком КОН образуются растворимое комплексное соединение K3[Sb(OH)6] (в случае с SbCl3) и нерастворимый гидроксид висмута (III) Bi(OH)3.
Написать ионно-молекулярные реакции между соединениями: нитратом висмута (III) и арсенатом натрия
| 🎓 Заказ №: 22202 |
| ⟾ Тип работы: Задача |
| 📕 Предмет: Химия |
| ✅ Статус: Выполнен (Проверен преподавателем) |
| 🔥 Цена: 153 руб. |
👉 Как получить работу? Ответ: Напишите мне в whatsapp и я вышлю вам форму оплаты, после оплаты вышлю решение.
➕ Как снизить цену? Ответ: Соберите как можно больше задач, чем больше тем дешевле, например от 10 задач цена снижается до 50 руб.
➕ Вы можете помочь с разными работами? Ответ: Да! Если вы не нашли готовую работу, я смогу вам помочь в срок 1-3 дня, присылайте работы в whatsapp и я их изучу и помогу вам.
⚡ Условие + 37% решения:
Написать ионно-молекулярные реакции между соединениями: нитратом висмута (III) и арсенатом натрия
Решение: Молекулярное уравнение реакции Bi(NO3 ) 3 Na3AsO4 3NaNO3 BiAsO4
Научись сам решать задачи изучив химию на этой странице:
|
Услуги:
|
Готовые задачи по химии которые сегодня купили:




















































Образовательный сайт для студентов и школьников
Копирование материалов сайта возможно только с указанием активной ссылки «www.lfirmal.com» в качестве источника.
© Фирмаль Людмила Анатольевна — официальный сайт преподавателя математического факультета Дальневосточного государственного физико-технического института
Методические указания к лабораторному практикуму по курсу «Химия» (стр. 5 )
 | Из за большого объема этот материал размещен на нескольких страницах: 1 2 3 4 5 6 7 8 9 10 |
Выполнение опыта. В две пробирки внести по 3 – 5 капель 1н растворов: в одну – хлорида аммония, в другую – ацетата натрия. В обе пробирки добавить по 2 ‑ 3 капли нейтрального лакмуса и отметить изменение его окраски (табл. п. 3.4). Определить рН раствора с помощью универсального индикатора. Написать в ионном и молекулярном виде уравнения гидролиза обеих солей. Указать реакцию среды в растворах, случай и форму гидролиза.
Опыт 2. Ступенчатый гидролиз солей, образованных различными по силе основанием и кислотой
В зависимости от основности кислоты и кислотности основания, образующих соль различают следующие формы гидролиза:
Простой гидролиз характерен для солей, образованных слабым однокислотным основанием и (или) слабой одноосновной кислотой. При этом гидролиз обратим и протекает по одной ступени.
Ступенчатый гидролиз характерен для солей, образованных слабым многокислотным основанием и (или) слабой многоосновной кислотой. При этом гидролиз обратим и протекает по нескольким ступеням. В наибольшей степени гидролиз протекает по первой ступени. Многозарядный катион или анион постепенно присоединяет к себе ОН — или Н+, образуя основные или кислые соли.
Гидролиз по катиону:
I ступень
II ступень:
III ступень: 
Гидролиз по аниону:
I ступень: 
II ступень: 
Накапливающиеся в системах ионы H+ или ОН — обеспечивают кислую или щелочную реакцию среды и сильно смещают процесс диссоциации воды 
Выполнение опыта. В две пробирки внести по 5 – 10 капель 1М растворов: в одну – карбоната (или сульфида) натрия, в другую – хлорида (или сульфата) алюминия. В обе пробирки добавить по 2 ‑ 3 капли нейтрального лакмуса и отметить изменение его окраски (табл. п. 3.4). Определить рН растворов с помощью универсального индикатора. Написать в ионном и молекулярном виде уравнения гидролиза обеих солей. Указать реакцию среды в растворах, случай и форму гидролиза. Назовите соли, образующиеся по первой ступени гидролиза в каждом случае.
Опыт 3. Гидролиз солей, образованных слабым основанием и слабой летучей кислотой. Полный необратимый гидролиз
Некоторые соли, образованные очень слабым основанием и слабой летучей кислотой (Cr2S3, Al2S3, Cr2(CO3)3, Fe2(CO3)3, Al2(CO3)3 и др.), при нагревании в присутствии воды подвергаются полному необратимому гидролизу. При этом образуются слабо диссоциирующие основание и кислота. Оба продукта уходят из сферы реакции в виде осадков и газов. Аналогично гидролизуются смеси солей, одна из которых образована очень слабым основанием и сильной кислотой, а другая – сильным основанием и слабой летучей кислотой (Na2S + CrCl3, Na2CO3 + Al2(SO4)3 и т. п.). Например:

Выполнение опыта. В две пробирки внести по 5 – 10 капель 1М растворов: в одну – хлорида или сульфата хрома, в другую – хлорида (или сульфата) алюминия. В первую пробирку прибавить раствор сульфида натрия, во вторую — раствор карбоната натрия до выпадения осадков малорастворимых соединений. Отметить выделение газа. Какие это газы?
Написать уравнения гидролиза смесей солей в молекулярном и ионном виде. Доказать, что в осадке гидроксиды, а не сульфид хрома или карбонат алюминия. Для этого слить растворы с полученных осадков, разделить каждый из осадков на две пробирки, в одну из них добавить раствор щелочи, а в другую раствор кислоты. Наблюдать растворение осадков во всех пробирках. Объяснить наблюдаемые процессы. Почему при взаимодействии растворов этих солей гидролиз протекает практически необратимо? Каков механизм взаимного усиления гидролиза?
КОЛИЧЕСТВЕННЫЕ ХАРАКТЕРИСТИКИ ПРОЦЕССА ГИДРОЛИЗА
Степень h, константа гидролиза Kгидр и pH раствора зависят от силы (константы диссоциации) слабого электролита, от случая гидролиза (по катиону, аниону, или по катиону и аниону), а также в первых двух случаях от концентрации раствора:

http://lfirmal.com/%D0%9D%D0%B0%D0%BF%D0%B8%D1%81%D0%B0%D1%82%D1%8C-%D0%B8%D0%BE%D0%BD%D0%BD%D0%BE-%D0%BC%D0%BE%D0%BB%D0%B5%D0%BA%D1%83%D0%BB%D1%8F%D1%80%D0%BD%D1%8B%D0%B5-%D1%80%D0%B5%D0%B0%D0%BA%D1%86%D0%B8%D0%B8/
http://pandia.ru/text/78/670/21782-5.php