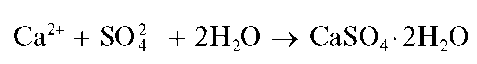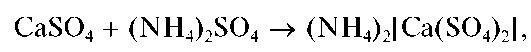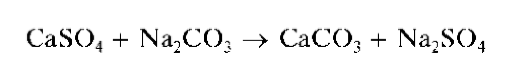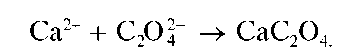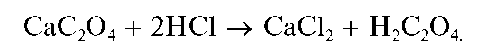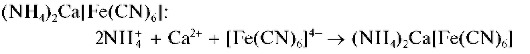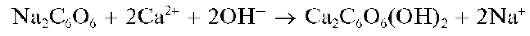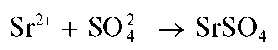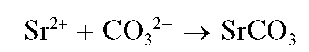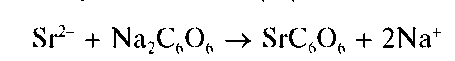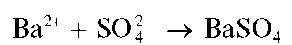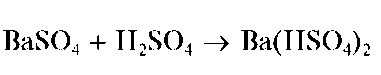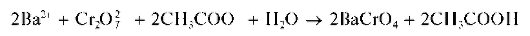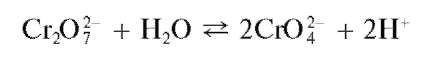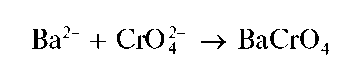Частные реакции катионов третьей аналитической группы
Реакции катиона бария Ba 2+
1. Реакция окрашивания пламени. Летучие соли бария окрашивают пламя газовой горелки в желто-зеленый цвет. Реакция является фармакопейной.
Выполнение реакции. Соль бария (лучше BaCl2 ) смачивают хлороводородной кислотой и вносят в основание пламени на тонкой платиновой проволоке или на грифеле, а затем переводят в зону пламени с наивысшей температурой.
2. Разбавленная серная кислота H2SO4 и растворимые сульфаты выделяют даже из очень разбавленных растворов осадок сульфата бария:
BaCl2 + H2SO4 
Ba 2+ + SO4 2- 
Осадок не растворяется в кислотах и щелочах. Реакция является фармакопейной.
Выполнение реакции. К одной капле раствора соли бария добавляют одну каплю разбавленной серной кислоты.
3. Карбонат аммония (NH4)2CO3 или другой растворимый карбонат с солями бария дает белый осадок карбоната бария:
BaCl2 + (NH4)2CO3 
Ba 2+ + CO3 2- 
Осадок растворим в разбавленных минеральных кислотах и в уксусной кислоте (но не в серной, так как в этом случае образуется нерастворимый сульфат бария). Осаждение следует вести в слабощелочной среде, лучше в аммиачной.
Выполнение реакции. В пробирку помещают 2 капли раствора BaCl2 или Ba(NO3)2, добавляют 1 каплю разбавленного раствора аммиака и 2 капли раствора карбоната аммония.
4. Хромат калия K2CrO4 или натрия Na2CrO4 осаждает из нейтральных или уксуснокислых растворов бариевой соли хромат бария желтого цвета:
BaCl2 + K2CrO4 
Ba 2+ + CrO4 2- 
Выполнение реакции. К одной капле раствора бариевой соли добавляют 1 каплю раствора хромата калия.
5. Дихромат калия K2Cr2O7 осаждает из растворов солей бария также желтый осадок BaCrO4:
2BaCl2 + K2Cr2O7 + H2O 

2Ba 2+ + Cr2O7 2- + H2O 

Осадок BaCrO4 растворим в сильных кислотах, поэтому реакция не доходит до конца (сильная кислота HCl образуется в результате самой реакции). Если к раствору добавить ацетат натрия, хлороводородная кислота будет замещена слабой уксусной кислотой
CH3COONa + HCl 
И реакция практически дойдет до конца.
Выполнение реакции. К 1-2 каплям раствора бариевой соли добавляют 2 капли раствора ацетата натрия и 2 капли раствора дихромата калия.
6. Оксалат аммония (NH4)2C2O4 образует с солями бария белый осадок, растворимый в хлороводородной и азотной кислотах, а в уксусной кислоте только при кипячении:
BaCl2 + (NH4)2C2O4 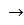
Ba 2+ + C2O4 2- 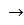
Выполнение реакции. К 2 каплям раствора соли бария добавляют 2 капли раствора оксалата аммония.
Реакции катиона Ca 2+
1. Реакция окрашивания пламени. Летучие соли кальция окрашивают бесцветное газовое пламя в кирпично-красный цвет. Реакция является фармакопейной.
Выполнение реакции. Реакция выполняется так же, как описано для катиона бария.
2. Разбавленная серная кислота H2SO4 образует с ионом кальция белый осадок сульфата кальция:
CaCl2 + H2SO4 
Ca 2+ + SO4 2- 
Вследствие достаточно высокой растворимости сульфата кальция (2 г/л) осаждение возможно только из достаточно концентрированных растворов солей кальция. Более полное осаждение сульфата происходит при добавлении к раствору этилового спирта.
Выполнение реакции. К 3 каплям раствора соли кальция добавляют 3-4 капли разбавленной серной кислоты. К помутневшему раствору приливают 8-10 капель этилового спирта. Наблюдают выделение осадка.
3. Карбонат аммония (NH4)2CO3 осаждает карбонат кальция в виде осадка белого цвета:
CaCl2 + (NH4)2CO3 
Ca 2+ + CO3 2- 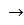
Для полного осаждения кальция необходим достаточный избыток осадителя. Осадок растворим в разбавленных минеральных кислотах и в уксусной кислоте. Осаждение следует проводить в аммиачной среде.
Выполнение реакции. В пробирку помещают 2 капли раствора соли кальция, добавляют 1 каплю разбавленного раствора аммиака и 2 капли раствора карбоната аммония.
4. Оксалат аммония (NH4)2C2O4 дает на холоду в нейтральных и слабощелочных растворах белый мелкокристаллический осадок оксалата кальция:
CaCl2 + (NH4)2C2O4 
Ca 2+ + C2O4 2- 
Осадок не растворим в уксусной кислоте, но легко растворим в минеральных кислотах. Реакцию с оксалатом аммония нельзя проводить в присутствии солей бария, так как ион Ba 2+ образует с оксалатом аммония белый осадок ВaC2O4.
Это наиболее важная качественная реакция иона Са 2+ . Она является фармакопейной.
Выполнение реакции. К 2 каплям раствора хлорида кальция добавляют 2 капли раствора оксалата аммония.
5. Гексацианоферрат (II) калия (желтая кровяная соль К4[Fe(CN)6]) с солями кальция образует в слабощелочной среде белый кристаллический осадок, нерастворимый в уксусной кислоте:
CaCl2 + К4[Fe(CN)6] + NH4Cl 
Ca 2+ + K + + NH4 + + [Fe(CN)6] 3- 
В присутствии значительных количеств иона Ba 2+ не рекомендуется применять эту реакцию для открытия ионов Ca 2+ , так как ион Ba 2+ при достаточном количестве может дать осадок с К4[Fe(CN)6].
Выполнение реакции. В пробирку помещают 2 капли раствора хлорида кальция, добавляют 1 каплю раствора хлорида аммония и 2 капли раствора аммиака до щелочной реакции и нагревают 1-2 минуты на водяной бане. К горячему раствору прибавляют 5-6 капель 0,5 М раствора желтой кровяной соли. Вновь нагревают 2-3 минуты на водяной бане. Реакция менее чувствительна, чем с оксалатом аммония.
6. Микрокристаллоскопическая реакция. Разбавленная серная кислота образует с солями кальция иглообразные кристаллы СaSO4*2H2O.
Выполнение реакции. На предметное стекло помещают одну каплю раствора соли кальция и рядом одну каплю разбавленной серной кислоты. Соединяют стеклянной палочкой обе капли и слегка подсушивают (но не высушивают досуха!) над огнем до появления каемки по краям капли. Образующиеся кристаллы рассматривают под микроскопом.
Задания для самостоятельной работы
учащихся по теме:
«Катионы 3 аналитической группы, анализ смеси катионов 1,2,3 аналитических групп»
1.Какие катионы относятся к третьей аналитической группе . Назовите групповой реагент третьей аналитической группы.
2.Какую роль в организме человека играют ионы Ca 2+ ,Ba 2+ . Какие соли этих катионов используются в медицине.
3.Напишите в молекулярном и ионном виде реакции обнаружения на катион Ba 2+ .
4.Допишите реакцию взаимодействия:
а) Pb(NO3)2 + 2KOH
б) Pb(NO3)2 + K2CrO4
в) CaCl2 + H2SO4
г) CaCl2 + (NH4)2CO3
д) CaCl2 + (NH4)2C2O4
е) CaCl2 + К4[Fe(CN)6] + NH4Cl
5.На какой из катионов 3 аналитической группы проводится микроскопическая реакция. Опишите ее выполнение.
6.Какой катион второй группы при систематическом анализе смеси катионов 1,2,3 групп может оказаться вместе с катионами третьей группы
7.Почему сульфаты катионов третьей аналитической группы необходимо превращать в карбонаты
8.Какой реактив в качестве катализатора следует добавить в реакционную среду при взаимодействии серной кислоты и Са 2+ для полного осаждения продукта реакции?
9. В какой цвет окрашивают пламя горелки соли бария?
а) зеленый в) кирпично-красный
б) фиолетовый г) желто-зеленый
10.В каком реактиве растворяется осадок, образующийся в реакции хромата калия с солями бария?
—>Аналитические группы катионов —>
III аналитическая группа: Ca 2+ ,Sr 2+ ,Ba 2+
При действии группового реагента (водного раствора серной кислоты ^SO.j) катионы третьей аналитической группы осаждаются в виде малорастворимых в воде сульфатов кальция CaSO4,стронцияSrSO4 и бария BaSO4 (свинец осаждается в виде сульфата PbSO4). Числовые значения произведений растворимости этих сульфатов при комнатной температуре равны: Ks°(CaSO4) = 2,5 10 -5 ,Ks° (SrSO4) = 3,2 10 -7 , Ks°(BaSO4) = 1,110 -10 ,Ks°(PbSO4) = 1,6 10 -8 . При действии группового реагента катионы кальция неполностью осаждаются из водного рас-творавформеосадкасульфата кальция — частьионов Ca 2 + остается в растворе. Для более полного осаждения катионов кальция в форме сульфата кальция при действии группового реагента к анализируемому раствору прибавляют этанол, в присутствии которого растворимость сульфата кальция уменьшается.
Сульфаты кальция, стронция и бария практически нерастворимы в разбавленных кислотах, щелочах. Сульфат бария заметно растворяется в концентрированной серной кислоте с образованием кислой соли Ba(HSO4)2 Сульфат кальция растворим в водном растворе сульфата аммония (NH4)2SO4 с образованием комплекса (NH4)2[Ca(SO4)2]; сульфаты стронция и бария — не растворяются.
Аналитические реакции катиона кальция Ca 2+
Реакция с сульфат-ионами. Катионы кальция образуют с сульфат-ионами SO4 2- белый осадок малорастворимого в воде сульфата кальция, который при медленной кристаллизации выделяется в форме игольчатых кристаллов гипса — дигидрата сульфата кальция-CaSO4*2H2O:
Для увеличения полноты осаждения к раствору прибавляют равный объем этанола — в водно-этанольной среде растворимость сульфата кальция уменьшается по сравнению с растворимостью в чистой воде.
Осадок сульфата кальция нерастворим в кислотах и щелочах, но растворяется в насыщенном водном растворе сульфата аммония с образованием комплекса (NH4)2[Ca(SO4)2]:
что позволяет отделить катионы Ca 2+ от катионов Sr 2+ иBa 2+ .
При нагревании с растворимыми карбонатами, например, с раствором соды Na2CO3, белый осадок сульфата кальция переходит в белый же осадок карбоната кальция:
Карбонат кальция растворим в кислотах, поэтому нагревание CaSO4 с раствором соды с последующим растворением образующегося CaCO3 используют для отделения катионов кальция (вместе с катионами стронция и бария) от других катионов и перевода их в раствор.
Реакцию катионов кальция с сульфат-ионами обычно проводят как микрокристаллоскопическую. Предельное разбавление равно 2,5-10 4 мл/г.
Методика. Каплю раствора хлорида кальция CaCl2 наносят на предметное стекло, прибавляют каплю раствора серной кислоты и слегка упаривают смесь. Под микроскопом наблюдают образовавшиеся игольчатые кристаллы гипса CaSO4•2H2Oв виде красивых сросшихся пучков или звездочек.
Реакция с оксалатом аммония (фармакопейная). Катионы Ca 2+ образуют с оксалатом аммония (NH4)2C2O4 белый кристаллический осадок оксалата кальция CaC2O4:
Реакцию проводят в слабокислой среде (рН = 6-6,5) в присутствии уксусной кислоты, в которой оксалат кальция не растворяется. В конце проведения реакции можно добавить аммиак.
Осадок CaC2O4 нерастворим в растворе аммиака, но растворяется в разбавленных минеральных кислотах с образованием щавелевой кислоты H2C2O4, например:
Открываемый минимум — около 100 мкг, предельное разбавление — 6 10 4 мл/г (подругимданным
Мешают катионы Sr 2+ ,Ba 2+ ,Mg 2+ , дающие аналогичные осадки.
Методика. В пробирку вносят 3 капли раствора CaCl2, прибавляют каплю раствора уксусной кислоты и 3 капли раствора оксалата аммония. Выпадает белый кристаллический осадок оксалата кальция.
Реакция с гексацианоферратом(П) калия. Катионы Ca 2+ образуют с гексацианоферратом(П) калия K4[Fe(CN)6] при нагревании раствора до кипения в присутствии катионов аммония белый кристаллический осадок смешанного гексацианоферрата(П) аммония и кальция Осадок нерастворим в уксусной кислоте.
Открываемый минимум равен 25 мкг, предельное разбавление — 2-10 3 мл/г.
Мешают катионы Ba 2+ и другие катионы, образующие осадки фер-роцианидов.
Методика. В пробирку вносят 3-4 капли насыщенного водного раствора CaCl2, 2-3 капли раствора аммиака. Нагревают раствор до кипения и прибавляют 5-6 капель свежеприготовленного насыщенного раствора K4[Fe(CN)6]. Выпадает белый кристаллический осадок.
Реакция сродизонатом натрия. Катионы Ca 2+ образуют со свежеприготовленным раствором родизоната натрия Na2C6O6 в щелочной среде осадок фиолетового комплекса, состав которого, по-видимому, можно описать формулой Ca2C6O6(OH)2:
Реакция довольно чувствительна: предел обнаружения — 1 мкг, предельное разбавление — 5-10 4 мл/г. Катионы Sr 2+ иBa 2+ не мешают, так как в щелочной среде не образуют осадки с родизонатом натрия.
Реакцию можно проводить капельным методом на фильтровальной бумаге.
Методика. В пробирку вносят 3-4 капли раствора CaCl2,3-4 капли раствора NaOH и
2 капли свежеприготовленного 0,2 % раствора ро-дизоната натрия. Выпадает фиолетовый осадок.
При проведении реакции на фильтровальной бумаге поступают следующим образом. На лист фильтровальной бумаги наносят каплю щелочного раствора CaCl2 и каплю свежеприготовленного 0,2 % раствора Na2C6O6 Образуется пятно (или осадок) фиолетового цвета.
Окрашивание пламени газовой горелки (фармакопейный тест). Соли (или другие соединения) кальция окрашивают пламя газовой горелки в кирпично-красный цвет.
Методика. На кончике платиновой или нихромовой проволоки, смоченной раствором HCl, вносят в пламя газовой горелки несколько кристалликов соли кальция или каплю раствора CaCl2 Пламя окрашивается в кирпично-красный цвет.
Другие реакции катионов кальция. Катионы Ca 2+ образуют также осадки при реакциях в растворах: с растворимыми карбонатами — белый осадок CaCO3 (растворяется в кислотах), с гидрофосфатом натрия
Na2HPO4 — белый CaHPO4 (растворяется в кислотах), с хроматами — желтый CaCrO4, с фторидами — белый студенистый CaF2 (малорастворимый в кислотах и разлагающийся при нагревании с концентрированной серной кислотой).
Аналитические реакции катиона стронция Sr 2+
Реакция с сульфат-ионами. Катионы Sr 2+ образуют с сульфат-ионами белый осадок сульфата стронция SrSO4:
Осадок нерастворим в щелочах, в растворе сульфата аммония (NH4)2SO4 (в отличие от сульфата кальция, который растворяется в этом реагенте).
Осадок сульфата стронция образуется и при прибавлении «гипсовой воды» (насыщенный водный раствор сульфата кальция) к растворам, содержащим соли стронция, поскольку растворимость в воде сульфата стронция ниже растворимости сульфата кальция. Добавление «гипсовой воды» приводит к образованию осадка SrSO4 лишь при нагревании; без нагревания осадок SrSO4 выделяется только при длительном стоянии. Мешают катионы Ba 2+ .
При нагревании осадка SrSO4 с раствором соды он, как и сульфат кальция, переходит в карбонат стронция SrCO3, также нерастворимый в кислотах.
а) Реакция с «гипсовой водой». В пробирку вносят 4 капли раствора хлорида стронция SrCl2, прибавляют 5-6 капель «гипсовой воды», нагревают на водяной бане и оставляют на
10-15 минут. Постепенно выделяется белый осадок сульфата стронция.
б) Реакция с серной кислотой. В пробирку вносят 1-2 капли раствора SrCl2, прибавляют 2-3 капли раствора серной кислоты. Выпадает белый кристаллический осадок сульфата стронция.
Реакция с карбонат-ионами. Катионы Sr 2+ образуют при нагревании с карбонат-ионами CO3 2- белый кристаллический осадок карбоната стронция:
Осадок растворяется в кислотах.
Методика. В пробирку вносят 3-5 капель раствора SrCl2,прибавля-ют столько же капель раствора карбоната аммония (NH4)2CO3 иосто-рожно нагревают пробирку с раствором. Выпадает белый осадок карбоната стронция.
Реакция с родизонатом натрия. Катионы Sr 2+ образуют с родизона-том натрия Na2C6O6 в нейтральной среде бурый осадок родизоната стронция, по-видимому, состава SrC6O6:
Реакцию проводят капельным методом на фильтровальной бумаге. Предел обнаружения — 7 мкг.
Катионы бария также образуют бурый осадок с родизонатом натрия. Однако родизонат стронция, в отличие от родизоната бария, растворим в хлороводородной кислоте, тогда как родизонат бария при взаимодействии с HO превращается в ярко-красный гидрородизонат бария.
Методика. На лист фильтровальной бумаги наносят каплю раствора SrCl2 и каплю свежеприготовленного 0,2 % раствора родизоната натрия. Наблюдается образование красно-бурого пятна.
На пятно наносят каплю раствора HO. Окраска пятна исчезает (в присутствии катионов бария окраска не исчезает, а переходит из бурой в ярко-красную).
Окрашивание пламени газовой горелки. Соли (и другие соединения) стронция при внесении в бесцветное пламя газовой горелки окрашивают пламя в карминово-красный цвет. Методика аналогична описанной выше для теста на другие катионы.
Другие реакции катионов стронция. Катионы Sr 2+ образуют также осадки при реакциях в растворах: c оксалатом аммония (NH4)2C2O4 — белый SrC2O4 (частично растворяется в уксусной кислоте), с гидрофосфатом натрия Na2HPO4 — белый SrHPO4 (растворяется в кислотах), с хроматом калия K2CrO4 — желтый SrCrO4 (растворяется в уксусной кислоте; реакция высокочувствительна: предел обнаружения — 0,8 мкг).
Применяют также довольно чувствительную (предельное разбавление — 10 4 мл/г) микрокристаллоскопическую реакцию образования сине-зеленых кубических кристаллов K2Sr[Cu(NO2)6].
Аналитические реакции катионов бария Ba 2+
Катионы бария Ba 2+ образуют с сульфат-ионами белый кристаллический осадок сульфата бария BaSO4:
Осадок нерастворим в щелочах и кислотах, за исключением концентрированной серной кислоты, в которой он заметно растворяется с образованием гидросульфата бария Ba(HSO4)2:
При нагревании с растворами карбонатов (например, соды Na2CO3) сульфат бария превращается в малорастворимый в воде карбонат бария BaCO3, который растворяется в кислотах.
Предел обнаружения каионов бария данной реакцией составляет 10 мкг. Мешают катионы Ca 2+ ,Sr 2+ ,Pb 2+ .
Методика. В пробирку вносят 2-3 капли раствора BaCl2,прибавля-ют по каплям раствор H2SO4 Выпадает белый мелкокристаллический осадок сульфата бария.
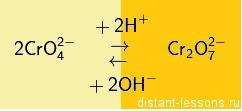
Реакция с дихромат-ионами. Катионы Ba 2+ образуют с дихромат-ионами Cr2O7 2- в присутствии ацетат-ионов желтый осадок хромата бария BaCrO4:
Образование хромата бария BaCrO4, а не дихромата BaCr2O7,вэтой реакции объясняется тем, что хромат бария менее растворим в воде, чем дихромат бария.
В водных растворах дихроматов устанавливается равновесие
В присутствии катионов Ba 2+ образуется и выпадает в осадок малорастворимый хромат BaCrO4,тогда как дихроматBa2Cr2O7 в осадок не выпадает вследствие его более высокой растворимости. В результате равновесие смещается вправо, и в растворе накапливаются ионы водорода, что, однако, препятствует более глубокому смещению равновесия. Поэтому для нейтрализации ионов водорода в раствор вводят ацетат натрия CH3COONa. Ацетат-ионы CH3COO — , образующиеся при электролитической диссоциации ацетата натрия, связывают ионы водорода в малодиссоциированную слабую уксусную кислоту CH3COOH, вследствие чего равновесие образования хромат-ионов из дихромат-ионов смещается вправо. При этом возрастает полнота осаждения хромата бария.
Осадок хромата бария растворяется в сильных кислотах, но не растворяется в уксусной кислоте.
Мешают Ag + ,Pb 2+ ,Cd 2+ ,Co 2+ ,Ni 2+ и другие катионы, дающие осадки хроматов. Катионы Ca 2+ ,Sr 2+ не мешают открытию катионов бария.
Методика. В пробирку вносят 5 капель раствора BaCl2, прибавляют 5 капель раствора дихромата калия K2Cr2O7 и 4-5 капель раствора ацетата натрия CH3COONa. Выпадает желтый кристаллический осадок хромата бария.
Хромат бария образуется также при реакции катионов Ba 2+ с хромат-ионами:
Однако при реакции с дихромат-ионами в присутствии ацетат-ионов катионы бария осаждаются практически количественно.
Реакция с родизонатом натрия. Катионы Ba 2+ реагируют с родизона-том натрия Na2C6O6 в нейтральной среде с образованием красно-бурого осадка родизоната бария:
При прибавлении раствора хлороводородной кислоты красно-бурый осадок родизоната бария превращается в ярко-красный гидроро-дизонат бария Ba (HC6O6)2.
Предел обнаружения — 0,25 мкг. Мешают катионы Pb 2+ .
Реакцию проводят капельным методом на фильтровальной бумаге. Методика аналогична описанной для реакции катионов стронция с родизонатом натрия.
Окрашивание пламени газовой горелки. Соли и другие соединения бария окрашивают пламя газовой горелки в желто-зеленый цвет. Методика — такая же, как и в других вышеописанных случаях.
Другие реакции катионов бария. Катионы Ba 2+ образуют также осадки при реакциях: с растворимыми оксалатами — белый BaC2O4 (растворяется в HCl, HNO3, при нагревании — также и в CH3COOH); с гидрофосфатом натрия Na2HPO4 — белый BaHPO4 (растворяется в кислотах); с растворимыми карбонатами — белый BaCO3 (растворяется в кислотах); с сульфитами — белый BaSO3 (растворяется в кислотах).
Катионы Ba 2+ образуют окрашенные комплексы с некоторыми органическими реагентами, например, с 8-оксихинолином (желто-зеленый), с сульфоназом III (сине-зеленый) и др.
Химия, Биология, подготовка к ГИА и ЕГЭ
Материал для задания 37 ЕГЭ (по-старому С2 ЕГЭ), для олимпиад, да и вообще для тех, кому нужны нормальные знания по химии
Автор статьи — Саид Лутфуллин
В статье приведены многие реакции, которые встречаются в ЕГЭ. Формулировки описания реакций тоже как в ЕГЭ, поэтому не удивляйтесь если встретите что-то вроде «…осадок растворяется в кислотах…», конечно же, он не растворяется, он реагирует с кислотой. Растворение – это немного другой процесс, но господа составители из ФИПИ со мной не согласны и упорно применяют в таких случаях именно этот термин.
Уравнения качественных реакций неорганической химии.
(кликните на название категории, чтобы перейти в соответствующий раздел)
I. Элементы IA-группы (щелочные металлы)
– легкие металлы, настолько пластичные, что их можно разрезать ножом. Из-за чрезвычайной активности, на воздухе легко окисляются (некоторые со взрывом), поэтому их хранят в керосине, кроме лития. Литий хранить в керосине невозможно из-за физических свойств. Этот металл легче керосина, поэтому всплывает в нем. Литий хранят в вазелине или еще в чем-нибудь таком инертном и вязком.
Почти все соли щелочных металлов растворимы в воде.
Поэтому обнаружение их катионов выпадением осадка невозможно. Для определения катионов металлов используют метод пирохимического анализа.
Этот метод основан на способности ионов металлов, входящих в состав летучих солей, окрашивать пламя горелки в определенный цвет.
1) Li +
Окрашивает пламя горелки в карминово-красный цвет
Помимо этого, литий – один единственный щелочной металл, катион которого можно обнаружить с помощью осадка. Катион лития с фосфат-ионом дает белый осадок:
Сокращенное ионное уравнение:
3Li + + PO4 3- → Li3PO4↓
2) Na +
Окрашивает пламя горелки в желтый цвет.
3) K +
Окрашивает пламя горелки в фиолетовый цвет.
4) Rb +
Окрашивает пламя горелки в розово-фиолетовый цвет.
5) Cs +
Окрашивает пламя горелки в голубовато-фиолетовый цвет.
II. Щелочноземельные металлы (подгруппа кальция)
– металлы серого цвета. Твердые, ножом не режутся. На воздухе ведут себя спокойно: покрываются оксидной пленкой.
Определить катионы щелочноземельных металлов можно как с помощью выпадения осадка, так и с помощью пирохимического метода:
1. Ca 2+
Образует белый осадок с карбонат-ионом : CaCl 2 + K 2 CO 3 → CaCO 3 ↓ + 2 KCl
Сокращенное ионное уравнение: Ca 2+ + CO 3 2- → CaCO 3 ↓
Образуется карбонат кальция – мел. Так же карбонат кальция – составная часть накипи. Иногда можно встретить формулировку: «…белый осадок, растворимый в кислотах с выделением газа (без цвета, вкуса, запаха)…». Имеется в виду реакция карбонатов с кислотами:
Катион кальция окрашивает пламя горелки в оранжево-красный цвет .
2. Sr 2+
Образует белый нерастворимый в кислотах осадок с сульфат-ионом : SrCl 2 + K 2 SO 4 → SrSO 4 ↓ + 2 KCl
Сокращенное ионное уравнение: Sr 2+ + SO 4 2- → SrSO 4 ↓
Окрашивает пламя горелки в темно-красный цвет .
3. Ba 2+
Образует белый нерастворимый в кислотах осадок с сульфат-ионом : BaCl 2 + K 2 SO 4 → BaSO 4 ↓ + 2 KCl
Сокращенное ионное уравнение: Ba 2+ + SO 4 2- → BaSO 4 ↓
Катионы бария окрашивают пламя горелки в зеленый цвет
4. Mg 2+
Определяется, как и кальций, карбонат-ионами .
Карбонат магния – белый осадок: Mg ( NO 3 ) 2 + K 2 CO 3 → MgCO 3 ↓ + 2 KNO 3
Сокращенное ионное уравнение: Mg 2+ + CO 3 2- → MgCO 3 ↓
III. Be 0 (Be 2+ ), Zn 0 (Zn 2+ ), Al 0 (Al 3+ )
эти три металла объединяют амфотерные свойства. Поэтому если в задании встречается следующая формулировка: «…металл, растворимый в раствор е щелочи…», «…металл, который растворяется и в щелочах, и кислотах…» или «…металл, растворяющийся в щелочи с выделением горючего газа, легче воздуха…» , то имеют в виду один из этих трех металлов.
Ионы этих металлов в растворах тоже определяют добавлением щелочи.
Выпадает белый студенистый осадок (гидроксид металла), который в избытке щелочи растворяется (гидроксиды алюминия, цинка и бериллия реагируют со щелочами, образуя растворимые гидроксоалюминаты, гидроксоцинкаты и гидроксобериллаты соответственно):
BeCl 2 + 2 KOH → Be ( OH ) 2 ↓ + 2 KCl
(образование осадка) сокращенное ионное уравнение:
Be 2+ + 2 OH — → Be ( OH ) 2 ↓ Be ( OH ) 2 + 2 KOH → K 2 [ Be ( OH ) 4 ] (растворение осадка)
ZnCl 2 + 2 KOH → Zn ( OH ) 2 ↓ + 2 KCl (образование осадка)
сокращенное ионное уравнение: Zn 2+ + 2 OH — → Zn ( OH ) 2 ↓
Zn ( OH ) 2 + 2 KOH → K 2 [ Zn ( OH ) 4 ] (растворение осадка)
AlCl 3 + 3 KOH → Al ( OH ) 3 ↓ + 3 KOH (образование осадка)
сокращенное ионное уравнение:
Al 3+ + 3 OH — → Al ( OH ) 3 ↓
Al ( OH ) 3 + KOH → K [ Al ( OH ) 4 ] (растворение осадка)
Оксиды этих металлов, как и гидроксиды, растворяются в кислотах и щелочах, рассмотрим на примере оксида алюминия:
У гидроксида цинка есть характерная особенность: он растворяется в NH 3 (водн.)
Ион Zn 2+ с S 2+ образует белый осадок . Который растворяется в кислотах с выделением газа с запахом тухлых яиц – сероводорода (про него подробнее ниже, в разделе сера):
ZnSO 4 + K 2 S → ZnS ↓ + K 2 SO 4 (образование осадка)
Сокращенное ионное уравнение:
ZnS + H 2 SO 4 → ZnSO 4 + H 2 S ↑ (растворение осадка с выделением сероводорода)
Медь – пластичный розовато-красный металл.
Хороший проводник электрического тока.
Не вытесняет из кислот водород.
Реагирует только с кислотами-окислителями (азотной и концентрированной серной):
Оксид меди – CuO – черный – основный.
Растворяется в кислотах, окрашивая раствор в голубой цвет: CuO + 2HCl → CuCl 2 + H 2 O
Cu 2+
Летучие соли меди окрашивают пламя горелки в зеленый цвет. Соединения меди имеют голубоватую окраску , это можно использовать как диагностический признак.
В растворе ионы меди можно обнаружить добавлением щелочи выпадает растворимый в кислотах, голубой осадок, который используется в нескольких качественных реакциях органической химии.
Сокращенное ионное уравнение:
Осадок Cu ( OH ) 2 растворяется в избытке NH 3 (водн.) образуя интенсивно синий раствор:
Если нагреть осадок Cu ( OH ) 2 , то он почернеет. Потому что гидроксид меди( II ) – нерастворимое основание и разлагается:
Голубой – это фирменный цвет соединений меди, и если в задании ЕГЭ написано про этот цвет, то 90% вероятности, что говорят про соединение меди.
Серебро – мягкий благородный металл. Цвет серебристый.
Оксид серебра Ag 2 O- черный – основный.
Ag +
Катион серебра с хлорид-ионом дает белый творожистый осадок : AgNO 3 + KCl → AgCl ↓ + KNO 3
сокращенное ионное уравнение: Ag + + Cl — → AgCl ↓
Осадок хлорида серебра (и остальные галогениды) , как и гидроксида меди, растворяется в NH 3 * H 2 O
Еще одна особенность серебра, которая позволяет определить его ионы в растворе, – это его гидроксид, который нестабилен и быстро разлагается в водном растворе.
При добавлении к раствору соли серебра щелочи , выпадает черный осадок оксида серебра :
AgNO 3 + KOH → KNO 3 + AgOH
можно (и грамотнее) записать сразу:
То есть при добавлении к соли серебра щелочи выпадает черный осадок . Осадок оксида серебра , как и галогениды этого металла, растворяются в NH 3 (водн.) :
[ Ag ( NH 3 ) 2 ] OH – гидроксид диамминсеребра( I ) известен как раствор Толленса.
Он используется в качественной реакции на альдегиды (реакция серебряного зеркала).
Оксид серебра как основный гидроксид растворяется в кислотах (само собой, в тех, с которыми серебро может образовать растворимую соль):
Железо – серебристо-белый пластичный металл.
Обладает магнитными свойствами.
Вытесняет из растворов кислот водород (кроме азотной). Обратите внимание, что при взаимодействии с кислотами-неокислителями, и слабыми окислителями железо приобретает степень окисления +2, а при взаимодействии с сильными окислителями оно приобретет степень окисления +3:
2 Fe + 3 Cl 2 ( t )→ 2 FeCl 3
Катион Fe 3+
При добавлении к раствору, содержащему ионы трехвалентного железа , выпадает бурый осадок гидроксида железа ( III ):
Сокращенное ионное уравнение:
Оксид и гидроксид железа( III ) – амфотерные соединения, поэтому они растворяются в щелочах и кислотах:
Катион Fe 2+ с гидроксид ионом тоже образует осадок, только зеленоватого цвета .
Сокращенное ионное уравнение: Fe 2+ + 2 OH — → Fe ( OH ) 2 ↓
Оксид и гидроксид железа( II ) – основные.
В щелочах не растворяются. Осадок со временем буреет (меняет степень окисления с 2+ на +3):
На ионы железы есть еще две похожие канонические качественные реакции. Образуется одно и то же вещество: берлинская лазурь, или турнбулева синь.
Раньше считали, что это два разных вещества, в книжках писали: «не путайте», а потом оказалось, что это не так.
Ион Fe 2+ определяется добавлением красной кровяной соли (гексацианоферрат (III) калия):
4Fe 2+ + 3 [Fe III (CN) 6 ] 3− → Fe III 4 [Fe II (CN) 6 ] 3 ↓
Ион Fe 3+ определяется добавлением желтой кровяной соли (гексацианоферрат (II) калия):
4Fe 3+ + 3 [Fe II (CN) 6 ] 4− → Fe III 4 [Fe II (CN) 6 ] 3 ↓
Не очень активный, так как покрывается оксидной пленкой.
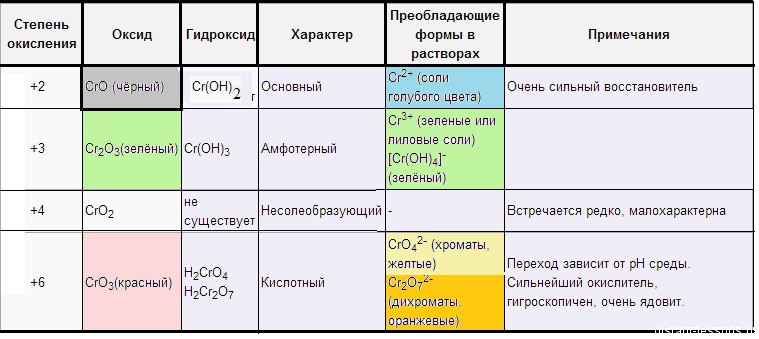
Название элемента переводится с греческого «цвет», потому что соединения хрома, как правило, окрашены. Простое вещество хром ведет себя как типичный металл, со щелочами не реагирует.
Реагирует с кислотами. Кислоты-неокислители ( в том числе разбавленная серная кислота) и вообще слабые окислители переводят хром в степень окисления +2:
Cr + S (t)→ CrS C окислителями приобретает степень окисления +3:
В общем тут все как у железа. Правило простое и вполне логичное.
С азотной и концентрированной серной кислотой не реагирует, так как пассивируется.
Проявляет несколько устойчивых степеней окисления.
Степень окисления +2
В этих соединениях хром проявляет сильные восстановительные свойства.
Оксид хрома ( II ) – CrO (основный) – черный.
Растворы солей Cr 2+ голубые . Если обработать черный оксид хрома( II ) соляной кислотой, образуется голубой раствор :
Если к раствору соли двухвалентного хрома добавить щелочь выпадет желтый осадок гидроксида хрома( II ), (осадок на воздухе зеленеет, об этом чуть позже):
Сокращенное ионное уравнение:
Гидроксид хрома( II ) основный,
поэтому он не растворяется в щелочах, зато прекрасно растворяется в кислотах, образуя все тот же синий раствор:
Степень окисления +3.
Оксид хрома( III ) – Cr 2 O 3 (амфотерный) – зеленый .
Как амфотерный оксид Cr 2 O 3 растворяется в кислотах и щелочах:
Соли трехвалентного хрома могут быть разного цвета (от фиолетового до темно-зеленого). Поэтому визуально опознать соль трехвалентного хрома со 100% уверенностью нельзя. Наличие катионов Cr 3+ в растворе определяется добавлением щелочи .
Cr 3+ с гидроксид-ионами образует зеленый осадок гидроксида хрома( III ) :
Сокращенное ионное уравнение:
Cr 3+ + 3 OH — → Cr ( OH ) 3 ↓
Выпавший осадок – гидроксид хрома( III ) амфотерный, поэтому растворяется в кислотах и щелочах, с образованием зеленых солей – гидроксохроматов :
Если оставить на некоторое время на воздухе желтый осадок гидроксида хрома( II ) , то он позеленеет . Cr +2 окисляется до Cr +3 ,
образуется зеленый гидроксид хрома( III ) :
Если подействовать на соединение хрома (+3) сильным окислителем, то произойдет смена окраски. Она станет желтой. Хром окислится до +6
Степень окисления +6.
В этих соединениях хром проявляет сильные окислительные свойства.
Оксид хрома( VI ) – CrO 3 (кислотный) – красный .
Окисляет многие органические соединения. Этот процесс описывают как «растворение [оксида хрома VI ] в спиртах (альдегидах, эфирах)»
Оксид кислотный, поэтому в кислотах не растворяется, растворяется в щелочах, с образованием хроматов:
Хроматы – это соли хромовой кислоты ( H 2 CrO 4 ). Они желтого цвета. Кроме хромовой (хром +6) образует дихромовую кислоту ( H 2 Cr 2 O 7 ), ее соли – бихроматы (дихроматы) оранжевые .
Хроматы и бихроматы переходят друг в друга при изменении кислотности среды (с щелочной на кислую и наоборот):
То есть в кислой среде более устойчивы бихроматы, в щелочной хроматы.
Хроматы и бихроматы так же являются сильнейшими окислителями.
При добавлении к раствору хромата катионов бария выпадает желтый осадок хромата бария BaCrO 4 :
Сокращенное ионное уравнение: Ва 2+ + СrO 4 2- → BaCr O 4 ↓
Полученный хромат бария растворяется в сильных неорганических кислотах. Потому что, как уже говорилось ранее, в кислой среде хроматы не устойчивы и переходят в бихроматы:
2 BaCrO 4 + 2 H + → 2 Ba 2+ + Cr 2 O 7 2- + H 2 O
Компактная таблица цветов соединения хрома, приведена у нас в статье “Хром”:
Как и хром малоактивен за счет пассивации.
Реагируя с кислотами (даже с кислотами-окислителями), окисляется до +2:
Mn + HCl → MnCl2 + H2↑
Mn + 2H2SO4(конц.) → MnSO4 + SO2↑ + 2H2O
В более агрессивных средах с кислотами-окислителями процесс окисления идет глубже: до +4 и +7.
Кислородом окисляется до +4 (там конечно есть другие варианты с другими температурами, но мы их рассматривать не будем):
Галогены (кроме фтора) до +2:
Mn + Cl2 (t)→ MnCl2
Проявляет различные степени окисления.
Степень окисления 2+.
Степень окисления 2+. Оксид марганца( II ) – MnO (основный) зеленого цвета .
На воздухе очень быстро окисляется до темно-бурого MnO 2 :
Соли, содержащие катион Mn 2+ как правило имеют бледный светло-розовый цвет .
Катион Mn 2+ обнаруживают гидроксид-ионами, с которыми он образует розовато-белый осадок гидроксида марганца( II ), который окисляется на воздухе и буреет (превращается в бурый оксид марганца( II )):
MnCl 2 + 2 KOH → Mn ( OH ) 2 ↓ + 2 KCl
Сокращенное ионное уравнение:
Mn 2+ + 2 OH — → Mn ( OH ) 2 ↓
Степень окисления 4+. Оксид марганца( IV ) – MnO 2 (амфотерный) т емно-бурый – одно из самых устойчивых и встречаемых соединений марганца.
Mn +4 O 2 + 4 HCl → Mn +2 Cl 2 + Cl 2 ↑ + 2 H 2 O
Степень окисления +6. Оксид марганца( VII ) – Mn 2 O 7 (кислотный) зелено-бурая жидкость.
Очень не стабильное и агрессивное вещество, может спонтанно взорваться. Сильный окислитель.
Оксиду марганца( VII ) соответствует марганцевая кислота HMnO 4 .
Она существует только в водном растворе, который как и растворы ее солей (перманганатов) имеет фиолетово-малиновую окраску .
Перманганаты так же являются сильными окислителями.
В ЕГЭ часто встречаются реакции окисления органических веществ перманганатом калия – это классика:
Приведенное выше уравнение – это качественная реакция на кратные связи – обесцвечивание раствора перманганата и выпадение темно-бурого осадка.
Это весьма необычное вещество. Может быть, трудно представить, но среди всех простых веществ есть только два, которые при нормальных условиях находятся в жидком агрегатном состоянии. Это бром и ртуть.
В нормальных условиях ртуть – серебристо-белая жидкость, с высокой плотностью, поэтому она тонет в воде.
Сама по себе металлическая ртуть вреда не представляет, а вот ее пары и соединения (в особенности органические) чрезвычайно ядовиты.
Качественная реакция на Hg 2+ : при добавлении к раствору соли ртути( II ) щелочи выпадает оранжевый осадок ОКСИДА ртути , гидроксид не образуется, его не существует:
NH 4 + – ион аммония
Если добавить к раствору аммония (иногда нужно нагреть) щелочь образуется нестабильный гидроксид аммония, который разлагается. В ыделяется аммиак – газ с реким запахом (запах нашатырного спирта) :
Можно записать сразу: NH 4 NO 3 + KOH → NH 3 ↑ + H 2 O + KNO 3
Сокращенное ионное уравнение: NH 4 + + NO 3 — → NH 3 ↑ + H 2 O
Выделившийся газ (аммиак) может быть поглощен растворами кислот, с образованием солей аммония: NH 3 + HCl → NH 4 Cl
H +
– частица, в которую превращается атом водорода, отдав электрон.
Получается протон, понятное дело, такая частица в воде не существует.
Частица эта прикреплена по донорно-акцепторному механизму к атому кислорода в молекуле воды, получается ион гидроксония: H 3 O + .
О чем свидетельствует наличие в растворе такого иона?
Конечно же о том, что среда раствора кислая.
А для определения кислотности используют индикаторы.
Рассмотрим несколько индикаторов: лакмус фиолетовый , метиловый оранжевый , фенолфталеин .
Лучше учить названия индикаторов именно так, ведь в таких названиях заключена информации о цвете индикатора в нейтральной среде:
метиловый оранжевый – оранжевый,
| Индикатор | Цвет в кислой среде pH | Цвет в нейтральной среде pH = 7 Цвет в щелочной среде pH > 7 | |
| Лакмус фиолетовый | Красный | Фиолетовый | Синий |
| Метиловый оранжевый | Красный | Оранжевый | Желтый |
| Фенолфталеин | Нет (бесцветный) | Нет (бесцветный) | Малиновый |
Существует несколько мнемонических правил для запоминания цветов индикаторов:
Фенолфталеиновый в щелочах малиновый, но несмотря на это в кислотах он без цвета.
В кислотах лакмус красный – цвет такой прекрасный, а в щелочах он синий как январский иней, а в нейтральной среде фиолетовый, как нигде. (Этот стишок сочинили когда-то мы с товарищем. Хоть он не совсем складный и мы так и не можем объяснить, с чего бы это иней, который обычно белый, в январе вдруг станет синим, стишок как-то по-особенному запал в мою память, всегда им пользуюсь)
Кислота – начинается на букву К, как и слово «кислый» — помогает вспомнить цвет лакмуса и метилоранжа в кислотах.
– элементы VIIA -группы( F , Cl , Br , I ), типичные неметаллы.
Пойдем по порядку:
Фтор – F 2 – желтый газ с легким зеленым отливом. Самый электроотрицательный неметалл, поэтому с кислородом образует не оксид фтора, а фторид кислорода: OF 2 степень окисления кислорода в нем равна +2. Чрезвычайно активное вещество, реагирует со всем, с чем не лень. И большинство реакций протекает бурно, взрывообразно.
Фторид-ионы ( F — ) в растворе определяются добавлением катионов кальция ( Ca 2+ ), наблюдается выпадение белого осадка :
2 KF + CaCl 2 → 2 KCl + CaF 2 ↓
Сокращенное ионное уравнение: Ca 2+ + 2 F — → CaF 2 ↓
- Хлор – Cl 2 – зеленый газ, с характерным резким запахом, сильный яд, тяжелее воздуха (при химической атаке стелется по земле):
Хлорид-ионы ( Cl — ) в растворе определяются добавлением катионов серебра ( Ag + ), наблюдается выпадение белого творожистого осадка (об этой реакции говорилось ранее в разделе серебро):
KCl + AgNO 3 → AgCl ↓ + KNO 3
Сокращенное ионное уравнение: Ag + + Cl — → AgCl ↓
- Бром – Br 2 – красно-бурая летучая жидкость, имеющая очень резкий неприятный запах.
Бромд-ионы ( Br — ) в растворе определяются добавлением катионов серебра ( Ag + ), наблюдается выпадение слегка желтоватого осадка :
KBr + AgNO 3 → AgBr ↓ + KNO 3
Сокращенное ионное уравнение: Ag + + Br — → AgBr ↓
- Иод – I 2 – летучие черно-серые с фиолетовым отливом кристаллы. Пары фиолетовые, имеют характерный запах.
Иодид-ионы ( I — ) в растворе определяются добавлением катионов серебра ( Ag + ), наблюдается выпадение желтоватого осадка (цвет интенсивнее, чем у бромида серебра) :
Сокращенное ионное уравнение: Ag + + I — → AgI ↓
Осадки-галогениды не растворяются в разбавленных кислотах.
Простое вещество сера – хрупкие желтые кристаллы.
Сера может проявлять различные степени окисления:
Степень окисления -2:
в сульфИД-ионе ( S 2- ) и гидросульфИД-ионе ( HS — ).
СульфИДы (и гидросульфИДы) – это соли сероводородной кислоты, которая является слабым электролитом. Поэтому сильные кислоты вытесняют ее из растворов солей. Выделяется H 2 S – сероводород, газ с неприятным запахом тухлых яиц :
K 2 S + 2HCl → 2KCl + H 2 S↑
Сокращенное ионное уравнение: 2 H + + S 2- → H 2 S ↑
Выделившийся газ ( H 2 S ) на воздухе сгорает синим пламенем (не в смысле, что выделился и сразу сгорел, а если начать сжигать):
Так же сероводород ( H 2 S ) может быть поглощен растворами щелочей: H 2 S + 2 NaOH →
Сероводород является хорошим восстановителем, так как сера в нем в низшей степени окисления.
Еще одна особенность ионов S
2- позволяет легко определить их в растворе. Ионы S 2- образуют осадки со многими тяжелыми металлами:
- Классическая реакция с ионами Pb2+ . Образуется черный осадок сульфида серы :
- С ионами Cu 2+ , Fe 2+ , Ni 2+ , Cu 2+ , Pb 2+ , Hg 2+ , Ag + и ионами многих других металлов тоже образуются осадки черного цвета .
- С ионом Zn 2+ образуется белый осадок (один из немногих нечерных нерастворимых сульфидов):
Так как сера в сульфид-ионе в низшей степени окисления, она может окислиться. При действии сильных окислителей на сульфиды они окисляются до сульфатов (как правило). Классическая ЕГЭ-шная реакция, цитата из С2: «…черный осадок побелел после обработки его пероксидом водорода… ». Речь идет о
черном осадке сульфида свинца ( PbS ). Пероксид водорода H 2 O 2 (сильный окислитель) превращает черный сульфид свинца в белый (тоже нерастворимый) сульфат свинца ( PbSO 4 ):
Степень окисления + 4:
встречается в оксиде серы ( IV ) (сернистом газе – SO 2 ), в соответствующей этому оксиду кислоте – сернистой ( H 2 SO 3 , существующей только в растворе) и в солях сернистой кислоты – сульфИТах и гидросульфИТах.
Сернистый газ ( SO 2 ) – бесцветный газ с резким запахом (по легендам – запахом ада). Его можно почувствовать чиркнув спичку. Образуется при сжигании серы, сероводородов, сульфидов, серосодержащих органических веществ. Классическое школьное уточнение: « обесцвечивает раствор фуксина и фиолетовые чернила », при этом совсем не обязательно знать, что такое фуксин, и какие реакции протекают. Просто хорошо бы запомнить эту формулировку.
Так как является кислотным оксидом, реагирует с растворами щелочей. (формулировка из задания ЕГЭ: «…выделившийся газ с резким запахом был поглощен раствором щелочи…» ). Образуются соли сернистой кислоты – сульфиты:
СульфИТ-ионы и гидросульфИТ-ионы в растворе можно обнаружить добавлением сильной кислоты. При этом из раствора сульфита (гидросульфита) вытесняется сернистая кислота: H 2 SO 3 , которая не стабильная, поэтому быстро разлагается на воду и соответствующий оксид ( SO 2 ). То есть, если совсем коротко: при действии на сульфиты и гидросульфиты кислот выделяется SO 2 – газ с резким запахом (обесцвечивающий раствор фуксина и фиолетовые чернила):
Можно (и грамотнее) записать сразу:
Степень окисления +6
встречается в серном ангидриде (оксиде серы( VI ) – SO 3 ), в соответствующей ему серной кислоте ( H 2 SO 4 ) и в ее солях, сульфАТах.
Серный ангидрид ( SO 3 ) и серная кислота( H 2 SO 4 ) содержат серу в высшей степени окисления, поэтому являются сильными окислителями.
Сульфаты в растворе определяются добавлением катионов бария ( Ba 2+ ). Сульфат-ион с катионом бария образует белый осадок ( нерастворимый в кислотах ):
Сокращенное ионное уравнение: Ва 2+ + S O 4 2- → BaS O 4 ↓
CO 3 2-
– карбонат-ион и HCO 3 — – гидрокарбонат-ион
являются анионом слабой, нестабильной, существующей только в растворе, угольной кислоты. Поэтому она легко вытесняется сильными кислотами из растворов солей (карбонатов и гидрокарбонатов).
Вытесняется и тут же распадается на воду и углекислый газ.
При действии кислот на карбонаты выделяется бесцветный газ без вкуса и запаха :
Можно (и грамотнее) записать сразу: K 2 CO 3 + 2 HCl → 2 KCl + CO 2 ↑ + H 2 O
Эта качественная реакция вам хорошо известна, вы наверняка проводили ее у себя дома. Добавим уксус к соде, и как раз будет выделяться газ, в чем можно убедиться если поднести спичку, она погаснет, так как CO 2 не поддерживает горения:
Выделившийся углекислый газ может быть поглощен раствором щелочи:
В связи со способностью поглощаться щелочами для описания углекислого газа часто встречается следующая формулировка: «… газ, при пропускании его через известковую воду, вызвал ее помутнение… ». Известковая вода – это профильтрованный раствор гидроксида кальция (гидроксид кальция полностью не растворяется в воде, образуется взвесь, и чтобы получить прозрачный раствор – его фильтруют, для очищения от не растворившихся частиц гидроксида кальция). При взаимодействии гидроксида кальция с углекислым газом образуется нерастворимый карбонат кальция, который и обеспечивает мутность:
PO 4 3-
– анион ортофосфорной кислоты (H 3 PO 4 ). В растворе его можно определить добавлением катионов серебра , при этом выпадает интенсивно-желтый осадок :
Сокращенное ионное уравнение: 3 Ag + + PO 4 3- → Ag 3 PO 4 ↓
SiO 3 2-
– анион кремниевой кислоты ( H 2 SiO 3 ) , которая являясь слабым электролитом, вытесняется из растворов ее солей. Кроме того, кремниевая кислота малорастврима в воде, поэтому в момент вытеснения ее из раствора соли, появляется гелеобразный осадок – это и будет H 2 SiO 3 :
Кремниевая кислота настолько слабая, что вытесняется даже угольной:
– оксид азота ( VI ).
Ядовитый газ с неприятным запахом бурого цвета.
В ЕГЭ его обычно именно так и обзывают – бурый газ .
Химически очень активное вещество:
- при взаимодействии не очень активных металлов с HNO 3 концентрированной;
- при разложении нитратов этих металлов.
В реакции с водой диспропорционируется, образуя азотную и азотистую кислоты:
Похожая реакция диспропорционирования происходит при растворении NO 2 в щелочах (образуются не кислоты, а соли этих кислот, нитраты и нитриты соответственно):
В присутствии избытка кислорода реакция идет без образования азотистой кислоты (диспропорционирования не происходит):
OH —
Наличие в растворе ионов OH — указывает на щелочную реакцию среды ( pH >7).
Определить pH можно с помощью индикаторов.
Окраски индикаторов в разных средах указаны в пункте про ион H + . Щелочную среду имеют не только щелочи, но и растворы аммиака и аминов, растворы солей, образованных сильными основаниями и слабыми кислотами.
Если нужно определить щелочь, то к раствору надо добавить соль металла, образующего слабое основание. Щелочь с такой солью даст осадок гидроксида металла:
CuCl 2 + 2NaOH → Cu(OH) 2 ↓ + 2NaCl
http://analitica.ucoz.com/index/iii_analiticheskaja_gruppa_kationov/0-15
http://distant-lessons.ru/uravneniya-kachestvennyx-reakcij.html