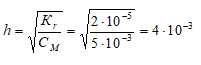Сульфат калия: способы получения и химические свойства
Сульфат калия K2SO4 — соль щелочного металла калия и серной кислоты. Белый, термически устойчивый. Хорошо растворяется в воде (гидролиза нет).
Относительная молекулярная масса Mr = 174,26; относительная плотность для тв. и ж. состояния d = 2,662; tпл = 1074º C; tкип > 2000º C
Способ получения
1. В результате взаимодействия при надпероксида калия и серы образуется сульфат калия:
2. Оксид калия реагирует с оксидом серы. В результате реакции образуется сульфат калия:
K2O + SO3 = K2SO4
3. В результате реакции между гидроксидом калия и серной кислотой происходит образование сульфата калия и воды:
4. Гидросульфат калия при 240 ºС разлагается с образованием сульфата калия и серной кислоты:
5. При взаимодействии концентрированного гидроксида калия и гидросульфата калия образуется сульфат калия и вода:
6. Сульфат калия взаимодействует с хлоридом калия при 450–700º C с образованием сульфата калия и соляной кислоты:
7. Твердый хлорид калия реагирует с концентрированной серной кислотой в состоянии кипения. В результате реакции образуется сульфат калия и газ хлороводород:
8. При температуре выше 500º С твердый сульфид калия взаимодействует с кислородом, образуя сульфат калия:
Качественная реакция
Качественная реакция на сульфат калия — взаимодействие его с хлоридом бария, в результате реакции происходит образование белого осадка , который не растворим в азотной кислоте:
1. При взаимодействии с хлоридом бария , сульфат калия образует сульфат бария и хлорид калия:
Химические свойства
1. Сульфат калия может реагировать с простыми веществами :
1.1. Сульфат калия реагирует с углеродом при температуре 900º C. При этом образуются сульфид калия и угарный газ:
1.2. С водородом сульфат калия реагирует при температуре 600º C, в присутствии катализатора Fe2O3 с образованием сульфида калия и воды:
2. Сульфат калия вступает в реакцию со многими сложными веществами :
2.1. Сульфат калия взаимодействует с гидроксидами :
2.1.1. Сульфат калия реагирует с гидроксидом бария с образованием гидроксида калия и сульфата бария:
2.2. Сульфат калия может реагировать с кислотами :
2.2.1. При взаимодействии с концентрированной серной кислотой твердый сульфат калия образует гидросульфат калия:
2.3. Сульфат калия может взаимодействовать с оксидами :
2.3.1. Сульфат калия реагирует с оксидом серы (VI) . Взаимодействие сульфата калия с оксидом серы (VI) приводит к образованию пиросульфата калия:
2.4. Сульфат калия реагирует с солями :
2.4.1. Сульфат калия взаимодействует с хлоридом бария . При этом образуются хлорид калия и осадок сульфат бария:
напишите молекулярные и ионные уравнения гидролиза солей. 1) сульфита калия 2) нитрата алюминия
K2SO3 + H2O = KHSO3 + KOH
2K(+) + SO3(-2) + HOH 2K(+) + HSO3(-) + OH(-)
SO3(-2) + HOH HSO3(-) + OH(-) pH >7 среда щелочная , -краткое ионное ур.
Al(NO3)3 + H2O = [Al(OH)](NO3)2 + HNO3
Al(+3) + 3NO3(-) + HOH [Al(OH)+2] + 3NO3(-) + H(+)
Al(+3) +HOH [Al(OH)+2] + H(+) — краткое ионное уравнение, среда кислая pH
K2SO3+H2O=KHSO3+KOH
SO3 2- +H2O=HSO3- +OH-
Al(NO3)3+H2O=AlOH(NO3)2+HNO3
Al 3+ +H2O=AlOH 2+ +H+ сам-то когда будешь?
Как правильно написать уравнения гидролиза и рассчитать константу и степень гидролиза соли
Молекулярная и ионная формы уравнений реакций гидролиза
Задача 21.
Напишите в молекулярной и ионной форме уравнения реакций гидролиза следующих солей: а) сульфида калия; б) сульфата меди (ⅠⅠ); в) совместного гидролиза хлорида алюминия и ацетата калия. Константа гидролиза соли.
Решение:
а) Гидролиз сульфида калия:
K2S + H2O = KHS + KOH — (молекулярная форма);
S 2– + HOH = HS – + OH – — (ионная форма).
б) Гидролиз сульфата меди (ⅠⅠ):
Cu 2+ + HOH = CuOH + + H + — (ионная форма).
в) Совместный гидролиз хлорида алюминия и ацетата калия:
AlCl3 + 3CH3COOK + 3H2O = Al(OH)3↓ + 3CH3COOH + 3KCl — (молекулярная форма);
Al 3+ + 3CH3COO – + 3HOH = Al(OH)3↓ + 3CH3COOH — (ионная форма).
Определение степени гидролиза и рН раствора цианида калия
Задача 22.
Определите степень гидролиза и pH раствора цианида калия с молярной концентрацией 0,005 моль/л.
Решение:
Цианид калия – соль, образованная сильным основанием КОН и слабой кислотой HCN, которая в водном растворе гидролизуется по аниону.
KCN + HOH ⇔ KOH + HCN
CN – + HOH ⇔ HCN + OH –
Таким образом, при гидролизе этой соли в растворе ее будет избыток ионов OH-, что придает раствору щелочную реакцию
(pH > 7 – среда щелочная).
Константа гидролиза соли, образованной слабой кислотой и сильным основанием определяется по формуле:
Kw = 1 . 10 -14 – ионное произведение воды.
KD(HCN) = 5 . 10 -10 – константа диссоциации циановодородной кислоты
Константа гидролиза цианида калия равна:
Kr(KCN) = Kw/KD(HCN) = (1 . 10 -14 )/(5 . 10 -10 ) = 2 . 10 -5 .
Находим степень гидролиза цианида калия, получим:
Рассчитаем молярную концентрацию ионов OH? в растворе, получим:
[OH – ] = h . СM(KCN) = (4 . 10 -3 ) . 0,005 = 2 . 10 -5 моль/л.
Находим гидроксильный показатель, получим:
рОН = — lg[OH – ] = – lg2 . 10 -5 = 5 — lg2 = 5 — 0,30 = 4,7.
Находим водородный показатель, получим
http://sprashivalka.com/tqa/q/27559777
http://buzani.ru/zadachi/obshchaya-khimiya/1413-gidrokarbonat-natriya-zadachi-15-16