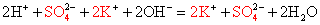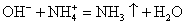Ионные уравнения
Ионные уравнения — неотъемлемая часть сложной и интересной химической науки. Такие уравнения позволяют наглядно увидеть, какие ионы вступают в химические превращения. В виде ионов записывают вещества, которые подвергаются электролитической диссоциации. Разберем историю вопроса, алгоритм составления ионных уравнений и примеры задач.
ИСТОРИЯ ВОПРОСА
Еще древние алхимики, проводя нехитрые химические реакции в поисках философского камня и записывая в толстые фолианты результаты своих исследований, использовали определенные знаки для химических веществ. У каждого ученого была своя система, что неудивительно: каждый хотел защитить свои тайные знания от происков завистников и конкурентов. И лишь в VIII веке появляются единые обозначения для некоторых элементов.
В 1615 году Жан Бегун в своей книге «Начала химии», что по праву считается одним из первых учебников в этом разделе естествознания, предложил использовать условные обозначения для записи химических уравнений. И лишь в 1814 году шведский химик Йонс Якоб Берцелиус создал систему химических символов на основе одной или двух первых букв латинского названия элемента, подобную той, с которой ученики знакомятся на уроках.
В восьмом классе (параграф 12, учебник «Химия. 8 класс» под редакцией В.В. Еремина) ребята научились составлять молекулярные уравнения реакций, где и реагенты, и продукты реакций представлены в виде молекул.
Однако это упрощенный взгляд на химические превращения. И об этом задумывались ученые уже в XVIII веке.
Аррениус в результате своих экспериментов выяснил, что растворы некоторых веществ проводят электрический ток. И доказал, что вещества, обладающие электропроводностью, в растворах находятся в виде ионов: положительно заряженных катионов и отрицательно заряженных анионов. И именно эти заряженные частицы вступают в реакции.
ЧТО ТАКОЕ ИОННЫЕ УРАВНЕНИЯ
Ионные уравнения реакций — это химические равенства, в которых вещества, вступающие в реакцию, и продукты реакций обозначены в виде диссоциированных ионов. Уравнения данного типа подходят для записи химических реакций замещения и обмена в растворах.
Ионные уравнения — неотъемлемая часть сложной и интересной химической науки. Такие уравнения позволяют наглядно увидеть, какие ионы вступают в химические превращения. В виде ионов записывают вещества, которые подвергаются электролитической диссоциации (тема подробно разбирается в параграфе 10, учебник «Химия. 9 класс» под редакцией В.В. Еремина). В виде молекул записывают газы, вещества, выпадающие в осадок, и слабые электролиты, которые практически не диссоциируют. Газы обозначаются стрелкой вверх (↑), субстанции, выпадающие в осадок, стрелкой вниз (↓).
ОСОБЕННОСТИ ИОННЫХ УРАВНЕНИЙ
1. Реакции ионного обмена, в отличие от окислительно-восстановительных реакций, протекают без нарушения валентности веществ, вступающих в химические превращения.

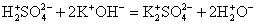
2. Реакции между ионами протекают при условии образования в ходе реакции плохорастворимого осадка, выделения летучего газа или образования слабых электролитов.
Удивительно, что реакции обмена могут проходить даже с нерастворимыми солями слабых кислот. В этом случае сильная кислота вытесняет слабую из ее солей. В качестве примера можно привести сокращенное ионное уравнение разведения карбоната кальция в сильных кислотах.
АЛГОРИТМ СОСТАВЛЕНИЯ ИОННОГО УРАВНЕНИЯ
Записываем молекулярное уравнение химического процесса.
Балансируем молекулярное уравнение с помощью коэффициентов.
Чтобы правильно сбалансировать равенство, нужно вспомнить закон сохранения массы веществ (параграф 12, «Химия. 8 класс» под редакцией В.В. Еремина), согласно которому в ходе химических превращений новые атомы не появляются, а старые не разрушаются. Т.е. число атомов в продуктах реакции равно числу атомов в исходных веществах. Помним, что водород и кислород уравниваем в последнюю очередь.
Определяем, какие вещества в химической реакции диссоциируют, т.е. распадаются на ионы.
Записываем в виде ионов:
- растворимые соли;
- сильные кислоты (H2SO4, HNO3, HCl и др.);
- растворимые в воде основания.
Записываем в виде молекул:
- нерастворимые соли;
- слабые кислоты, щелочи, вода;
- оксиды;
- газы;
- простые вещества;
- большинство органических соединений.
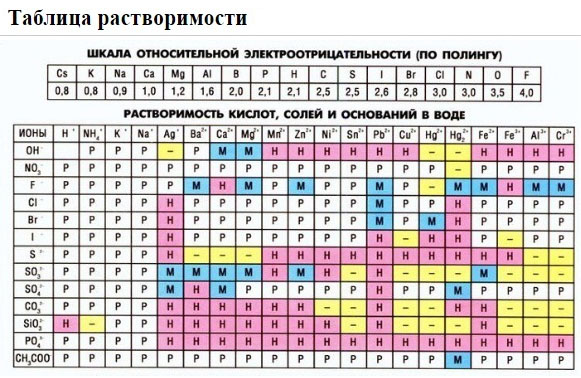
Если есть сомнения в растворимости реагента или продукта реакции, можно проверить по специальной таблице, которая является справочным материалом, ей можно пользоваться на различных экзаменах.
В таблице, помимо растворимости соединений, представлены также заряды катионов и анионов, участвующих в реакциях.
Определяем многоатомные ионы.
Это необходимо сделать, т.к. данные соединения не разлагаются на отдельные атомы и имеют свой заряд. Чаще всего в химических превращениях участвуют следующие многоатомные ионы:
Записываем равенство таким образом, чтобы все диссоциирующие субстанции были представлены в виде катионов и анионов.
Проверяем, чтобы уравнение было сбалансировано, т.е. количество различных атомов в частях с реагентами и продуктами реакции совпадало.
На данном этапе мы получили полное ионное уравнение.
Вычеркиваем идентичные ионы в обеих частях равенства, т.е. катионы и анионы с одинаковыми нижними индексами и зарядами, и переписываем равенство без данных ионов.
Проверяем, чтобы количество атомов элементов совпадало в правой и левой частях уравнения. Таким образом получаем краткое ионное уравнение.
ПРИМЕРЫ
Задача 1
Выясните, произойдет ли химическое взаимодействие между растворами гидроксида калия и хлорида аммония. (Записать для реакции молекулярное, полное ионное и сокращенное ионное уравнение.)
Записываем молекулярное уравнение, проверяем коэффициенты.
Помним, что гидроксид аммония — нестабильное соединение и разлагается на аммиак и воду.
Записываем окончательное уравнение:
NB! Благодаря летучести и резкому раздражающему запаху 3%-й раствор NH3 называется «нашатырный спирт» и используется в медицине.
Подсматривая в таблицу растворимости, помечаем полное ионное уравнение, не забывая о зарядах ионов.
Вычеркивая идентичные катионы и анионы в обеих частях реакции, составляем краткое ионное уравнение.
Делаем вывод: химическая реакция между гидроксидом калия и хлоридом аммония протекает с образованием воды и выделением аммиака — летучего газа с резким запахом.
Задача 2
А сейчас выполним задание из учебника «Химия. 9 класс» под редакцией В.В. Еремина.
Налейте в пробирку 1 мл раствора карбоната натрия и аккуратно прилейте к нему пару капелек соляной кислоты.
Составьте уравнение реакции, напишите полное и сокращенное ионные уравнения.
Записываем реакцию в молекулярном виде, расставляем коэффициенты, если это необходимо.
Подсматривая в таблицу растворимости, записываем полное ионное уравнение, не забывая отмечать заряды ионов.
Вычеркивая одинаковые катионы и анионы в правой и левой частях равенства, составляем краткое ионное уравнение.
Вопрос «Что происходит?» остался без ответа. К сожалению, в домашних условиях этот опыт осуществить трудновато, так как стиральной содой уже давно никто не пользуется, да и соляную кислоту в аптеке уже не продают. Но примерно такой же визуальный эффект можно наблюдать, если смешать раствор пищевой соды с раствором уксусной кислоты.
Составление уравнений реакций ионного обмена
Этот видеоурок доступен по абонементу
У вас уже есть абонемент? Войти
Данный урок продолжает тему «Реакции ионного обмена». Урок поможет закрепить умение составлять уравнения реакций ионного обмена в молекулярной и ионной формах, научит составлять по сокращенному ионному уравнению молекулярные.
Разработка урока по химии 9 класс «Ионные уравнения»
Обращаем Ваше внимание, что в соответствии с Федеральным законом N 273-ФЗ «Об образовании в Российской Федерации» в организациях, осуществляющих образовательную деятельность, организовывается обучение и воспитание обучающихся с ОВЗ как совместно с другими обучающимися, так и в отдельных классах или группах.
«Актуальность создания школьных служб примирения/медиации в образовательных организациях»
Свидетельство и скидка на обучение каждому участнику
Урок химии 9 класс.
Тема: Реакции ионного обмена.
1.Сформировать у учащихся представления о реакций ионного обмена.
2. Научить составлять уравнения реакций ионного обмена между электролитами в молекулярном, полном ионном и сокращенном ионном виде.
3. Продолжить формирование практических навыков при работе с химическими веществами, умения обобщать и делать выводы.
Оборудование: химические реактивы: растворы HCl, H 2 SO 4 , KOH, BaCl 2 , Na 2 CO 3 , Na 2 SO 4 , KCl, фенолфталеин.
1.Актуализация опорных знаний.
1.Какие вещества называются электролитами?
2. Растворимость веществ. Таблица растворимости.
3.Какие электролиты относят к сильным, а какие к слабым?
Из данного перечня веществ выберите вещества, которые относятся к сильным, какие к слабым электролитам: NaNO 2 , H 2 S , LiNO 3 , HCl , Na 2 S , Ba ( OH ) 2 , Al ( OH ) 3 , NaOH , HNO 3 , H 2 SO 4 , HNO 2 , K 2 SO 3 , CH 3 COOH , NaNO 2 , K 2 CO 3 .
4.Напишите уравнения электролитической диссоциации следующих веществ:
б) Сульфат магния, гидроксид бария, фосфорная кислота, хлорид алюминия.
2.Мотивация к изучению нового учебного материала.
Что произойдет при сливании двух электролитов?
Какие процессы протекают в растворе при сливании двух и более электролитов?
3.Объяснение нового материала.
Опыт. К раствору хлорида бария прильем раствор сульфата калия. При этом образуется белый осадок.
Какое вещество выпало в осадок?
Для этого запишем уравнение реакции обмена и расставим коэффициенты:
Посмотрим в таблицу растворимости: BaSO 4 – нерастворимое вещество, оно и образует белый осадок:
Изучая электролитическую диссоциацию, мы узнали, что в водном растворе , каждое из этих веществ распадается на ионы. Следовательно, реакции в растворах протекают между ионами. Эти реакции называются ионными .
Запишем уравнение реакций в ионном виде, пользуясь следующими правилами:
1.Составим полное ионное уравнение (вещества, которые растворимы записываются виде ионов, газы, нерастворимые, малодиссоциируемые вещества записываются в молекулярном виде):
Ва 2+ + 2С l — + 2 H + + SO 4 2- = Ва SO 4
2.Приведем подобные. Найдем одинаковые ионы в левой и правой части уравнения, они не участвуют в реакции. Исключив их, запишем сокращенное ионное уравнение:
Сокращенное ионное уравнеие отражает суть реакции: ионы Ва 2+ связываются с ионами SO 4 2- и образуют осадок Ва SO 4
1.Реакции ионного обмена протекают в строну связывания ионов.
2.Реакции ионного обмена протекают в сторону образования слабого электролита.
Проведем еще один опыт: в пробирку с раствором карбоната калия прильем раствор соляной кислоты. Что наблюдается?
Происходит вспенивание. Выделение пузырьков газа. Какой это газ?
Для определения газа составим уравнение реакции и расставим коэффициенты:
В результате реакции образуется H 2 CO 3 , но она неустойчива и тут же распадается на H 2 O и CO 2.
Запишем ионные уравнения данной реакции:
2К + + С O 3 2- + 2 H + + 2 Cl — 2 K + + 2 Cl — + H 2 O + CO 2 – полное ионное уравнение
С O 3 2- + 2 H + H 2 O + CO 2 – сокращенное ионное уравнение
И еще один опыт: Как вы думаете, что произойдет при смешивании раствора гидроксида натрия с разбавленной серной кислотой. Как называется такая реакция между кислотой и щелочью и какой реактив необходим для наблюдения изменений в растворе?
Взаимодействие кислоты с щелочью называется реакцией нейтрализации. А для наблюдения изменений в растворе можно использовать индикатор – фенолфталеин.
К раствору щелочи добавим несколько капель фенолфталеина – раствор приобрел малиновую окраску. А теперь будем по капля приливать серную кислоту. Окраска исчезла, раствор снова стал прозрачным. Почему? Запишем уравнение данной реакции:
2 Na + + OH — + 2 H + + SO 4 2 — 2 Na + + SO 4 2- + H 2 O
OH — + 2 H + H 2 O
Почему возможна данная реакция?
Образуется слабый электролит – вода.
Отработка навыков написания уравнений реакций ионного обмена.
1.Если в результате реакции выделяется малодиссоциирующее (мд) вещество – вода.
Молекулярное уравнение реакции щелочи с кислотой:
KOH (р) + HCl (р) = KCl(р) + H 2 O (мд)
Полное ионное уравнение реакции:
K+ + OH– + H+ + Cl– = K+ + Cl– + H 2 O
Сокращённое ионное уравнение реакции:
2. Если в результате реакции выделяется нерастворимое в воде вещество.
Молекулярное уравнение реакции щелочи с солью:
CuCl 2 (р) + 2KOH (р) = 2KCl(р) + Cu(OH) 2 ↓
Полное ионное уравнение реакции:
Cu2+ + 2Cl– + 2K+ + 2OH– = 2K+ + 2Cl– + Cu(OH) 2 ↓.
Cокращенное ионное уравнение реакции:
Cu2+ + 2OH– = Cu(OH)2↓.
3. Если в результате реакции выделяется газообразное вещество.
Молекулярное уравнение реакции растворимой соли (сульфида) с кислотой:
K 2 S + 2HCl = 2KCl + H 2 S↑.
Полное ионное уравнение реакции:
2K+ + S 2– + 2H+ + 2Cl– = 2K+ + 2Cl – + H 2 S↑.
Сокращённое ионное уравнение реакции:
4.Расставьте коэффициенты в уравнениях реакций и запишите их в полном и сокращенном ионном виде:
Задания 1 уровня.
а ) CaCl 2 + AgNO 3 AgCl 
б ) Na 2 CO 3 + Ва Cl 2 BaCO 3 
в ) HCl + NaOH NaCl + H 2 O.
Задания 2 уровня.
При взаимодействии растворов каких веществ образуется осадок:
Задания 3 уровня.
Напишите молекулярные и ионные уравнения реакций между растворами:
а) гидроксида калия и нитрата меди (II);
б) соляной кислоты и гидроксида бария;
в) хлорида железа (III) и гидроксида натрия.
Сегодня на уроке мы узнали, что такое ионные реакции, в каком случае они возможны. Научились составлять полные и краткие уравнения таких реакций.
http://interneturok.ru/lesson/chemistry/9-klass/bhimicheskaya-svyaz-elektroliticheskaya-dissociaciyab/sostavlenie-uravneniy-reaktsiy-ionnogo-obmena
http://infourok.ru/razrabotka-uroka-po-himii-klass-ionnie-uravneniya-2490611.html