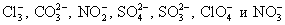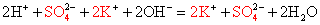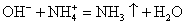§ 38. Ионные уравнения
Большинство химических реакций протекает в растворах. Растворы электролитов содержат ионы, поэтому реакции в растворах электролитов фактически сводятся к реакциям между ионами.
| Реакции между ионами называют ионными реакциями, а уравнения таких реакций — ионными уравнениями. |
При составлении ионных уравнений следует руководствоваться тем, что формулы веществ малодиссоциирующих, нерастворимых и газообразных записывают в молекулярном виде. Если вещество выпадает в осадок, то, как вы уже знаете, рядом с его формулой ставят стрелку, направленную вниз (↓), а если в ходе реакции выделяется газообразное вещество, то рядом с его формулой ставят стрелку, направленную вверх (↑).
Например, если к раствору сульфата натрия Na2SO4 прилить раствор хлорида бария ВаСl2 (рис. 132), то в результате реакции образуется белый осадок сульфата бария BaSO4. Запишем молекулярное уравнение реакции:
Рис. 132.
Взаимодействие сульфата натрия и хлорида бария
Перепишем это уравнение, изобразив сильные электролиты в виде ионов, а уходящие из сферы реакции — в виде молекул:
Мы записали, таким образом, полное ионное уравнение реакции. Если исключить из обеих частей равенства одинаковые ионы, т. е. ионы, не участвующие в реакции (2Na + и 2Сl — в левой и правой частях уравнения), то получим сокращённое ионное уравнение реакции:
Это уравнение показывает, что сущность реакции сводится к взаимодействию ионов бария Ва 2+ и сульфат-ионов 
Лабораторный опыт № 17
Взаимодействие растворов хлорида натрия и нитрата серебра
- К 1 мл раствора хлорида натрия в пробирке добавьте с помощью пипетки несколько капель раствора нитрата серебра. Что наблюдаете? Запишите молекулярное и ионное уравнения реакции. Согласно сокращённому ионному уравнению предложите несколько вариантов проведения такой реакции с другими электролитами. Запишите молекулярные уравнения проделанных реакций.
Таким образом, сокращённые ионные уравнения представляют собой уравнения в общем виде, которые характеризуют сущность химической реакции и показывают, какие ионы реагируют и какое вещество образуется в результате.
| Реакции ионного обмена протекают до конца в тех случаях, когда образуется осадок, газ или малодиссоциирующее вещество, например вода. |
Рис. 133.
Взаимодействие азотной кислоты и гидроксида натрия
Если к раствору гидроксида натрия, окрашенного фенолфталеином в малиновый цвет, прилить избыток раствора азотной кислоты (рис. 133), то раствор обесцветится, что послужит сигналом протекания химической реакции:
Полное ионное уравнение этой реакции:
Na + + OН — + Н + + NO3 = Na + + NO — 3 + Н2O.
Но поскольку ионы Na + и NO — 3 в растворе остаются в неизменном виде, то их можно не писать, и в конечном итоге сокращённое ионное уравнение реакции записывают так:
Оно показывает, что взаимодействие сильной кислоты и щёлочи сводится к взаимодействию ионов Н + и ионов ОН — , в результате которого образуется малодиссоциирующее вещество — вода.
| Реакцию взаимодействия сильной кислоты с щёлочью называют реакцией нейтрализации. Это частный случай реакции обмена. |
Подобная реакция обмена может протекать не только между кислотами и щелочами, но и между кислотами и нерастворимыми основаниями. Например, если получить голубой осадок нерастворимого гидроксида меди (II) взаимодействием сульфата меди (II) с щёлочью (рис. 134):
а затем поделить полученный осадок на три части и прилить к осадку в первой пробирке раствор серной кислоты, к осадку во второй пробирке — соляной кислоты, а к осадку в третьей пробирке раствор азотной кислоты, то во всех трёх пробирках осадок растворится (рис. 135).
Рис. 135.
Взаимодействие гидроксида меди (II) с кислотами:
а — серной; б — соляной; в — азотной
Это будет означать, что во всех случаях прошла химическая реакция, суть которой и отражена с помощью одного и того же ионного уравнения.
Чтобы в этом убедиться, запишите молекулярные, полные и сокращённые ионные уравнения приведённых реакций.
Лабораторный опыт № 18
Получение нерастворимого гидроксида и взаимодействие его с кислотами
- В три пробирки налейте по 1 мл раствора хлорида или сульфата железа (III). Прилейте в каждую пробирку по 1 мл раствора щёлочи. Что наблюдаете? Затем добавьте в пробирки соответственно растворы серной, азотной и соляной кислот до исчезновения осадка. Запишите молекулярные и ионные уравнения реакции.
Предложите несколько вариантов проведения такой реакции с другими электролитами. Запишите молекулярные уравнения предложенных реакций.
Рассмотрим ионные реакции, которые протекают с образованием газа.
В две пробирки нальём по 2 мл растворов карбоната натрия и карбоната калия. Затем в первую прильём соляной, а во вторую — раствор азотной кислоты (рис. 136). В обоих случаях мы заметим характерное «вскипание» из-за выделяющегося углекислого газа.
Рис. 136.
Взаимодействие растворимых карбонатов:
а — с соляной кислотой; б — с азотной кислотой
Запишем молекулярное и ионные уравнения реакции для первого случая:
Реакции, протекающие в растворах электролитов, записывают с помощью ионных уравнений. Эти реакции называют реакциями ионного обмена, так как в раствоpax электролиты обмениваются своими ионами. Таким образом, можно сделать два вывода.
| 1. Реакции в водных растворах электролитов являются реакциями между ионами, а потому их изображают в виде ионных уравнений. 2. Реакции ионного обмена в растворах электролитов практически необратимо протекают только в том случае, если в результате образуется осадок, газ или малодиссоциирую-щее вещество (например, вода). |
Ключевые слова и словосочетания
- Молекулярное и ионное уравнения реакций.
- Реакции ионного обмена.
- Реакции нейтрализации.
Работа с компьютером
- Обратитесь к электронному приложению. Изучите материал урока и выполните предложенные задания.
- Найдите в Интернете электронные адреса, которые могут служить дополнительными источниками, раскрывающими содержание ключевых слов и словосочетаний параграфа. Предложите учителю свою помощь в подготовке нового урока — сделайте сообщение по ключевым словам и словосочетаниям следующего параграфа.
Вопросы и задания
- Запишите молекулярные и ионные уравнения реакций, о которых говорилось в первой части параграфа, — между сульфатом калия и нитратом бария, между серной кислотой и хлоридом бария. В чём суть обеих реакций?
- Запишите молекулярные и ионные уравнения реакций, о которых говорилось во второй части параграфа, — между гидроксидом меди (II) и соляной кислотой, между гидроксидом меди (II) и азотной кислотой. В чём суть обеих реакций?
- Запишите молекулярное и ионное уравнения реакций между карбонатом калия и фосфорной кислотой. Что объединяет эту реакцию и те реакции, о которых говорилось в конце параграфа?
- Предложите примеры реакций, протекающих с образованием осадков, пользуясь таблицей растворимости. Уравнения реакций запишите в молекулярной и ионной формах.
- Приведите по два молекулярных уравнения реакций для следующих ионных:
Ионные уравнения
Ионные уравнения — неотъемлемая часть сложной и интересной химической науки. Такие уравнения позволяют наглядно увидеть, какие ионы вступают в химические превращения. В виде ионов записывают вещества, которые подвергаются электролитической диссоциации. Разберем историю вопроса, алгоритм составления ионных уравнений и примеры задач.
ИСТОРИЯ ВОПРОСА
Еще древние алхимики, проводя нехитрые химические реакции в поисках философского камня и записывая в толстые фолианты результаты своих исследований, использовали определенные знаки для химических веществ. У каждого ученого была своя система, что неудивительно: каждый хотел защитить свои тайные знания от происков завистников и конкурентов. И лишь в VIII веке появляются единые обозначения для некоторых элементов.
В 1615 году Жан Бегун в своей книге «Начала химии», что по праву считается одним из первых учебников в этом разделе естествознания, предложил использовать условные обозначения для записи химических уравнений. И лишь в 1814 году шведский химик Йонс Якоб Берцелиус создал систему химических символов на основе одной или двух первых букв латинского названия элемента, подобную той, с которой ученики знакомятся на уроках.
В восьмом классе (параграф 12, учебник «Химия. 8 класс» под редакцией В.В. Еремина) ребята научились составлять молекулярные уравнения реакций, где и реагенты, и продукты реакций представлены в виде молекул.
Однако это упрощенный взгляд на химические превращения. И об этом задумывались ученые уже в XVIII веке.
Аррениус в результате своих экспериментов выяснил, что растворы некоторых веществ проводят электрический ток. И доказал, что вещества, обладающие электропроводностью, в растворах находятся в виде ионов: положительно заряженных катионов и отрицательно заряженных анионов. И именно эти заряженные частицы вступают в реакции.
ЧТО ТАКОЕ ИОННЫЕ УРАВНЕНИЯ
Ионные уравнения реакций — это химические равенства, в которых вещества, вступающие в реакцию, и продукты реакций обозначены в виде диссоциированных ионов. Уравнения данного типа подходят для записи химических реакций замещения и обмена в растворах.
Ионные уравнения — неотъемлемая часть сложной и интересной химической науки. Такие уравнения позволяют наглядно увидеть, какие ионы вступают в химические превращения. В виде ионов записывают вещества, которые подвергаются электролитической диссоциации (тема подробно разбирается в параграфе 10, учебник «Химия. 9 класс» под редакцией В.В. Еремина). В виде молекул записывают газы, вещества, выпадающие в осадок, и слабые электролиты, которые практически не диссоциируют. Газы обозначаются стрелкой вверх (↑), субстанции, выпадающие в осадок, стрелкой вниз (↓).
ОСОБЕННОСТИ ИОННЫХ УРАВНЕНИЙ
1. Реакции ионного обмена, в отличие от окислительно-восстановительных реакций, протекают без нарушения валентности веществ, вступающих в химические превращения.

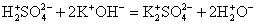
2. Реакции между ионами протекают при условии образования в ходе реакции плохорастворимого осадка, выделения летучего газа или образования слабых электролитов.
Удивительно, что реакции обмена могут проходить даже с нерастворимыми солями слабых кислот. В этом случае сильная кислота вытесняет слабую из ее солей. В качестве примера можно привести сокращенное ионное уравнение разведения карбоната кальция в сильных кислотах.
АЛГОРИТМ СОСТАВЛЕНИЯ ИОННОГО УРАВНЕНИЯ
Записываем молекулярное уравнение химического процесса.
Балансируем молекулярное уравнение с помощью коэффициентов.
Чтобы правильно сбалансировать равенство, нужно вспомнить закон сохранения массы веществ (параграф 12, «Химия. 8 класс» под редакцией В.В. Еремина), согласно которому в ходе химических превращений новые атомы не появляются, а старые не разрушаются. Т.е. число атомов в продуктах реакции равно числу атомов в исходных веществах. Помним, что водород и кислород уравниваем в последнюю очередь.
Определяем, какие вещества в химической реакции диссоциируют, т.е. распадаются на ионы.
Записываем в виде ионов:
- растворимые соли;
- сильные кислоты (H2SO4, HNO3, HCl и др.);
- растворимые в воде основания.
Записываем в виде молекул:
- нерастворимые соли;
- слабые кислоты, щелочи, вода;
- оксиды;
- газы;
- простые вещества;
- большинство органических соединений.
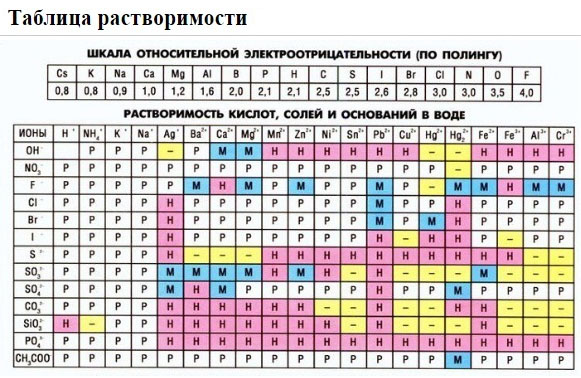
Если есть сомнения в растворимости реагента или продукта реакции, можно проверить по специальной таблице, которая является справочным материалом, ей можно пользоваться на различных экзаменах.
В таблице, помимо растворимости соединений, представлены также заряды катионов и анионов, участвующих в реакциях.
Определяем многоатомные ионы.
Это необходимо сделать, т.к. данные соединения не разлагаются на отдельные атомы и имеют свой заряд. Чаще всего в химических превращениях участвуют следующие многоатомные ионы:
Записываем равенство таким образом, чтобы все диссоциирующие субстанции были представлены в виде катионов и анионов.
Проверяем, чтобы уравнение было сбалансировано, т.е. количество различных атомов в частях с реагентами и продуктами реакции совпадало.
На данном этапе мы получили полное ионное уравнение.
Вычеркиваем идентичные ионы в обеих частях равенства, т.е. катионы и анионы с одинаковыми нижними индексами и зарядами, и переписываем равенство без данных ионов.
Проверяем, чтобы количество атомов элементов совпадало в правой и левой частях уравнения. Таким образом получаем краткое ионное уравнение.
ПРИМЕРЫ
Задача 1
Выясните, произойдет ли химическое взаимодействие между растворами гидроксида калия и хлорида аммония. (Записать для реакции молекулярное, полное ионное и сокращенное ионное уравнение.)
Записываем молекулярное уравнение, проверяем коэффициенты.
Помним, что гидроксид аммония — нестабильное соединение и разлагается на аммиак и воду.
Записываем окончательное уравнение:
NB! Благодаря летучести и резкому раздражающему запаху 3%-й раствор NH3 называется «нашатырный спирт» и используется в медицине.
Подсматривая в таблицу растворимости, помечаем полное ионное уравнение, не забывая о зарядах ионов.
Вычеркивая идентичные катионы и анионы в обеих частях реакции, составляем краткое ионное уравнение.
Делаем вывод: химическая реакция между гидроксидом калия и хлоридом аммония протекает с образованием воды и выделением аммиака — летучего газа с резким запахом.
Задача 2
А сейчас выполним задание из учебника «Химия. 9 класс» под редакцией В.В. Еремина.
Налейте в пробирку 1 мл раствора карбоната натрия и аккуратно прилейте к нему пару капелек соляной кислоты.
Составьте уравнение реакции, напишите полное и сокращенное ионные уравнения.
Записываем реакцию в молекулярном виде, расставляем коэффициенты, если это необходимо.
Подсматривая в таблицу растворимости, записываем полное ионное уравнение, не забывая отмечать заряды ионов.
Вычеркивая одинаковые катионы и анионы в правой и левой частях равенства, составляем краткое ионное уравнение.
Вопрос «Что происходит?» остался без ответа. К сожалению, в домашних условиях этот опыт осуществить трудновато, так как стиральной содой уже давно никто не пользуется, да и соляную кислоту в аптеке уже не продают. Но примерно такой же визуальный эффект можно наблюдать, если смешать раствор пищевой соды с раствором уксусной кислоты.
Открытый урок по химии на тему «Ионные уравнения» (8 класс)
Обращаем Ваше внимание, что в соответствии с Федеральным законом N 273-ФЗ «Об образовании в Российской Федерации» в организациях, осуществляющих образовательную деятельность, организовывается обучение и воспитание обучающихся с ОВЗ как совместно с другими обучающимися, так и в отдельных классах или группах.
Выберите документ из архива для просмотра:
Выбранный для просмотра документ Технологическая карта для гостей.doc
Автор учебника : О.С.Габриелян
Тема урока: Ионные реакции
— выяснить условия необратимости реакций в растворах;
— организовать деятельность по осознанию обучающимися алгоритма составления ионных уравнений;
— выделять существенные признаки реакций ионного обмена;
— сформировать практические умения и навыки по выполнению лабораторных опытов;
— развитие логического мышления учащихся путём выявления причинно-следственной связи между строением и свойствами веществ;
— способствовать формированию и развитию познавательного интереса учащихся к обучению.
Планируемые результаты обучения, планируемый уровень достижений.
Формулируют и воспроизводят понятия «Электролиты», «неэлектролиты», Дают определение «Электролитической диссоциации»,
Определяют ионные реакции, как реакции, протекающие между растворами электролитов.
Проводят опыты, наблюдают, описывают наблюдения
освоение алгоритма написания реакций ионного обмена,
действия по образцу
Преобразуют практическую задачу в познавательную
Планируют собственную деятельность
Осуществляют контроль и самооценку своих действий и взаимооценку.
Управление своей деятельностью на уроке
совместная деятельность учителя и учащихся
Проводят наблюдение, анализ, выдвигают предположения.
осуществляют экспериментальную проверку своих гипотез
совместные (групповые) действия, выполняемые под руководством учителя
Обмениваются знаниями между членами группы для принятия эффективных решений
Навыки сотрудничества: совместные (групповые), выполняемые под руководством учителя
Проявляют устойчивый интерес к поиску решения проблемы
Мотивация на решение проблемы
устойчивый познавательный интерес
Формы организации познавательной деятельности обучающихся: индивидуальная, парная, фронтальная.
Тип урока: урок усвоения новых знаний.
Оборудование: таблица химических элементов Д.И.Менделеева, таблица растворимости, презентация, компьютер, проектор, экран, рабочая карта; штативы с пробирками, 1 стол: растворы хлорида натрия, нитрата серебра, сульфата натрия хлорида бария
2 стол: растворы карбоната натрия, серной кислоты, хлорида цинка, нитрата серебра
3 стол: растворы гидроксида натрия, серной кислоты, фенолфталеин, пипетка, хлорид алюминия, нитрат серебра. На столе учителя растворы нитрата серебра и хлорида меди, штатив с чистыми пробирками.
Постановка цели и задач урока. Мотивация учебной деятельности учащихся.
На доске находятся карточки с различными понятиями
-Предлагаю распределить эти карточки на группы знаю, не знаю, умею, не умею (электролитическая диссоциация, электролит, писать уравнения диссоциации, кислоты, основания, соли, неэлектролит, условия протекания реакций обмена до конца, катионы, анионы, реакция обмена, ионные реакции, ионные уравнения, писать ионные уравнения
-Предлагаю повторить понятия, которые уже знакомы
-Какие из этих понятий незнакомы?
-Попробуйте сформулировать тему урока.
— Запишите тему урока в рабочие листки ( « Ионные реакции »)
-Попробуйте поставить цели сегодняшнего урока.
Все ли реакции ионного обмена идут до конца?
На сегодняшнем уроке мы должны выяснить, какие реакции называются реакциями ионного обмена и научиться составлять ионные уравнения .
Распределяют понятия на группы
Повторяют фронтально знакомые понятия
Формулируют тему урока ( « Ионные реакции »).
Записывают тему урока в рабочих листках
Формулируют цели урока
-узнать, что такое «реакции ионного обмена»
-Научиться составлять уравнения ионных реакций
-Рассмотреть условия протекания данных реакций до конца.
Предлагает выполнить самостоятельную работу — (задания в рабочем листке). Время выполнения работы — около 5 минут.
Предлагает осуществить взаимопроверку, сравнив с эталоном на слайде.
Выполняют самостоятельную работу
Первичное усвоение новых знаний
Вы уже знакомы с реакциями обмена. Вам также известно, что данные реакции возможны лишь в тех случаях, если в результате реакции выделяется осадок или газ или вода.
Теперь вам известно, что в растворах кислот, оснований и солей молекул практически нет, а есть ионы водорода, гидроксид-ионы, ионы металлов и кислотных остатков. Отсюда следует вывод, что реакции между растворами этих веществ сводятся к взаимодействию ионов. Попробуйте сформулировать понятие «ионные реакции»
Что же такое ионные уравнения?
Найдите в учебнике определение ионных реакций. Прочитайте.
Сейчас мы будем учиться писать уравнения ионных реакций.
Показывает Демонстрационный эксперимент
Оборудование и реактивы: растворы C u Cl 2 , AgNO 3 , чистые пробирки.
а) В пробирку наливаем раствор C u Cl 2
б) В пробирку с раствором C u Cl 2 , добавим AgNO 3 .
Что наблюдаете? Запишите молекулярное и ионные уравнения химической реакции в рабочих листах в колонке «Выполнение действий».
Сущность данной реакции сводится к взаимодействию ионов Ag + и Cl — ; в результате этого взаимодействия образуется осадок AgCl
— попробуйте описать наши действия по составлению ионных уравнений, заполнив устно первую колонку «Последовательность действий»
Данные ионы могли входить в состав любого электролита и наблюдалась бы аналогичная реакция.
Дает задание. По таблице растворимости выберите любые другие электролиты, содержащие ионы Ag + и Cl .
Есть ли такие реактивы на вашем столе? Соблюдая технику безопасности, проведите химический эксперимент, согласно сокращённому ионному уравнению. Прокомментируйте результаты опытов
Попробуйте сделать вывод.
Вывод: Таким образом, сокращенные ионные уравнения показывают сущность процесса, протекающего между растворами электролитов.
Вопрос. А какие признаки химических реакций вы знаете?
Для того, чтобы выяснить условия протекания данных реакций до конца выполним лабораторные опыты. Инструкция к работе у вас на столах.
Учащимся предлагается работа в парах. Для каждой пары приводится отдельное задание (учитель делает акцент на правилах по ТБ.
Лабораторный опыт № 1 “Реакции, идущие с образованием осадка”.
Лабораторный опыт № 3 “Реакции, идущие с образованием газа”.
Лабораторный опыт № 3 “Реакции, идущие с образованием слабого электоролита – воды”
Результаты лабораторной работы проверяются, комментируются учителем,
Химик правила обмена не забудет никогда:
В результате — непременно будет газ или вода,
Выпадет осадок, вот тогда — порядок!
Формулируют понятие ионные реакции (реакции, протекающие между ионами)
Отвечают ( это уравнения ионных реакций)
Затем один из учащихся читает это определение.
Смотрят эксперимент, слушают объяснение , отвечают, делают запись в рабочем листе.
Проговаривают алгоритм действий
Пользуясь таблицей растворимости выбирают вещества, в которые содержат такие же ионы
Подбирают реактивы, проводят лабораторный опыт
Делают вывод (по заданию): можно взять любой растворимый хлорид и любую растворимую соль серебра.
Отвечают (образование осадка, газа , изменение цвета, запаха, выделение тепла, света, изменениетемпературы)
Учащиеся проводят опыт, руководствуясь инструкцией, находящейся на их столе и соблюдая технику безопасности.
Пары обсуждают полученные результаты, готовятся к ответу.
Ионные уравнения реакций учащиеся записывают на доске, используя алгоритм составления ионных уравнений реакций., второй объясняет ход эксперимента. Класс в это время внимательно слушает и записывает все уравнения реакций, комментируя ошибки, если таковые имеются.
Предлагает выполнить проверочную работу с последующей самопроверкой по эталону. (самооценка)
Выполняют проверочную работу. Оценивают работу по 5- бальной шкале.
Информация о домашнем задании, инструктаж по его выполнению.
Информирует о домашнем задании.
1 уровень (для всех).
2 уровень (по желанию)
Подготовить мультимедийную презентацию о практическом значении реакций ионного обмена.
(задания на рабочем листке)
Записывают домашнее задание.
-Достигли ли вы целей, поставленных на урок?
Оцените свою работу на уроке.
Подводит итог урока.
1.На уроке я работал
2.Своей работой на уроке я
3.Урок для меня показался
4.За урок я
5.Мое настроение
6.Материал урока мне был
7.Домашнее задание мне кажется
активно / пассивно
доволен / не доволен
коротким / длинным
не устал / устал
стало лучше / стало хуже
понятен / не понятен
полезен / бесполезен
интересен / скучен
легким / трудным
интересно / не интересно
Отвечают на вопрос.
Оценивают свою работу на уроке.
Выбранный для просмотра документ открытый урок.ppt
Описание презентации по отдельным слайдам:
Цель урока Узнать, что такое «реакции ионного обмена» Научиться составлять уравнения ионных реакций Рассмотреть условия протекания данных реакций до конца
Ответы на вопросы самостоятельной работы (взаимопроверка) 1 2 3 4 5 КОН↔K+ + OH Н2SO4↔2H+ + SO42- Na2CO3↔2 Na+ + CO32- а, в, д А Газ, вода, осадок Электролитынеэлектролиты А, в, дБ, г, е, ж
Оценка 0- 1 ошибок — оценка «5» 2-4 ошибки — оценка «4» 5-6 ошибок — оценка «3» 7 ошибок — оценка «2»
Определения «ионные реакции»- «ионные уравнения» — реакции, протекающие между ионами это уравнения ионных реакций
Алгоритм составления ионных уравнений CuCl2+ 2AgNO3→Cu(NO3)2 +2AgCl CuCl2 –Р, AgNO3- -Р, Cu(NO3)2 – Р, AgCl — Н Cu 2+2Cl-+ 2Ag+ +2NO3-→Cu2+ +2NO3- +2AgCl↓ 2Ag+ +2Cl- →2AgCl↓ Записать молекулярное уравнение реакции, подобрать коэффициенты С помощью таблицы растворимости определить растворимость каждого вещества Составить полное ионное уравнение реакции, записав электролиты в виде ионов, неэлектролиты в молекулярном виде. Составить сокращённое ионное уравнение, сократив одинаковые ионы в левой и правой частях уравнения. Последовательность действийВыполнение действий 1. 2. 3. 4.
Задание. По таблице растворимости выберите любые другие электролиты, содержащие ионы Ag+ и Cl- . Найдите реактивы на вашем столе, содержащие ионы Ag+ и Cl- . Соблюдая технику безопасности, проведите химический эксперимент, согласно сокращённому ионному уравнению. Ag+ +Cl- →AgCl↓
Лабораторные опыты в парах Химик правила обмена не забудет никогда: В результате — непременно будет газ↑ или вода, Выпадет осадок↓, вот тогда — порядок!
Ответы к итоговому тесту 1.В 2.В 3.Д 4.В 5.А 6.Г 7.Б 8.Б 0- ошибок — оценка «5» 1-2 ошибки — оценка «4» 3-4 ошибки — оценка «3» 5 ошибок — оценка «2»
Достигли ли мы цели? Узнать, что такое «реакции ионного обмена» Научиться составлять уравнения ионных реакций Рассмотреть условия протекания данных реакций до конца
Рефлексия Оцените свою работу на уроке.
Выбранный для просмотра документ рабочая карта.doc
Время выполнения работы — около 5 минут.
Осуществить взаимопроверку, сравнив с эталоном на слайде
Разделите перечисленные ниже вещества на два столбика — электролиты и неэлектролиты.;
а) хлорид натрия (раствор)
б) сахар (раствор)
в) сульфат натрия (раствор)
г) гидроксид калия (крист.)
д) раствор серной кислоты
е) оксид углерода( IV )
Составьте уравнения диссоциации KOH; H 2 SO 4 ; Na 2 CO 3
Найдите среди предложенных реакций реакции обмена . Выписать буквы правильных ответов
Какая из реакций обмена (задание 3) протекает с образованием газа? Выписать букву правильного ответа
Перечислите условия протекания реакций обмена до конца
Реакция обмена идёт до конца, если
Алгоритм составления ионных уравнений
Лабораторный опыт № 1 “Реакции, идущие с образованием осадка”.
Оборудование и реактивы: растворы хлорида бария ВаCl2, сульфата натрия Na2SO4, штатив с пробирками.
Распределите обязанности в паре. Один проводит эксперимент на месте и у доски и рассказывает о последовательности действий и наблюдениях. Второй записывает уравнение реакции на доске в молекулярном и ионном виде и комментирует записи.
Налейте в чистую пробирку ≈1 мл раствора хлорида бария ВаCl2
К нему прилейте аккуратно ≈1 мл сульфата натрия Na2SO4.
Какие признаки реакции вы наблюдали? _________________________
Записываем уравнение реакции в молекулярном и ионном виде
Лабораторный опыт № 3 “Реакции, идущие с образованием газа”.
Оборудование и реактивы: растворы карбоната натрия Na2CO3, серной кислоты H2SO4, штатив с пробирками.
Распределите обязанности в паре. Один проводит эксперимент на месте и у доски и рассказывает о последовательности действий и наблюдениях. Второй записывает уравнение реакции на доске в молекулярном и ионном виде и комментирует записи.
Налейте в чистую пробирку ≈1 мл раствора карбоната натрия Na2CO3
К нему прилейте аккуратно ≈1 мл серной кислоты H2SO4.
Какие признаки реакции вы наблюдали?________________________
Записываем уравнение реакции в молекулярном и ионном виде .
Лабораторный опыт № 3 “Реакции, идущие с образованием слабого электоролита – воды”.
Оборудование и реактивы: растворы гидроксида натрия NaОН, серной кислоты H2SO4, фенолфталеина, штатив с пробирками.
Распределите обязанности в паре. Один проводит эксперимент на месте и у доски и рассказывает о последовательности действий и наблюдениях. Второй записывает уравнение реакции на доске в молекулярном и ионном виде и комментирует записи.
Налейте в чистую пробирку ≈1 мл раствора гидроксида натрия NaОН
К нему прилейте по каплям фенолфталеин.
Какие признаки реакции вы наблюдали? ______________
Прилейте аккуратно ≈1 мл серной кислоты H2SO4.
Какие признаки реакции вы наблюдали? ____________________
Записываем уравнение реакции в молекулярном и ионном виде .
1.Ответить на вопросы теста (выбрать одну букву, соответствующую правильному ответу)
2.Провести самопроверку по эталону.
1. Реакции ионного обмена – это реакции:
А. Разложения. В. Обмена
Б. Замещения. Д. Соединения
2. Укажите уравнение реакции ионного обмена:
3. Реакцией нейтрализации является реакция между парой веществ:
5. Формулы веществ, при взаимодействии которых образуется вода:
А. Fe(OH) 2 и HNO 3
Б. К 2 SiO 3 и HNO 3
В. КOH и Zn(NO 3 ) 2
Д.MgCO 3 и Ba(NO 3 ) 2
6. Уравнению реакции Zn(OH) ₂ ↓ + H ₂ SO ₄ = ZnSO ₄ + 2H ₂ O соответствует сокращённое ионное уравнение
А. H ⁺ + OH ⁻ = H ₂ O
Б Zn² ⁺ + SO ₄ ² ⁻ = ZnSO ₄
В. H ₂ SO ₄ + Zn² ⁺ = ZnSO ₄ + H ₂ O
Г . Zn(OH) ₂ ↓ + 2H ⁺ = Zn² ⁺ + 2H ₂ O
7. Практически необратимо протекает реакция ионного обмена между растворами
А. хлорида калия и нитрата цинка
Б . сульфата калия и нитрата бария
В. сульфата натрия и гидроксида калия
Г. нитрата натрия и сульфата железа (||)
8. С выделением газа протекает реакция между
А. силикатом калия и гидроксидом кальция
Б. карбонатом кальция и соляной кислотой
В. нитратом цинка и оксидом бария
Г сульфатом калия и хлоридом магния
1 уровень (для всех).
Саша и Алеша делали домашнее задание. Они составили уравнения реакций, но случайно на лист бумаги пролили чернила. Помогите ученикам восстановить запись. Составьте к восстановленным
Колдунья с вороном отравили лечебный колодец, в котором был раствор хлористого кальция, который помогал целому городу. Он использовался горожанами при отравлениях, кровотечениях, аллергиях. Они превратили раствор СaCl2 в нерастворимый известняк CaCO3. Помогите жителям “расколдовать” колодец, если в вашем распоряжении есть растворы NaCl, Na2CO3, HCl, H2SO4, Zn(NO3)2.
Олененок спешит к друзьям. Он шел долгих 3 дня. Ему осталось только перейти реку, но река оказалась испорчена – она наполнена раствором серной кислоты. Помогите Олененку воссоединиться с друзьями, если в вашем распоряжении есть растворы NaCl, Ba(OH)2 HCl, CuSO4, Ba(NO3)2.
2 уровень (по желанию)
Подготовить мультимедийную презентацию о практическом значении реакций ионного обмена.
(задания на доске)
активно / пассивно
доволен / не доволен
коротким / длинным
не устал / устал
стало лучше / стало хуже
понятен / не понятен
полезен / бесполезен
интересен / скучен
легким / трудным
интересно / не интересно
Для реакций ионного обмена составляютполные и сокращенные ионные уравнения. При этом на ионы никогда не раскладывают :
нерастворимые вещества (см. таблицу растворимости);
http://rosuchebnik.ru/material/ionnye-uravneniya/
http://infourok.ru/otkrytyj-urok-po-himii-na-temu-ionnye-uravneniya-8-klass-4160325.html