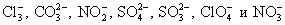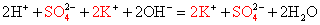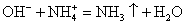§ 38. Ионные уравнения
Большинство химических реакций протекает в растворах. Растворы электролитов содержат ионы, поэтому реакции в растворах электролитов фактически сводятся к реакциям между ионами.
| Реакции между ионами называют ионными реакциями, а уравнения таких реакций — ионными уравнениями. |
При составлении ионных уравнений следует руководствоваться тем, что формулы веществ малодиссоциирующих, нерастворимых и газообразных записывают в молекулярном виде. Если вещество выпадает в осадок, то, как вы уже знаете, рядом с его формулой ставят стрелку, направленную вниз (↓), а если в ходе реакции выделяется газообразное вещество, то рядом с его формулой ставят стрелку, направленную вверх (↑).
Например, если к раствору сульфата натрия Na2SO4 прилить раствор хлорида бария ВаСl2 (рис. 132), то в результате реакции образуется белый осадок сульфата бария BaSO4. Запишем молекулярное уравнение реакции:
Рис. 132.
Взаимодействие сульфата натрия и хлорида бария
Перепишем это уравнение, изобразив сильные электролиты в виде ионов, а уходящие из сферы реакции — в виде молекул:
Мы записали, таким образом, полное ионное уравнение реакции. Если исключить из обеих частей равенства одинаковые ионы, т. е. ионы, не участвующие в реакции (2Na + и 2Сl — в левой и правой частях уравнения), то получим сокращённое ионное уравнение реакции:
Это уравнение показывает, что сущность реакции сводится к взаимодействию ионов бария Ва 2+ и сульфат-ионов 
Лабораторный опыт № 17
Взаимодействие растворов хлорида натрия и нитрата серебра
- К 1 мл раствора хлорида натрия в пробирке добавьте с помощью пипетки несколько капель раствора нитрата серебра. Что наблюдаете? Запишите молекулярное и ионное уравнения реакции. Согласно сокращённому ионному уравнению предложите несколько вариантов проведения такой реакции с другими электролитами. Запишите молекулярные уравнения проделанных реакций.
Таким образом, сокращённые ионные уравнения представляют собой уравнения в общем виде, которые характеризуют сущность химической реакции и показывают, какие ионы реагируют и какое вещество образуется в результате.
| Реакции ионного обмена протекают до конца в тех случаях, когда образуется осадок, газ или малодиссоциирующее вещество, например вода. |
Рис. 133.
Взаимодействие азотной кислоты и гидроксида натрия
Если к раствору гидроксида натрия, окрашенного фенолфталеином в малиновый цвет, прилить избыток раствора азотной кислоты (рис. 133), то раствор обесцветится, что послужит сигналом протекания химической реакции:
Полное ионное уравнение этой реакции:
Na + + OН — + Н + + NO3 = Na + + NO — 3 + Н2O.
Но поскольку ионы Na + и NO — 3 в растворе остаются в неизменном виде, то их можно не писать, и в конечном итоге сокращённое ионное уравнение реакции записывают так:
Оно показывает, что взаимодействие сильной кислоты и щёлочи сводится к взаимодействию ионов Н + и ионов ОН — , в результате которого образуется малодиссоциирующее вещество — вода.
| Реакцию взаимодействия сильной кислоты с щёлочью называют реакцией нейтрализации. Это частный случай реакции обмена. |
Подобная реакция обмена может протекать не только между кислотами и щелочами, но и между кислотами и нерастворимыми основаниями. Например, если получить голубой осадок нерастворимого гидроксида меди (II) взаимодействием сульфата меди (II) с щёлочью (рис. 134):
а затем поделить полученный осадок на три части и прилить к осадку в первой пробирке раствор серной кислоты, к осадку во второй пробирке — соляной кислоты, а к осадку в третьей пробирке раствор азотной кислоты, то во всех трёх пробирках осадок растворится (рис. 135).
Рис. 135.
Взаимодействие гидроксида меди (II) с кислотами:
а — серной; б — соляной; в — азотной
Это будет означать, что во всех случаях прошла химическая реакция, суть которой и отражена с помощью одного и того же ионного уравнения.
Чтобы в этом убедиться, запишите молекулярные, полные и сокращённые ионные уравнения приведённых реакций.
Лабораторный опыт № 18
Получение нерастворимого гидроксида и взаимодействие его с кислотами
- В три пробирки налейте по 1 мл раствора хлорида или сульфата железа (III). Прилейте в каждую пробирку по 1 мл раствора щёлочи. Что наблюдаете? Затем добавьте в пробирки соответственно растворы серной, азотной и соляной кислот до исчезновения осадка. Запишите молекулярные и ионные уравнения реакции.
Предложите несколько вариантов проведения такой реакции с другими электролитами. Запишите молекулярные уравнения предложенных реакций.
Рассмотрим ионные реакции, которые протекают с образованием газа.
В две пробирки нальём по 2 мл растворов карбоната натрия и карбоната калия. Затем в первую прильём соляной, а во вторую — раствор азотной кислоты (рис. 136). В обоих случаях мы заметим характерное «вскипание» из-за выделяющегося углекислого газа.
Рис. 136.
Взаимодействие растворимых карбонатов:
а — с соляной кислотой; б — с азотной кислотой
Запишем молекулярное и ионные уравнения реакции для первого случая:
Реакции, протекающие в растворах электролитов, записывают с помощью ионных уравнений. Эти реакции называют реакциями ионного обмена, так как в раствоpax электролиты обмениваются своими ионами. Таким образом, можно сделать два вывода.
| 1. Реакции в водных растворах электролитов являются реакциями между ионами, а потому их изображают в виде ионных уравнений. 2. Реакции ионного обмена в растворах электролитов практически необратимо протекают только в том случае, если в результате образуется осадок, газ или малодиссоциирую-щее вещество (например, вода). |
Ключевые слова и словосочетания
- Молекулярное и ионное уравнения реакций.
- Реакции ионного обмена.
- Реакции нейтрализации.
Работа с компьютером
- Обратитесь к электронному приложению. Изучите материал урока и выполните предложенные задания.
- Найдите в Интернете электронные адреса, которые могут служить дополнительными источниками, раскрывающими содержание ключевых слов и словосочетаний параграфа. Предложите учителю свою помощь в подготовке нового урока — сделайте сообщение по ключевым словам и словосочетаниям следующего параграфа.
Вопросы и задания
- Запишите молекулярные и ионные уравнения реакций, о которых говорилось в первой части параграфа, — между сульфатом калия и нитратом бария, между серной кислотой и хлоридом бария. В чём суть обеих реакций?
- Запишите молекулярные и ионные уравнения реакций, о которых говорилось во второй части параграфа, — между гидроксидом меди (II) и соляной кислотой, между гидроксидом меди (II) и азотной кислотой. В чём суть обеих реакций?
- Запишите молекулярное и ионное уравнения реакций между карбонатом калия и фосфорной кислотой. Что объединяет эту реакцию и те реакции, о которых говорилось в конце параграфа?
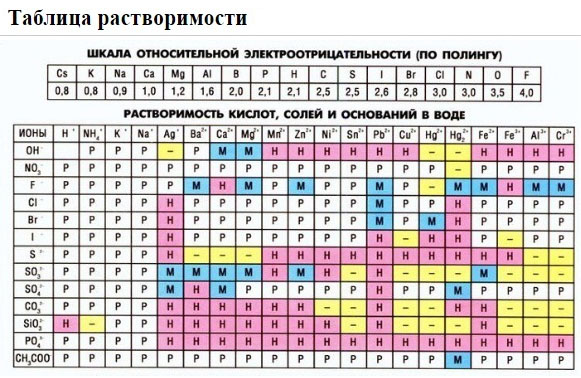
- Предложите примеры реакций, протекающих с образованием осадков, пользуясь таблицей растворимости. Уравнения реакций запишите в молекулярной и ионной формах.
- Приведите по два молекулярных уравнения реакций для следующих ионных:
Ионные уравнения
Ионные уравнения — неотъемлемая часть сложной и интересной химической науки. Такие уравнения позволяют наглядно увидеть, какие ионы вступают в химические превращения. В виде ионов записывают вещества, которые подвергаются электролитической диссоциации. Разберем историю вопроса, алгоритм составления ионных уравнений и примеры задач.
ИСТОРИЯ ВОПРОСА
Еще древние алхимики, проводя нехитрые химические реакции в поисках философского камня и записывая в толстые фолианты результаты своих исследований, использовали определенные знаки для химических веществ. У каждого ученого была своя система, что неудивительно: каждый хотел защитить свои тайные знания от происков завистников и конкурентов. И лишь в VIII веке появляются единые обозначения для некоторых элементов.
В 1615 году Жан Бегун в своей книге «Начала химии», что по праву считается одним из первых учебников в этом разделе естествознания, предложил использовать условные обозначения для записи химических уравнений. И лишь в 1814 году шведский химик Йонс Якоб Берцелиус создал систему химических символов на основе одной или двух первых букв латинского названия элемента, подобную той, с которой ученики знакомятся на уроках.
В восьмом классе (параграф 12, учебник «Химия. 8 класс» под редакцией В.В. Еремина) ребята научились составлять молекулярные уравнения реакций, где и реагенты, и продукты реакций представлены в виде молекул.
Однако это упрощенный взгляд на химические превращения. И об этом задумывались ученые уже в XVIII веке.
Аррениус в результате своих экспериментов выяснил, что растворы некоторых веществ проводят электрический ток. И доказал, что вещества, обладающие электропроводностью, в растворах находятся в виде ионов: положительно заряженных катионов и отрицательно заряженных анионов. И именно эти заряженные частицы вступают в реакции.
ЧТО ТАКОЕ ИОННЫЕ УРАВНЕНИЯ
Ионные уравнения реакций — это химические равенства, в которых вещества, вступающие в реакцию, и продукты реакций обозначены в виде диссоциированных ионов. Уравнения данного типа подходят для записи химических реакций замещения и обмена в растворах.
Ионные уравнения — неотъемлемая часть сложной и интересной химической науки. Такие уравнения позволяют наглядно увидеть, какие ионы вступают в химические превращения. В виде ионов записывают вещества, которые подвергаются электролитической диссоциации (тема подробно разбирается в параграфе 10, учебник «Химия. 9 класс» под редакцией В.В. Еремина). В виде молекул записывают газы, вещества, выпадающие в осадок, и слабые электролиты, которые практически не диссоциируют. Газы обозначаются стрелкой вверх (↑), субстанции, выпадающие в осадок, стрелкой вниз (↓).
ОСОБЕННОСТИ ИОННЫХ УРАВНЕНИЙ
1. Реакции ионного обмена, в отличие от окислительно-восстановительных реакций, протекают без нарушения валентности веществ, вступающих в химические превращения.

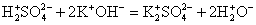
2. Реакции между ионами протекают при условии образования в ходе реакции плохорастворимого осадка, выделения летучего газа или образования слабых электролитов.
Удивительно, что реакции обмена могут проходить даже с нерастворимыми солями слабых кислот. В этом случае сильная кислота вытесняет слабую из ее солей. В качестве примера можно привести сокращенное ионное уравнение разведения карбоната кальция в сильных кислотах.
АЛГОРИТМ СОСТАВЛЕНИЯ ИОННОГО УРАВНЕНИЯ
Записываем молекулярное уравнение химического процесса.
Балансируем молекулярное уравнение с помощью коэффициентов.
Чтобы правильно сбалансировать равенство, нужно вспомнить закон сохранения массы веществ (параграф 12, «Химия. 8 класс» под редакцией В.В. Еремина), согласно которому в ходе химических превращений новые атомы не появляются, а старые не разрушаются. Т.е. число атомов в продуктах реакции равно числу атомов в исходных веществах. Помним, что водород и кислород уравниваем в последнюю очередь.
Определяем, какие вещества в химической реакции диссоциируют, т.е. распадаются на ионы.
Записываем в виде ионов:
- растворимые соли;
- сильные кислоты (H2SO4, HNO3, HCl и др.);
- растворимые в воде основания.
Записываем в виде молекул:
- нерастворимые соли;
- слабые кислоты, щелочи, вода;
- оксиды;
- газы;
- простые вещества;
- большинство органических соединений.
Если есть сомнения в растворимости реагента или продукта реакции, можно проверить по специальной таблице, которая является справочным материалом, ей можно пользоваться на различных экзаменах.
В таблице, помимо растворимости соединений, представлены также заряды катионов и анионов, участвующих в реакциях.
Определяем многоатомные ионы.
Это необходимо сделать, т.к. данные соединения не разлагаются на отдельные атомы и имеют свой заряд. Чаще всего в химических превращениях участвуют следующие многоатомные ионы:
Записываем равенство таким образом, чтобы все диссоциирующие субстанции были представлены в виде катионов и анионов.
Проверяем, чтобы уравнение было сбалансировано, т.е. количество различных атомов в частях с реагентами и продуктами реакции совпадало.
На данном этапе мы получили полное ионное уравнение.
Вычеркиваем идентичные ионы в обеих частях равенства, т.е. катионы и анионы с одинаковыми нижними индексами и зарядами, и переписываем равенство без данных ионов.
Проверяем, чтобы количество атомов элементов совпадало в правой и левой частях уравнения. Таким образом получаем краткое ионное уравнение.
ПРИМЕРЫ
Задача 1
Выясните, произойдет ли химическое взаимодействие между растворами гидроксида калия и хлорида аммония. (Записать для реакции молекулярное, полное ионное и сокращенное ионное уравнение.)
Записываем молекулярное уравнение, проверяем коэффициенты.
Помним, что гидроксид аммония — нестабильное соединение и разлагается на аммиак и воду.
Записываем окончательное уравнение:
NB! Благодаря летучести и резкому раздражающему запаху 3%-й раствор NH3 называется «нашатырный спирт» и используется в медицине.
Подсматривая в таблицу растворимости, помечаем полное ионное уравнение, не забывая о зарядах ионов.
Вычеркивая идентичные катионы и анионы в обеих частях реакции, составляем краткое ионное уравнение.
Делаем вывод: химическая реакция между гидроксидом калия и хлоридом аммония протекает с образованием воды и выделением аммиака — летучего газа с резким запахом.
Задача 2
А сейчас выполним задание из учебника «Химия. 9 класс» под редакцией В.В. Еремина.
Налейте в пробирку 1 мл раствора карбоната натрия и аккуратно прилейте к нему пару капелек соляной кислоты.
Составьте уравнение реакции, напишите полное и сокращенное ионные уравнения.
Записываем реакцию в молекулярном виде, расставляем коэффициенты, если это необходимо.
Подсматривая в таблицу растворимости, записываем полное ионное уравнение, не забывая отмечать заряды ионов.
Вычеркивая одинаковые катионы и анионы в правой и левой частях равенства, составляем краткое ионное уравнение.
Вопрос «Что происходит?» остался без ответа. К сожалению, в домашних условиях этот опыт осуществить трудновато, так как стиральной содой уже давно никто не пользуется, да и соляную кислоту в аптеке уже не продают. Но примерно такой же визуальный эффект можно наблюдать, если смешать раствор пищевой соды с раствором уксусной кислоты.
План-конспект урока химии в 8-м классе по теме «Ионные уравнения»
Разделы: Химия
Тип урока: изучение нового материала
Дидактическая цель: показать суть химических реакций, протекающих в растворах
Цели по содержанию:
- на основе усвоенных понятий о реакциях обмена и электролитической диссоциации веществ разных классов сформировать понятие «реакции ионного обмена», закрепить понятие «реакции нейтрализации»;
- экспериментально доказать, что реакции в растворах электролитов являются реакциями между ионами; выявить условия, при которых они идут практически до конца;
- дать первоначальные представления о качественных реакциях;
- научить школьников применять знания о диссоциации кислот, оснований, солей при написании ионных уравнений реакций;
- научить составлять эмпирические, полные и сокращённые ионные уравнения; по сокращённому ионному уравнению определять продукты реакции.
- совершенствовать учебные умения школьников при составлении химических уравнений, при выполнении лабораторных опытов;
- продолжить формирование химической речи учащихся, творческого мышления, правил научного общения, умения прогнозировать результат деятельности;
- воспитывать культуру интеллектуального труда; чувство ответственности, уверенности в себе, требовательности к себе; умение работать в парах
Основные понятия темы: реакции ионного обмена, ионные реакции, ионные уравнения, молекулярные (эмпирические) уравнения реакций, полные и сокращённые ионные уравнения реакций, реакции нейтрализации
Методы обучения: репродуктивный, частично-поисковый
Формы организации познавательной деятельности: фронтальная, парная
- Габриелян О.С. Химия. 8 класс: Учеб. для общеобразоват. учеб. заведений. – 3-е изд. – М.: Дрофа, 1999. – 208 с.: ил.
- Габриелян О.С. Настольная книга учителя. Химия. 8 класс/ О.С. Габриелян, Н.П. Воскобойникова, А.В. Яшукова. – 2-е изд., стереотип. – М.: Дрофа, 2003. – 416 с.
- Горковенко М.Ю. Химия. 8 класс: Поурочные разработки к учебникам О.С. Габриеляна; Л.С. Гузея, В.В. Сорокина, Р.П. Суровцевой; Г.Е. Рудзитиса, Ф.Г. Фельдмана. – М.: ВАКО, 2004. – 284 с.
- Савинкина Е.В. Сборник задач и упражнений по химии: 8-й кл. к учебнику О.С. Габриеляна «Химия. 8 класс»/ Е.В. Савинкина, Н.Д. Свердлова. – М.: Экзамен, 2006. – 191 с.
- Габриелян О.С. Химический эксперимент в школе. 8 класс: учебно-метод. пособие/ О.С. Габриелян, Н.Н. Рунов, В.И. Толкунов. – М.: Дрофа, 2005. – 304 с.
- Габриелян О.С. Химия. 8 кл.: тетрадь для лабораторных опытов и практических работ к учебнику О.С. Габриеляна «Химия. 8 класс»/ О.С. Габриелян, А.В. Яшукова. – М.: Дрофа, 2006. – 96 с.: ил.
- Ходаков Ю.В. и др. Неорганическая химия: Учеб. для 9 кл. сред. шк./ Ю.В. Ходаков, Д.А. Эпштейн, П.А. Глориозов. – 17-е изд. – М.: Просвещение, 1988. – 176 с., 2 л. ил.: ил.
- Занимательная химия на уроках в 8-11 классах: тематические кроссворды/ сост. О.В. Галичкина. – Волгоград: Учитель, 2007. – 119 с.
- Карты с лабораторными работами, «лабиринтом букв», задачами, домашним заданием.
- Растворы CaCl2, AgNO3, BaCl2 и Na2SO4, K2CO3 и H2SO4, NaOH и H2SO4, CuSO4 ,KNO3 и NaCl, пипетка, пробиркодержатель, чистые пробирки, фенолфталеин.
Ход урока
I. Организационное начало урока.
II. Мобилизующий этап. Актуализация знаний учащихся.
Ц И И С Р О А Н К А И О О Г М Е Р Е Б Н Н О Б К
- Определите ключевое понятие сегодняшнего урока, используя «лабиринт букв» («реакции ионного обмена»)
- Какие уже известные вам понятия включает это, пока ещё новое для вас, понятие? («реакции обмена», «ионы»)
- Что такое ионы? Какие вещества и при каких условиях образуют ионы? Как называется процесс распада вещества на ионы при растворении в воде? На какие ионы при растворении в воде диссоциируют кислоты, соли, основания? (схемы диссоциации кислот, оснований, солей, см. приложение 1)
- Какие реакции мы называем реакциями обмена? (общая схема, см. приложение 2)
- Найдите среди предложенных реакций реакции обмена:
- K2CO3 + H2SO4 ?
- Mg + HCl ?
- Na2SO4 + Ba(NO3)2?
- Zn(OH)2 ?
- NaOH + HCl ?
- SO3 + MgO ?
- Перечислите условия протекания реакций обмена до конца (схема, см. приложение 3)
- Какая из реакций протекает с образованием осадка, газа, воды?
III. Целеполагание и мотивация.
— Итак, опираясь на знания о реакциях обмена и условиях их протекания до конца, а также электролитической диссоциации кислот, солей, оснований при растворении в воде, на сегодняшнем уроке мы должны выяснить, какие реакции называются реакциями ионного обмена и научиться составлять ионные уравнения.
— Запишите тему урока
IV. Изучение нового материала. Первичное закрепление.
1) Вступительное слово
— Каждое химическое свойство, проявляемое сильными электролитами в растворах, — это свойство ионов, на которые электролит распался: либо катионов, либо анионов. Между тем, реакции обмена между электролитами в водных растворах мы раньше изображали молекулярными уравнениями, не учитывая, что в этих реакциях участвуют не молекулы электролита, а ионы, на которые он диссоциирован.
— Итак, реакции, осуществляемые в растворах между ионами, называются ионными, а уравнения таких реакций – ионными уравнениями
— Как такие реакции происходят в действительности, рассмотрим сначала на примере реакций, сопровождающихся выделением осадка.
2) Лабораторная работа № 1 «Реакции, идущие с образованием нерастворимых (малорастворимых) веществ»
Оборудование и реактивы: растворы CaCl2, AgNO3, BaCl2 и Na2SO4, пипетка, пробиркодержатель, чистые пробирки.
а) В пробирку с раствором CaCl2, закреплённую в пробиркодержателе, добавьте несколько капель AgNO3.
Что наблюдаете? Запишите молекулярное уравнение химической реакции
(см. приложение 4)
— При выполнении лабораторных опытов соблюдайте основные правила техники безопасности
(см. приложение 5)
— Сливая растворы CaCl2 и AgNO3, мы наблюдаем образование осадка AgCl, в растворе остаётся Ca(NO3)2
2AgNO3 + CaCl2 = Ca(NO3)2 + 2AgCl ?
Полекулярное (эмпирическое) уравнение
— Обе исходные соли – сильные электролиты, полностью диссоциирующие в воде
 |  |  |  |  |  |  |
|---|---|---|---|---|---|---|
| 2Ag+ | 2NO3— | Ca2+ | 2Cl- | Ca2+ | 2NO3— | 2AgCl ? |
— Одна из полученных солей также остаётся в растворе диссоциированной на ионы Ca2+ и NO3-, а вот AgCl – нерастворимое соединение, не диссоциирующее в воде, поэтому его переписываем в молекулярном виде.
— Итак, уравнение реакции между CaCl2 и AgNO3 можно записать так:
2Ag+ + 2NO3 — + Ca2 + + 2Cl- = Ca2 + + 2NO3 — + 2AgCl ?
Полное ионное уравнение
— Что же произошло при сливании растворов? Ионы Ag + и Cl- соединились и образовали AgCl, выпавший в осадок.
— Ионы же Ca2 + и NO3 — в реакции не участвовали, они остались такими, какими были и до сливания растворов, следовательно, мы можем исключить их обозначение из левой и правой частей полного ионного уравнения. Что осталось?
2Ag + + 2Cl — = 2AgCl ?
— Или, сокращая коэффициенты,
Ag + + Cl — = AgCl ?
Сокращённое ионное уравнение
— Это уравнение показывает, что суть данной реакции сводится к взаимодействию Ag + и Cl — , в результате которого образуется осадок AgCl. При этом совершенно не важно, в состав каких электролитов входили эти ионы до реакции: аналогичное взаимодействие можно наблюдать и между NaCl и AgNO3, AgNO3 и AlCl3 и так далее – суть всех этих реакций будет сводиться к взаимодействию Ag + и Cl — c образованием AgCl?
б) Рассмотрите реакцию ионного обмена между BaCl2 и Na2SO4
(см. приложение 4)
— Предложите, пользуясь таблицей растворимости, формулы электролитов, реакции между которыми сводятся к взаимодействию Ba2 + + SO4 — = BaSO4?
в) растворы каких веществ нужно взять, чтобы в растворе осуществилась реакция между Ca2 + + CO3 — = CaCO3?
(см. приложение 4)
— Составьте молекулярные уравнения предложенных реакций, запишите сокращённое ионное уравнение, отражающее их суть.
— Образование при реакции нерастворимого или малорастворимого соединения используют для обнаружения в растворе того или иного иона: так растворимые соли серебра используют для обнаружения Cl — , Br — , I — … — ионов, так как с этими анионами Ag + образует нерастворимые осадки, и, наоборот, растворимые соли, содержащие Cl — , Br — , I — … — ионы, используют для распознавания Ag + в растворе.
— Такие реакции принято называть качественными, т.е. реакциями, с помощью которых можно обнаружить тот или иной ион.
(таблица «Качественные реакции на ионы», см. приложение 6)
3) Лабораторный опыт № 2 «Реакции с образованием газообразных веществ»
Оборудование и реактивы: растворы K2CO3 и H2SO4, пипетка, пробиркодержатель, чистые пробирки.
а) Видеоопыт «Реакции ионного обмена, протекающие с выделением газа»
Посмотрите видеоопыт, составьте и запишите молекулярное, полное и сокращённое ионное уравнения реакции.
Можно ли считать данную реакцию качественной? Почему?
б) Проведите аналогичную реакцию между K2CO3 и H2SO4, составьте и запишите молекулярное и сокращённое ионное уравнения реакции.
в) Предложите вещества, растворы которых можно взять для осуществления реакции между 2H + + SO32 — = H2O + SO2?
(см. приложение 4)
4) Лабораторный опыт № 3 «Реакции, идущие с образованием слабого электролита»
Оборудование и реактивы: растворы NaOH и H2SO4, CuSO4, пипетка, пробиркодержатель, чистые пробирки, фенолфталеин
а) В пробирку прилейте 1-2 мл раствора NaOH, добавьте 2-3 капли фенолфталеина. Прилейте H2SO4 до полного обесцвечивания раствора.
Почему раствор обесцветился? Как называются реакции между кислотами и основаниями, в результате которых образуется соль и вода?
б) Посмотрите видеоопыт «Реакция нейтрализации», составьте молекулярное и сокращённое ионное уравнение для продемонстрированной вам реакции
— Реакция нейтрализации может протекать не только между кислотами и щелочами, но и между кислотами и нерастворимыми основаниями. Для доказательства проведём следующий опыт.
в) Получите свежеосаждённый Cu(OH)2, используя выданные вам реактивы. Какие? Разделите полученный осадок на 3 равные пробирки, в каждую добавьте по 1-2 мл разных кислот. Что наблюдаете?
Составьте и запишите молекулярное, полное и сокращённое ионное уравнение одной из проведённых реакций. В чём её суть? Можно утверждать, что сокращённая запись отражает суть всех трёх реакций, независимо от того, какая кислота вступала в реакцию?
5) Лабораторный опыт № 4 «Обратимое взаимодействие между ионами»
Оборудование и реактивы: растворы KNO3 и NaCl, пипетка, пробиркодержатель, чистые пробирки, фенолфталеин
В пробирку с KNO3 добавьте 2-3 капли фенолфталеина, прилейте 1-2 мл раствора NaCl. Что наблюдаете? Составьте молекулярное и полное ионное уравнения реакции.
Какие ионы находились в растворе? Какие ионы находятся в полученном растворе? О чём свидетельствует отсутствие видимых эффектов реакции?
Как называются такие реакции?
V. Обобщение
— Итак, мы рассмотрели реакции, протекающие в растворах электролитов с образованием осадка, газа или малодиссоциирующего вещества: растворы электролитов содержат ионы, следовательно, реакции в растворах электролитов сводятся к реакциям между ионами. Сформулируйте определение понятия «реакции ионного обмена» (реакции между ионами в растворах электролитов, протекающие с выделением осадка, газа или воды)
VI. Значение реакций ионного обмена
— Реакции ионного обмена широко распространены в живой и неживой природе, например, образование осадочных пород (гипс, известняк, другие соли), появление камней в почках животных и человека.
Широко используются реакции ионного обмена и в практических целях, например, для осаждения ионов, приносящих существенный вред людям и животным. К таким относят, в первую очередь, катионы тяжёлых металлов.
Тяжелые металлы — это элементы периодической системы с относительной молекулярной массой больше 40. Так сложилось, что термины «тяжелые металлы» и «токсичные металлы» стали синонимами.
На сегодняшний день безоговорочно к числу токсичных относят кадмий, ртуть, свинец, сурьму. Деятельность значительной части остальных в живых организмах можно оценить только на «отлично». Действительно, металлы в ионной форме входят в состав витаминов, гормонов, регулируют активность ферментов.
Установлено, что для белкового, углеводного и жирового обмена веществ необходимы Mo, Fe, V, Co, W, B, Mn, Zn; в синтезе белков участвуют Mg, Fe, Cu, Zn, Mn, Co; в кроветворении — Co, Cu, Mn, Ni, Zn; в дыхании — Mg, Fe, Cu, Zn, Mn, Co. Справедливо утверждение о том, что нет вредных веществ, есть вредные концентрации. Поэтому ионы меди, кобальта или даже хрома, если их содержание в живом организме не превышает естественного, можно именовать микроэлементами, если же они генеалогически связаны с заводской трубой, то это уже тяжелые металлы. Тяжелые металлы (ртуть, свинец, кадмий, цинк, медь, мышьяк,) относятся к числу распространенных и весьма токсичных загрязняющих веществ. Они широко применяются в различных промышленных производствах, поэтому, несмотря на очистные мероприятия, содержание соединения тяжелых металлов в промышленных сточных водах довольно высокое. Большие массы этих соединений поступают в океан через атмосферу. Для морских биоценозов наиболее опасны ртуть, свинец и кадмий. Ртуть переносится в океан с материковым стоком и через атмосферу.
— Предложите решение следующей задачи:
Задача 1.
В сточных водах гальванического цеха химического завода обнаружены катионы Fe3 + , Fe2 + , Ni 2+ и анионы Cl — , SO4 2- . Как с помощью реакций ионного обмена можно очистить эти стоки?
— Поработайте в парах над решением подобных задач:
Задача 2.
Предложите ионные реакции для очистки сточных вод автотранспортного предприятия от катионов Pb 2+ и Cu 2+ , оказывающих токсическое действие на живые организмы.
Задача 3.
В сточных водах животноводческих ферм отмечено повышенное содержание катионов Ca 2+ и Zn 2+ . Предложите реактивы, с помощью которых можно очистить воду от этих ионов.
VII. Домашнее задание
С какими веществами может реагировать фосфорная кислота, образуя а) газ; б) воду; в) осадок?
Запишите уравнения реакций в молекулярном, полном и сокращённом ионном видах.
http://rosuchebnik.ru/material/ionnye-uravneniya/
http://urok.1sept.ru/articles/572852