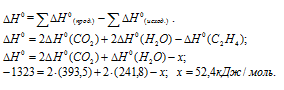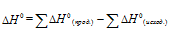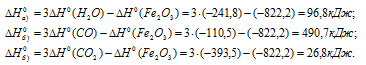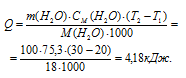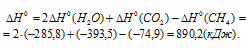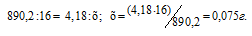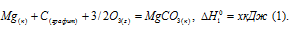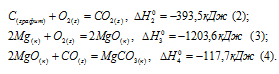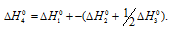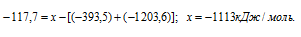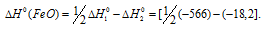Закономерности протекания химических реакций. Теплоты образования веществ
Задача 293.
Определить 
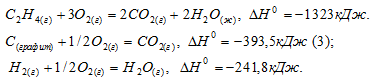
Решение:
Обозначим искомую величину [ 

Ответ: 52,4 кДж/моль.
Задача 294.
Сравнить 
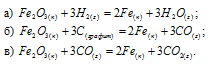
Решение:
По табличным данным стандартные энтальпии образования Fe2O3(к), Н2O(г) и СО(г) соответственно равны -822,2, -241,8, -110,5 и -393,5 кДж/моль (стандартные энтальпии образования простых веществ принято считать равными нулю). Для расчета 
Ответ: а) 96,8 кДж; б) 490,7 кДж; в) 26,8 кДж.
Задача 295.
Найти массу метана, при полном сгорании которой (с образованием жидкой воды) выделяется теплота, достаточная для нагревания 100 г воды от 20 до 30°С. Мольную теплоемкость воды принять равной 75,3Дж/(моль . К).
Решение:
Мольная теплоёмкость (CM) – это количество теплоты, необходимое для нагревания одного киломоля вещества на один градус. Находим количество теплоты необходимое для нагревания 100 г воды от 20 0 С до 30 0 С по формуле:
Табличные данные стандартных энтальпий образования СН4(г), Н2О(ж) и СО2(г) соответственно равны -74,9, -285,8 и -393,5кДж/моль. Стандартные энтальпии простых веществ принято считать равными нулю.
Уравнение реакции горения метана имеет вид:
Стандартную энтальпию реакции рассчитаем, используя уравнение из следствия закона Гесса:
Теперь, учитывая, что при сгорании 1 моля метана выделяется 890,2 кДж теплоты, рассчитаем его массу, которая необходима для выделения 4,18 кДж теплоты из пропорции:
Ответ: 0,075г.
Задача 296.
Вычислить 
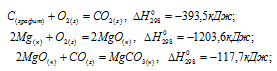
Решение:
Обозначим искомую величину через x, запишем термохимическое уравнение образования MgCO3 из простых веществ:
Затем запишем уравнения реакций образования CO2, MgO и MgCO3 из CO2 и MgO:
Из уравнений (1), (2) и (3) можно получить уравнение (4). Для этого нужно из уравнения (1) вычесть сумму уравнения (2) и ½ уравнения (3), получим:
Подставляя значения энтальпий образования веществ, находим искомую величину:
Ответ: -1113 кДж/моль.
Задача 297.
Исходя из 
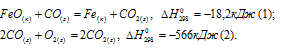
вычислить 
FeO(к) + Н2(г) = Fe(к) + Н2О(г) (3)
Решение:
Так как оксид железа (II) при взаимодействии с оксидом углерода (II) образует железо и оксид углерода (IV), то значение 
Тогда 
Равновесие в реакции, уравнение которой
СН4(г) + 4S(ж) ↔ СS2(г) + 2Н2S(г), ΔH 0 298 = 14 кДж/моль
1) в обратном 2) в прямом
3) состояние химического равновесия 4) реакция не протекает
49) Согласно уравнению гомогенной химической реакции С2Н2 + Н2« С2Н4; DН 0 0 =-52,3 кДж, стандартная энтальпия образования этилена равна____кДж/моль
52) Повышение давления смещает равновесие в сторону продуктов для реакции…
53) Для увеличения выхода продуктов реакции FeO(т) + H2(г)↔Fe(т) + H2O(г), ∆Н>0 необходимо…
1) понизить давление
2) понизить температуру
3) повысить давление
4) повысить температуру
54) Согласно первому началу термодинамики, справедливо выражение…
4) ∆U=Q-A
55) Для нахождения ∆Н 0 298 реакции 4HCN(г) + 5О2(г) = 2Н2О(ж) + 4СО2(г) + 2N2(г) ,
следует воспользоваться формулой…
1) ∆Н 0 298 = 2∆Н 0 298, Н2О (ж) + 4∆Н 0 298, СО2 (г) — 4∆Н 0 298, НСN (г)
2) ∆Н 0 298 = ∆Н 0 298, Н2О (ж) + ∆Н 0 298, СО2 (г) — ∆Н 0 298, НСN (г)
3) ∆Н 0 298 = 4∆Н 0 298, НСN (г) + 2∆Н 0 298, Н2О (ж) — 4∆Н 0 298, СО2 (г)
4) ∆Н 0 298 = ∆Н 0 298, НСN (г) + ∆Н 0 298, Н2О (ж) — ∆Н 0 298, СО2 (г)
56) Неверно, что согласно 2 началу термодинамики…
1) теплота самопроизвольно переходит от более нагретого тела к менее нагретому
2) тепловой эффект обратной реакции больше теплового эффекта прямойреакции
3) КПД тепловой машины всегда меньше единицы (100%)
4) в изолированной системе самопроизвольно идут процессы, сопровождающиеся увеличением энтропии
57) Если прямая экзотермическая реакция протекает с уменьшением количества газообразных веществ, то согласно принципу Ле-Шателье , чтобы сместить равновесие в сторону продуктов, следует…
Повысить давление
2) понизить давление
3) повысить температуру
4) добавить катализатор
58) Наибольшему значению энтропии соответствует состояние воды…
Количественное соотношение между изменением внутренней энергии, теплотой и работой устанавливает______ закон термодинамики
1) третий 2) первый 3) второй 4) нулевой
60) Реакция CaCO3= CaO + CO2, для которой ∆Н=178кДж, ∆S=160Дж/моль×К, при стандартных условиях:
1) протекает в прямом направлении
2) протекает в обратном направлении
3) находится в равновесии
4) находится в колебательном режиме
Для экзотермического процесса синтеза аммиака одновременное понижение температуры и увеличение давления_________выход аммиака
2) сначала увеличивает, а затем уменьшает
62) Уравнение реакции, проходящей с увеличением энтропии, имеет вид…
63) Выберите соединения с макроэргическими связями:
2) Окислительно-восстановительные реакции. Электролиз.
1) Перманганат ион MnO4 — в кислой среде восстанавливается до …
2) Оксид марганца (IV) MnO2 может проявлять в окислительно-восстановительных реакциях свойстваи окислителя, и восстановителя
1) только окислителя
2) ни окислителя, ни восстановителя
3) только восстановителя
3) При электролизе водного раствора KCl на катоде выделяется …
4) В качестве восстановителей в промышленных условиях используют…
5) Согласно уравнению Нернста потенциал электрода…
Химическая термодинамика. Термохимия. Решение задач (стр. 5 )
 | Из за большого объема этот материал размещен на нескольких страницах: 1 2 3 4 5 6 |
Поскольку в таблице 5 указаны стандартные значения термодинамических величин, то для первого условия величину ΔG(реакции) можно подсчитать по следующей формуле:
Проведите самостоятельно расчеты и получите результат: ΔG(реакции) = 129,1 кДж/моль. Положительный знак полученной величины показывает, как мы уже знаем, что при указанных условиях самопроизвольное протекание процесса невозможно.
Рассмотрим теперь случай, когда температура равна 1500оС.
Данные условия не являются стандартными, поэтому рассчитывать значение ΔG(реакции) необходимо в соответствии с формулой (14). Отдельно рассчитайте ΔН(реакции) и ΔS(реакции), используя следствие из закона Гесса,:
ΔН(реакции) = – 635,5 – 393,5 + 1207,0 = +178 кДж/моль;
ΔS(реакции) = 39,7 + 213,7 – 88,7 = +164,7 Дж/(моль•К).
Теперь можно посчитать значение искомой величины, не забыв перевести значение температуры в градусы Кельвина по формуле Т К = tºС + 273º; джоули в килоджоули: ΔG(реакции) = +178 – 1773 • 0,165 = –114,0 кДж/моль.
Полученное значение ΔG = –114,0 кДж /моль позволяет сделать вывод о возможности самопроизвольного протекания реакции при температуре 1500оС.
Можно сделать также вывод, что существует такое значение температуры, начиная с которой реакция может протекать самопроизвольно. Определим ее из условия, что ΔG (реакции) = 0, и уравнения (14), подставив значения термодинамических величин и решая уравнение относительно значения температуры:
Получаем результат: Т = 178 /0,165 =1081 К. Самостоятельно переведите это значение в шкалу Цельсия. После достижения этой температуры процесс разложения карбоната кальция может протекать самопроизвольно.
Таким образом, термодинамика позволяет предсказать принципиальную возможность протекания химических процессов в тех или иных условиях, однако, она ничего не говорит нам о том, насколько быстро будет происходить такое превращение. Термодинамическая возможность осуществления той или иной реакции является необходимым, но недостаточным условием реализации процесса, так как протекание химических реакций всегда связано с преодолением различных энергетических барьеров. Механизмы протекания реакций и закономерности развития их во времени изучаются в другом разделе химии, который называется химической кинетикой.
Разберем еще несколько примеров решения задач.
Задача 1. При сгорании 16 г магния выделилось 400,8 кДж. Определите энтальпию образования MgO(к.).
Решение. Запишем термохимическое уравнение реакции:
Mg(к.) + 1/2 O2(г.) = MgO(к.), DНреак.= х кДж.
Из условия задачи следует, что при сгорании некоторого числа молей магния выделилось 400,8 кДж, поэтому, сначала находим количество вещества прореагировавшего магния: ν = m/М = 16/24 = 0,66(6) моль.
Если при сгорании 0,66(6) моль магния выделяется 400,8 кДж, то при сгорании 1 моль магния выделяется х кДж (это и есть теплота образования MgO(к.)):
х = 1·(–400,8)/0,66(6) = – 601,2 кДж Ответ: DНобр(MgO) = – 601,2 кДж/моль.
Задача 2. Определите энтальпию реакции B2O3(к.) + 3 Mg(к.) = 2 B(к.) + 3 MgO(к.),
если энтальпии образования B2O3(к.) и MgO(к.) равны соответственно –1272,8 и –601,2 кДж/моль.
Решение: Воспользуемся следствием из закона Гесса, которое гласит: тепловой эффект химической реакции равен сумме стандартных теплот образования продуктов реакции за вычетом суммы стандартных теплот образования исходных веществ:
DНх = 3·DНобр(MgO) – DНобр (B2O3) = –1803,6 – (– 1272,8) = –530,8 кДж/моль.
Напомним, что стандартные теплоты образования простых веществ равны нулю.
Ответ: – 530,8 кДж/моль
Задача 3. Определить стандартную энтальпию сгорания метана, если станд. энтальпии образования CH4(г.), CO2(г.) и H2O(ж.) равны: –74,8; –393,5 и –285,8 кДж/моль.
Решение: Запишем термохимическое уравнение реакции:
CH4(г.) + 2 02(г.) = CO2(г.) + 2 H2O(ж.); DHºреакц. = ?
Используя первое следствие из закона Гесса, находим, что
DHºреакц. = 2 DHобр (H2O) + DHобр (CO2) – DHобр (СН4);
DHºреакц = [2 (–285,8) + (–393,5)] – (–74,8) = –890,3 кДж/моль
Ответ: – 890,3 кДж/моль
Задача 4. Пользуясь данными справочника, определите, может ли при стандартной температуре самопроизвольно протекать реакция
Fe2O3(к.) + H2(г.) = 2 FeO(к.) + H2O(г.)?
Решение: По справочным данным находим, что DGобрFe2O3(к.) = –740,3 кДж/моль;
DGобрFeO(к.) = –244,3 кДж/моль; DGобрH2O(г.) = –228,6 кДж/моль. Тогда,
DGреакц = 2×DGобр (FeO(к.)) + DGобр.(H2O(г.)) – DGобр(Fe2O3(к.)) =
[2 (–244,3) + (–228,6)] – (–740,35) = –23,17 кДж
Ответ: так как DGреакц 0
Задача 7. Вычислить изменение стандартной энтропии для реакций
а) H2(г.) + Br2(г.) = 2 HBr(г.); б) H2(г.) + Br2(ж.) = 2 HBr(г.);
в) CO(г.) + 1/2O2(г.) = CO2(г.); г) C(графит) + O2(г.) = CO2(г.).
Объяснить значительное различие в изменении энтропии для реакций а) и б); в) и г)?
Ответ: +21,3; 114,7; –86,3; +3,0
Задача 8. Не проводя расчета, определите качественно, в каких химических реакциях ΔS реакции будет 0.
а) 2H2(г.) + O2(г.) = H2O(г.); б) 2H2(г.) + O2(г.) = H2O(ж.);
г) N2 (г.) + 3H2(г.) = 2NH3(г.); д) CaO(к.) + CO2(г.) = CaCO3(к.);
е) 4 Fe(к.) + 3 O2(г.) = 2 Fe2O3(к.); ж) N2O4(г.) = 2 NO2(г.);
з) N2 (г.) + O2(г.) = 2 NO(г.).
Задача 9. При соединении 2,1 г железа с серой выделилось 3,77 кДж. Рассчитать теплоту образования сульфида железа.
Ответ: DНобр(FeS) = — 100,3 кДж. /моль.
Задача 10. Определить стандартную энтальпию (DН°298) образования РН3 , исходя из уравнения:
2РН3 (г.) + 4О2 (г.) = Р2 О5 (к.) + 3Н2О (ж.); DН° = — 2360 кДж.
Ответ: 5,3 кДж./моль.
Задача 11. Исходя из теплового эффекта реакции
3СаО (к.) + Р2О5 (к.) = Са3(РО4)2(к.); DН° = — 739 кДж,
определить DН°298 образования ортофосфата кальция.
Ответ: – 4137,5 кДж./моль.
Задача 12. Исходя из уравнения реакции
CH3OH (ж.) + 3/2 O2 (г.) = CO2 (г.) + H2O(ж.); DН° = –726,5 кДж,
вычислить DН°298 образования метилового спирта.
Ответ: –238,6 кДж./моль.
Задача 13. При восстановлении 12,7 г оксида меди (II) углем (с образованием CO) поглощается 8,24 кДж. Определить DН°298 образования оксида меди.
Ответ: –162,1 кДж/моль.
Задача 14. Определите DН°298 образования этилена, используя следующие данные:
C2H4(г.) + 3 O2(г.) = 2 CO2 (г.) + 2 H2O (г.), DН° = –1323 кДж;
C(графит) + O2(г.) = CO2 (г.), DН° = –393,5 кДж;
H2 (г.) + 1/2 O2 (г.) = H2O (г.), DН° = –241,8 кДж.
Ответ: 52,4 кДж/моль.
Задача 15. Не производя вычислений, установите знак DS следующих процессов:
а) 2NH3 (г.) = N2 (г.) +3H2 (г.); б) CO2 (к.) = CO2 (г.);
в) 2NO (г.) + O2 (г.) = 2NO2 (г.); г) 2H2S (г.) + 3O2 (г.) = 2H2O(ж.) + 2SO2 (г.);
д) 2CH3 OH (г.) + 3O2 (г.) = 4H2O (г.) + 2CO 2 (г.).
Задача 16. Определите знак изменения энтропии для реакции:
2 А2(г.) + В2(г.) = 2А2В(ж.).
Возможно ли протекание этой реакции в стандартных условиях? Ответ обосновать.
Задача 17. Укажите знаки DН°, DSº и ΔG° для следующих процессов:
а) расширение идеального газа в вакуум;
б) испарение воды при 100ºС и парциальном давлении паров воды 101,3 кПа (760 мм рт. ст.); в) кристаллизация переохлажденной воды.
Задача 18. Вычислите значения ΔG°298 реакций восстановления оксида железа (II):
а) FeO(к.) + ½ C(графит) = Fe(к.) + ½ CO2 (г.);
б) FeO(к.) + C(графит) = Fe(к.) + CO(г.); в) FeO(к.) + CO(г.) = Fe(к.) + CO2 (г.).
Протекание какой из этих реакций наиболее вероятно?
Ответ: а) 47,1 кДж; б) 107,2 кДж; в) –13,0 кДж.
Задача 19. Какие из перечисленных оксидов могут быть восстановлены алюминием при 298 К: CaO, FeO, CuO, PbO, Fe2O3, Cr2O3?
http://lektsii.org/3-132754.html
http://pandia.ru/text/80/326/61839-5.php