Пожалуйста, кому не сложно, помогите с химией, кто чем может. Буду просто несказанно благодарен вам за помощь!
1) Написать полные электронные формулы атомов элементов под порядковым номером 86.
2)По распределению валентных электронов определить, какой это элемент, указать его символ и написать полную электронную формулу: (4s^2)(4p^5) .
3) Написать полную электронную формулу иона La с зарядом 3+.
4) Написать уравнения диссоциации и константы для слабого электролита: HI .
5) Написать в молекулярной и ионной формах уравнения возможных реакций взаимодействия соединения с NaOH и H2SO4. Дано: H2SO3.
6) По заданному ионному уравнению написать соответствующее молекулярное уравнение:
2H+Si(заряд 2-)=H2SiO3
7) Написать в молекулярной и ионной формах уравнения реакций для следующего превращения: Al(OH)3 -> AIOHCl2 -> AlCl3 -> Al(NO3)3
8) Написать уравнения гидролиза солей в молекулярной и ионной формах, указать pH растворов (pH>7 или pH AsO4(заряд 3-), I(заряд -)
Mn(NO3)2+NaBiO3+HNO3->Bi(заряд 3+), MnO4(заряд -)
11) Укажите направление движения электронов в гальваническом элементе, используя значения электродных потенциалов. Написать уравнения анодного и катодного процессов, суммарное ионное и молекулярное уравнения реакции. Рассчитать ЭДС; если концентрация раствора не указана, использовать значения стандартного потенциала.
Cu / CuSO4 // V2(SO4)3, 0,05 M / V
12) Дописать уравнения реакций, составив к ней электронно-ионную схему.
Cu+NaOH+H2O+O2
13) Рассмотреть коррозию гальванопары, использую потенциалы указать катод и анод соответствующей гальванопары, рассчитать ЭДС, написать уравнения катодного и анодного процессов, молекулярное уравнение реакции коррозии, указать направление перемещения электронов в системе.
Коррозионная среда: NaOH+H2O. Дано: Al/Cu .
14) Рассмотреть катодные и анодные процессы при электролизе водных растворов вещества с инертными электродами. Рассчитайте массу или объём (при нормальных условиях газов) продуктов, выделяющихся на электродах при пропускании через раствор в течении 1 часа тока силой 1А. Вещество: KMnO4
Примеры решения и оформления заданий к разделу 8
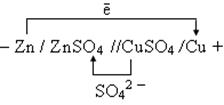
Пример 1.Медно — цинковый гальванический элемент
Условия стандартные, т.е. 
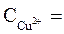
2. Электродные потенциалы
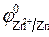
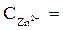
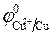
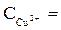
3. Направление движения электронов по внешний цепи — от цинкового электрода в медному, так как потенциал цинкового электрода меньше.
Расчет величины ЭДС.
ЭДС = φ 0 Ox — φ 0 Red = 0,34 — (— 0,76) = 1,1 В.
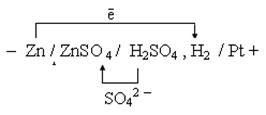
Пример 2 Гальванический элемент с водородным электродом.
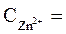
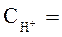
2. Электродные потенциалы
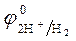
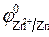
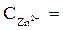
3. Направление движения электронов по внешней цепи — от цинкового электрода к водородному, так как потенциал цинкового электрода меньше.
4. Уравнения электродных процессов.
Zn (—): Zn — 2ē = Zn 2+ — процесс окисления
Pt (+): 2Н + + 2ē = Н 2 — процесс восстановления.
5. Суммарное уравнение:
Zn + 2Н + = Zn 2+ + Н 2
6. Расчет величины ЭДС.
ЭДС = φ 0 Ox — φ 0 Red = 0 — (— 0,76) = 0,76 В.
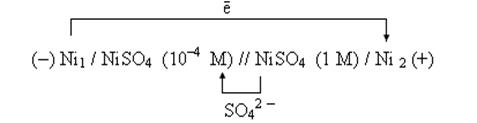
Пример 3. Концентрационный гальванический элемент.
Оба электрода из одного металла, но растворы солей, в которые погружены электроды, разной концентрации.
1. Схема гальванического элемента.
Ni / NiSO 4( 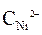
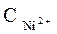
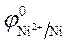
2. Вычисление электродных потенциалов по уравнению Нернста.
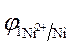
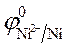
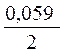
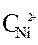
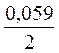

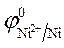
3.Направление движения электронов по внешней цепи от Ni1 электрода к Ni2, так как 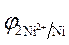
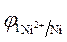
4. Уравнения электродных полуреакций.
Ni1 (—): Ni — 2ē = Ni 2+ — процесс окисления;
Ni2 (+): Ni 2+ + 2ē = Ni —процесс восстановления.
Токообразующая реакция не имеет смысла.
5. Расчет величины ЭДС.
ЭДС = 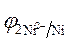
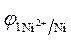
Пример 4. Гальванический элемент на основе окислительно-восстановительной реакции с инертным (С) электродом:
1. Сокращенная схема гальванического элемента
— Zn / Zn 2+ (1 M) // Cr2O7 2 — , Сr 3+ , H + (1 M) / C +
2. Используем значения стандартных электродных потенциалов, так как концентрации ионов в растворе равны 1моль/л.
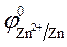
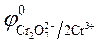
3. Направление движения электронов —от цинкового электрода к
угольному, так как 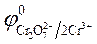
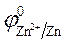
 |
4. Уравнения электродных процессов.
Zn (—): Zn — 2ē = Zn 2+ — процесс окисления
С (+): Cr2O 7 2 — + 6ē + 14Н + = 2Cr 3+ + 7Н2О — процесс восстановления.
5. Суммарные уравнения.
3Zn + Cr2O7 2 — + 14Н + = 3Zn 2+ + 2Cr 3+ + 7Н2О
6. Расчет величины ЭДС.
ЭДС = Е 0 Ox — Е 0 Red = 1,36— (— 0,76) = 2,12 В.
Тема №9: «Взаимодействие металлов с кислотами, водой и
растворами щелочей»
Задание 2. Используя потенциалы (см. таблицу на стр. 43), допишите уравнения реакций (по две для каждого варианта) и составьте к ним электронно-ионные схемы. Для реакций металлов с H2SO4 концентрированной и HNO3 значение потенциала окислителя примите равным более 1 В. Оцените практическую устойчивость металлов в данной среде.
Используя потенциалы (табл. П.6, П.7, П.8), допишите уравнения реакций а) Pb + KOH+ H2O + O2 б) Cu + H2SO4 (конц.) составив к ним электронно-ионные схемы.
| 🎓 Заказ №: 22194 |
| ⟾ Тип работы: Задача |
| 📕 Предмет: Химия |
| ✅ Статус: Выполнен (Проверен преподавателем) |
| 🔥 Цена: 153 руб. |
👉 Как получить работу? Ответ: Напишите мне в whatsapp и я вышлю вам форму оплаты, после оплаты вышлю решение.
➕ Как снизить цену? Ответ: Соберите как можно больше задач, чем больше тем дешевле, например от 10 задач цена снижается до 50 руб.
➕ Вы можете помочь с разными работами? Ответ: Да! Если вы не нашли готовую работу, я смогу вам помочь в срок 1-3 дня, присылайте работы в whatsapp и я их изучу и помогу вам.
⚡ Условие + 37% решения:
Используя потенциалы (табл. П.6, П.7, П.8), допишите уравнения реакций а) Pb + KOH+ H2O + O2 б) Cu + H2SO4 (конц.) составив к ним электронно-ионные схемы. Для реакций металлов с H2SO4 (конц.) и HNO3 значение потенциала окислителя более 1 В. Оцените практическую устойчивость металлов в данной среде.
Решение. а) Pb + KOH + H2O + O2 → Red Ox 2 Pb – 2ē + 4 ОН– = 2- PbO2 + 2 H2O 1 О2 + 4ē + 2 Н2О = 4 ОН– 2 Pb + 8 ОН– + О2 + 2 Н2О = 2 2- PbO2 + 4 H2O + 4 ОН– 2 Pb + 4 ОН– + О2 = 2 2- PbO2 + 2 H2O 2 Pb + 4 KОН + О2 = 2 K2PbO2 + 2 H2O
Научись сам решать задачи изучив химию на этой странице:
|
Услуги:
|
Готовые задачи по химии которые сегодня купили:




















































Образовательный сайт для студентов и школьников
Копирование материалов сайта возможно только с указанием активной ссылки «www.lfirmal.com» в качестве источника.
© Фирмаль Людмила Анатольевна — официальный сайт преподавателя математического факультета Дальневосточного государственного физико-технического института
http://lektsii.org/7-23708.html
http://lfirmal.com/%D0%98%D1%81%D0%BF%D0%BE%D0%BB%D1%8C%D0%B7%D1%83%D1%8F-%D0%BF%D0%BE%D1%82%D0%B5%D0%BD%D1%86%D0%B8%D0%B0%D0%BB%D1%8B-%D1%82%D0%B0%D0%B1%D0%BB-%D0%9F-6-%D0%9F-7-%D0%9F-8-%D0%B4%D0%BE%D0%BF%D0%B8-2/