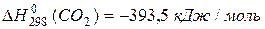Для получения 98 л (н.у.) оксида азота(II) согласно уравнению реакции N2+O2=2NO-180 потребуется затратить
Ваш ответ
решение вопроса
Похожие вопросы
- Все категории
- экономические 43,299
- гуманитарные 33,622
- юридические 17,900
- школьный раздел 607,247
- разное 16,834
Популярное на сайте:
Как быстро выучить стихотворение наизусть? Запоминание стихов является стандартным заданием во многих школах.
Как научится читать по диагонали? Скорость чтения зависит от скорости восприятия каждого отдельного слова в тексте.
Как быстро и эффективно исправить почерк? Люди часто предполагают, что каллиграфия и почерк являются синонимами, но это не так.
Как научится говорить грамотно и правильно? Общение на хорошем, уверенном и естественном русском языке является достижимой целью.
Алгоритм 4 — Расчёты по термохимическим уравнениям (ТХУ)
Задача 4.
По термохимическому уравнению: N 2(г) + O 2(г) = 2NO (г) – 180,7кДж, вычислите объём вступившего в реакцию азота при н.у., если при его окислении поглотилось 45,2 кДж теплоты.
Алгоритм решения
1. Над формулами веществ надпишем сведения, взятые из условия задачи , а под формулой – соотношение, отображаемое уравнением реакции
Решение типовых задач
Учитывая термохимическое уравнение реакции
найдите величину теплового эффекта при окислении 5,6 г азота.
Величина теплового эффекта пропорциональна количеству вещества или массе. Из уравнения реакции видно, что при окислении 1 моль азота, т.е. 28 г азота, поглощается 180,7 кДж теплоты. Находим значение теплового эффекта для 5,6 г азота с помощью пропорции:
При окислении 28 г N2 тепловой эффект равен 180,7 кДж
При окислении 5,6 г N2 тепловой эффект равен Х кДж.
Х = 5,6×180,7/28 = 36,14 кДж.
Вычислите 

DG o (O2) и DG o (N2) равны нулю, так как это простые вещества.
По таблицам термодинамических констант определяем, что
DG o (NH3) = 16,64 кДж/моль, DG o (H2Oж) = -237,5 кДж/моль.
Подставляем эти значения в формулу:


При какой температуре наступит равновесие системы:
Равновесие системы наступит при Т = DН /DS.
Определяем изменения энтальпии и энтропии с помощью следствия из закона Гесса по формулам:
DS о = 2S(СO) – S(CO2) – S(графит)
Числовые значения стандартных энтальпий и энтропий приводятся в таблицах термодинамических констант:
Подставляя эти значения в формулы, получаем:
DН о = 2×(-110,5) – (-393,5) = – 172,5 кДж/моль.
DS о = 2×197,5 – 213,75 – 5,7 = 175,85 Дж/(моль×К) =
175,85×10 -3 кДж/(моль×К).
Т = DН /DS = 172,5 /(175,85×10 -3 ) = 981 К.
Не прибегая к вычислениям, определите, как изменяется энтропия (уменьшается, увеличивается или не изменяется) в следующей реакции:
В этой реакции энтропия увеличивается, потому что исходные компоненты содержат 2 моля газа азота, а продукты реакции содержат 7 молей газообразных веществ (4 моля аммиака и 3 моля кислорода). 2
Моли веществ, находящихся в жидком или кристаллическом состоянии, обычно не суммируются, т.к. энтропия газа намного больше энтропии жидкости или твердого вещества.
http://www.sites.google.com/site/himulacom/%D0%B7%D0%B2%D0%BE%D0%BD%D0%BE%D0%BA-%D0%BD%D0%B0-%D1%83%D1%80%D0%BE%D0%BA/8-%D0%BA%D0%BB%D0%B0%D1%81%D1%81-%D0%BF%D0%B5%D1%80%D0%B2%D1%8B%D0%B9-%D0%B3%D0%BE%D0%B4-%D0%BE%D0%B1%D1%83%D1%87%D0%B5%D0%BD%D0%B8%D1%8F/%D0%B3%D0%BE%D1%80%D0%B5%D0%BD%D0%B8%D0%B5-%D0%B8-%D0%BC%D0%B5%D0%B4%D0%BB%D0%B5%D0%BD%D0%BD%D0%BE%D0%B5-%D0%BE%D0%BA%D0%B8%D1%81%D0%BB%D0%B5%D0%BD%D0%B8%D0%B5/%D0%B0%D0%BB%D0%B3%D0%BE%D1%80%D0%B8%D1%82%D0%BC-4-%D1%80%D0%B0%D1%81%D1%87%D1%91%D1%82%D1%8B-%D0%BF%D0%BE-%D1%82%D0%B5%D1%80%D0%BC%D0%BE%D1%85%D0%B8%D0%BC%D0%B8%D1%87%D0%B5%D1%81%D0%BA%D0%B8%D0%BC-%D1%83%D1%80%D0%B0%D0%B2%D0%BD%D0%B5%D0%BD%D0%B8%D1%8F%D0%BC-%D1%82%D1%85%D1%83
http://mykonspekts.ru/2-69201.html