Используя уравнение бэт рассчитайте поверхность адсорбента
В большинстве случаев реальная поверхность твердого тела не вполне однородна энергетически; адсорбция, как правило, не является строго локализованной; адсорбированные молекулы практически всегда взаимодействуют между собой; наконец, стехиометрия может нарушаться, вследствие чего адсорбция не будет ограничена образованием одного слоя. Поэтому реальные изотермы адсорбции всегда отклоняются от изотермы Ленгмюра. Еще самим Ленгмюром было показано, что если адсорбционные центры считать энергетически неоднородными, то суммарная адсорбция на всех центрах будет выражена следующим уравнением:
где i — количество групп одинаковых центров.
Брунауэр, Эммет и Теллер отказались от второго допущения Ленгмюра, приводящего к мономолекулярной адсорбции. Для случая, когда температура адсорбтива ниже критической (то есть, это еще пар) они разработали теорию полимолекулярной адсорбции. После анализа многочисленных реальных изотерм адсорбции ими была предложена их классификация на основе выделения пяти основных типов изотерм.
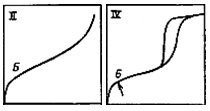
Изотермы типа I отражают мономолекулярную адсорбцию. Изотермы типа II и III обычно связывают с образованием при адсорбции многих слоев, то есть, с полимолекулярной адсорбцией. Приче м, в случае II взаимодействие адсорбент — адсорбат сильнее взаимодействия адсорбат — адсорбат, а в случае III — наобор от. Изотермы типа IV и V отличаются тем, что для них характерна конечная адсорбция при приближении давления пара к давлению насыщения ps. Изотермы типа II и III характерны для адсорбции на не пористом адсорбенте, а типа IV и V — на пористом твердом теле. Все пять типов изотерм адсорбции описываются теорией полимолекулярной адсорбции “БЭТ”, названной так по начальным буквам фамилий ее авторов.
Теория БЭТ сохраняет ленгмюровские представления о динамическом характере адсорбции. Адсорбция считается полислойной. Молекулы первого слоя адсорбируются на поверхности адсорбента в результате межмолекулярного взаимодействия адсорбент — адсорбат. Каждая адсорбированная молекула первого адсорбционного слоя может, в свою очередь, являться центром адсорбции молекул второго слоя и т.д. Так формируются второй и последующие сорбционные слои. Теплота адсорбции в первом слое q1 определяется взаимодействием адсорбат — адсорбент, во всех последующих слоях — взаимодействием адсорбат — адсорбат. Поэтому теплота адсорбции во всех слоях, начиная со второго, равна теплоте конденсации λ. Второй и последующие адсорбционные слои могут начинать образовываться и при незавершенном первом слое, как это показано на рисунке:
Составив уравнение адсорбционного равновесия для каждого слоя и просуммировав их, авторы теории БЭТ получили уравнение для полислойной адсорбции:
В приведенном уравнении АМ — емкость монослоя, С — константа, равная е (q1− λ) / RT . При малых относительных давлениях, когда р как частный случай уравнения БЭТ. В случаях, когда q1 > λ , т.е. энергия взаимодействия адсорбент — адсорбат больше энергии взаимодействия адсорбат — адсорбат, изотерма адсорбции выпукла и относится к типу II или IV. Если же энергия взаимодействия адсорбат — адсорбат больше теплоты адсорбции ( λ > q1 ), то изотерма адсорбции вогнута и относится к типу III или V.
Уравнение изотермы адсорбции БЭТ широко используется для определения величины удельной поверхности адсорбентов. Изотерма адсорбции выражается прямой линией, отсекающей на оси ординат отрезок, равный 1 / АМ С , а тангенс угла ее наклона к оси абсцисс равен (С − 1) / АМ С.
Из этих значений можно найти величину АМ, а зная ее, рассчитать по уравнению удельную поверхность адсорбента. Стандартной методикой для определения удельной поверхности адсорбентов принято считать измерение изотермы адсорбции азота при 77 К. В этом случае wо = 0.162 нм 2 .
- Источник: Пальтиель Л.Р., Зенин Г.С., Волынец Н.Ф. КОЛЛОИДНАЯ ХИМИЯ: Учеб. пособие. – СПб: СЗТУ, 2004. – 68 с.
- Источник: Кукушкина И.И., Митрофанов А.Ю. Коллоидная химия, Кемерово:2009 — 185 с.
Измерение удельной поверхности. Метод БЭТ
Методы анализа поверхности тел с участием сорбируемых газов приобрели особое значение в связи с появлением новых материалов с уникальной структурой и свойствами.
Для измерения удельной поверхности и пористой структуры высокодисперсных твердых тел или систем с развитой пористостью, таких, как порошки, адсорбенты, катализаторы, а также для расчета размера нанесенных частиц широко используются изотермы адсорбции, – экспериментальные зависимости адсорбции a от давления р/р0 при постоянной температуре.
Существует несколько методов математического описания физической адсорбции.
Определение удельной поверхности методом БЭТ (Брунауэра-Эммета-Теллера) является наиболее распространенным методом. В нем используются следующие допущения: поверхность адсорбента однородна; взаимодействие адсорбент–адсорбат сильнее, чем адсорбат–адсорбат; взаимодействие адсорбированных молекул учитывается только в направлении, перпендикулярном поверхности, и рассматривается как конденсация. Для вычисления площади поверхности адсорбента определяется объем газа относительно мономолекулярного слоя и площадь поперечного сечения молекулы адсорбированного газа. Принято считать, что метод БЭТ можно использовать для измерения площади поверхности с точностью 5-10% в интервале значений относительного давления р/р0 0,05-0,35.
Тема: Поверхностные явления. Адсорбция
Тема: Поверхностные явления. Адсорбция
1. Вычислите общую площадь поверхности частиц (S), содержащихся в 1 г угольной пыли. Масса каждой частицы равна 4,825∙10-13 г, а поверхность 2∙10-8 см2.
2. Из перечисленных ниже веществ укажите, какие относятся к ПАВ, ПИВ или ПНВ и нарисуйте изотермы поверхностного натяжения для каждого из них: сульфат натрия, глюкоза, стеарат натрия, пентанол-1.
3. Какова величина поверхностной энергии тромбоцитов, содержащихся в 1 мл крови, если известно, что поверхностное натяжение тромбоцита равно 20∙10-3 Дж/м2, число тромбоцитов 3∙108 в 1 см3, а площадь поверхности единичного тромбоцита составляет
4. Рассчитайте работу адгезии ртути к стеклу при 293 К, если известен краевой угол q = 130°. Поверхностное натяжение ртути 475 мДж/м2. Найдите коэффициент растекания ртути по поверхности стекла.
5. Объясните причину поднятия жидкости в тонком капилляре относительно уровня сообщающейся с ней жидкости с плоской поверхностью.
6. Ниже приведены экспериментальные данные по адсорбции азота на TiO2 (рутиле) при 75 К:
P·102 Па 60,94 116,41 169,84 218,65 275,25
А, моль/кг 0,367 0,417 0,467 0,512 0,567.
Постройте график соответствующий линейному уравнению БЭТ. Найдите константы А¥ и k. Рассчитайте удельную поверхность адсорбента. Давление насыщенного пара азота при указанной температуре Рs=78300 Па, площадь, занимаемая одной молекулой азота Sо=0,16 нм2.
7. Для водного раствора пропилового спирта найдены следующие значения констант уравнения Шишковского (при 293°): a = 14,4∙10-3, b = 6,6. Вычислите поверхностное натяжение раствора с концентрацией, равной 1 кмоль/м3. Поверхностное натяжение воды sо = 72,53∙10-3 н/м.
Домашняя работа №1 по коллоидной химии
Тема: Поверхностные явления. Адсорбция
1. Дисперсная система (золь камфоры в воде) содержит 2∙1014 шарообразных частиц в 1 см3. Подсчитайте общую поверхность частиц вещества дисперсной фазы (S), содержащихся в 100 мл этой системы, если диаметр частиц составляет 2∙10-6 см; площадь поверхности шара 4pR2.
2. Из перечисленных ниже веществ укажите, какие относятся к ПАВ, ПИВ или ПНВ и нарисуйте изотермы поверхностного натяжения для каждого из них: этанол, ацетон глицерин, бутанол-1.
3. Какова величина поверхностной энергии эритроцитов, содержащихся в крови взрослого человека, если известно, что поверхностное натяжение эритроцита равно 15∙10-3 Дж/м2, число эритроцитов 4∙109 в 1 см3, а площадь поверхности единичного тромбоцита составляет
22∙10-12 м2, а объем крови 5 л.
4. Один стеклянный капилляр погружен в воду (σ = 72,5 мН/м), другой – в бензол (σ = 28,9 мН/м). Каким должен быть радиус первого и второго капилляра, чтобы высота капиллярного поднятия была одинакова?
5. Почему две стеклянные пластинки, полностью погруженные в воду и прижатые друг к другу, можно легко отделить одна от другой, а на воздухе (при наличии между ними тонкого слоя воды) для этого требуются значительные усилия?
6. Используя уравнение БЭТ, построить изотерму адсорбции бензола по нижеуказанным данным и рассчитайте удельную поверхность адсорбента по изотерме адсорбции бензола:
Р/Рs 0,03 0,07 0,12 0,17 0,24 0,31 0,38
А, моль/кг 0,196 0,301 0,373 0,423 0,488 0,520 0,625.
Площадь, занимаемую молекулой бензола, примите равной 0,49 нм2.
7. Даны константы уравнения Шишковского для водного раствора валериановой кислоты при 273К: a = 14,72∙10-3, b = 10,4. При какой концентрации поверхностное натяжение раствора будет составлять 52,1∙10-3Н/м, если поверхностное натяжение воды при 273 К равно 75,49∙10-3 Н/м.
Домашняя работа №1 по коллоидной химии
Тема: Поверхностные явления. Адсорбция
1. Удельная поверхность суспензии селена 
2. Из перечисленных ниже веществ укажите, какие относятся к ПАВ, ПИВ или ПНВ и нарисуйте изотермы поверхностного натяжения для каждого из них: бензол, фруктоза, олеат калия, серная кислота.
3. Определите поверхностное натяжение бензола при 293, 313 и 343 К. Примите, что полная поверхностная энергия не зависит от температуры и для бензола равна 61,9 мДж/м2. Температурный коэффициент поверхностного натяжения равен -0,13 мДж/(м2К).
4. Вычислите краевой угол, образованный формамидом на поверхности желатинового геля, если работа адгезии составляет 50,2 мДж/м2. Поверхностное натяжение формамида равно 41,2 мДж/м2.
5. Изобразите схематически ориентацию молекул маслорастворимого ПАВ на поверхности раздела вода/углеводород при адсорбции из углеводорода. Зависит ли в этом случае поверхностная активность от длины углеводородного радикала ПАВ и как?
6. Используя уравнение БЭТ, построить изотерму адсорбции бензола по нижеуказанным данным и рассчитайте удельную поверхность адсорбента по изотерме адсорбции бензола:
Р/Рs 0,02 0,05 0,11 0,19 0,25 0,30 0,36
А, моль/кг 0,104 0,196 0,298 0,387 0,443 0,488 0,55.
Площадь, занимаемую молекулой бензола, примите равной 0,49 нм2.
7. Используя константы уравнения Шишковского (a = 12,6∙10-3, b = 21,5), рассчитать поверхностное натяжение для водных растворов масляной кислоты при 273К для следующих концентраций (кмоль/м3): 0,007; 0,021; 0,05; 0,104 и построить кривую в координатах s = f(c). Поверхностное натяжение воды sо = 75,49∙10 -3 Н/м.
Домашняя работа №1 по коллоидной химии
Тема: Поверхностные явления. Адсорбция
1. Удельная поверхность частиц аэрозоля серебра Sо= 300 м2 . Принимая частицы шарообразными, определить диаметр частиц серебра.
2. Из перечисленных ниже веществ укажите, какие относятся к ПАВ, ПИВ или ПНВ и нарисуйте изотермы поверхностного натяжения для каждого из них: соляная кислота, толуол, метанол, хлороформ.
3. Какова величина поверхностной энергии эритроцитов, содержащихся в 1 мл цельной крови человека, если известно, что поверхностное натяжение эритроцита равно 15∙10-3 Дж/м2, число эритроцитов 4∙109 в 1 см3, а площадь поверхности единичного тромбоцита составляет
4. Вычислите краевой угол, образованный формамидом на поверхности желатинового геля, если работа адгезии составляет 50,2 мДж/м2. Поверхностное натяжение формамида равно 41,2 мДж/м2.
5. Изобразите схематически ориентацию молекул маслорастворимого ПАВ на поверхности раздела вода/углеводород при адсорбции из углеводорода. Зависит ли в этом случае поверхностная активность от длины углеводородного радикала ПАВ и как?
6. Ниже приведены результаты измерения адсорбции газообразного криптона (при 77,5 К) на катализаторе:
А·103, м3/кг 1,27 1,5 1,76 1,9 1,98
Р, Па 13,22 23,99 49,13 75,70 91,22.
Значения А для криптона даны при нормальных условиях. Определите константы уравнения БЭТ и удельную поверхность катализатора, принимая, что один атом криптона занимает площадь 0,195 нм2, Рs=342,6 Па, плотность криптона равна 3,74 кг/м3.
7. Определите поверхностную активность уксусноэтилового эфира по приведенным ниже значениям поверхностного натяжения водных растворов его при 298 К:
С ммоль/л 7,8 15,6 31.2 62,5 125 250 500
s, мДж/м2 69,6 68,0 65,1 61,5 56,2 49,7 41,5.
Постройте изотерму гиббсовской адсорбции. Поверхностное натяжение воды 71,96 мДж/м2.
Домашняя работа №1 по коллоидной химии
Тема: Поверхностные явления. Адсорбция
1. Полагая, что частицы имеют форму шара, вычислить дисперсность D и удельную поверхность Sо для частиц микроскопической области, имеющих размеры, мкм: 1000; 100; 10; 1, а также для частиц из ультрамикроскопической области, где частицы имеют размеры, нм: 0,1; 1; 10; 100.
2. Из перечисленных ниже веществ укажите, какие относятся к ПАВ, ПИВ или ПНВ и нарисуйте изотермы поверхностного натяжения для каждого из них: сульфид натрия, сахароза, сульфацил натрия, изо-амиловый спирт.
3. Рассчитайте избыточное давление в капле воды (за счет кривизны) с удельной поверхностью 3∙106 м-1 при температуре 313 К, если поверхностное натяжение воды при 298 К составляет 71,96 мДж/м2, а температурный коэффициент поверхностного натяжения воды ds/dT = 0,16 мДж/(м2∙К).
4. Капли воды массой 0,1 г введена между параллельными стеклянными пластинками, причем краевой угол q = 0°. Какова сила притяжения между пластинками, если они находятся друг от друга на расстоянии 1 мкм. Поверхностное натяжение воды составляет 71,96 мДж/м2, плотность воды 0,997 г/см3.
3. На поверхность воды с бесконечно большой площадью нанесена капля стеариновой кислоты. Для этой системы Wa>Wc. Какое явление произойдет? Какая схема правильно отражает строение образовавшегося монослоя? Напишите уравнение состояния этого слоя.
6. Используя уравнение БЭТ, рассчитайте удельную поверхность адсорбента по данным об адсорбции азота:
А∙103, м3/кг 0,71 0,31 0,93 1,09
Р/Рs 0,1 0,2 0,3 0,4.
Площадь занимаемая молекулой азота в плотном монослое, равна 0,16 нм2, Плотность азота 1,25 кг/м3.
7. Вычислите адсорбцию масляной кислоты на поверхности раздела водного раствора с воздухом при 273К и концентрации c = 0,1 кмоль/л3, если зависимость поверхностного натяжения от концентрации выражается уравнением Шишковского:
Домашняя работа №1 по коллоидной химии
Тема: Поверхностные явления. Адсорбция
1. Кристалл поваренной соли, имеющий форму куба, подвергся дроблению, в результате чего получились мельчайшие кубики-кристаллики с ребрами в 1; 0,1; 0,01 и 0,001 мкм. Вычислить дисперсность D и удельную поверхность Sо для этих кристалликов.
2. Из перечисленных ниже веществ укажите, какие относятся к ПАВ, ПИВ или ПНВ и нарисуйте изотермы поверхностного натяжения для каждого из них: додецилсульфат натрия, метилэтилкетон, пероксид водорода, пентанол-2.
3. Рассчитайте поверхностное натяжение ртути, если в стеклянном капилляре радиусом 0,16·10-3 м столбик ее опустился на 0,012 м ниже уровня ртути в сосуде. Плотность ртути равна 13,6·103 кг/м3. Краевой угол смачивания равен 130°.
4. Рассмотрите возможность растекания водного раствора валериановой кислоты по поверхности ртути, исходя из значений поверхностных и межфазных натяжений: sр-р-воздух = 25 мДж/м2, sHg-воздух = 475 мДж/м2, sHg-р-р = 329 мДж/м2. Если раствор будет растекаться по поверхности ртути, то, как при этом ориентируются полярные группы валериановой кислоты: к воде или к ртути? Объясните почему.
5. В чем состоит правило Дюкло-Траубе? Нарисуйте схематически семейства изотерм поверхностного натяжения и адсорбции для этанола, н-пропанола и н-бутанола.
6. Используя уравнение БЭТ, рассчитайте удельную поверхность адсорбента по изотерме адсорбции азота (Т=77 К, Sо=16,2·10-20 м2):
Р/РS 0,0288 0,050 0,110 0,136 0,175 0,200
А, моль/кг 2,16 2,39 2,86 3,02 3,22 3,33.
Площадь занимаемая одной молекулой азота в адсорбционном слое 0,16 нм2.
7. Найдите адсорбцию пропионовой кислоты на поверхности раздела водный раствор – воздух при 273К и концентрации 0,5 кмоль/м3 по константам Шишковского: a = 12,5∙10-3 и b = 7,73.
Домашняя работа №1 по коллоидной химии
Тема: Поверхностные явления. Адсорбция
1. Туман, состоящий из капелек кадмия, сконденсировался, при этом образовалось 12,5∙10 -6 м3 жидкого кадмия, а свободная поверхностная энергия капелек уменьшилась на 530 Дж. Поверхностное натяжение жидкого кадмия при температуре конденсации равно 0,57 Н/м. Вычислить дисперсность D и размер (диаметр) капелек жидкого кадмия.
2. Из перечисленных ниже веществ укажите, какие относятся к ПАВ, ПИВ или ПНВ и нарисуйте изотермы поверхностного натяжения для каждого из них: сульфат меди, гептан, муравьиная кислота, изо-пропиловый спирт.
3. Рассчитайте полную поверхностную энергию 5 г эмульсии бензола в воде с концентрацией 55% (масс.) и дисперсностью 3 мкм3 при температуре 313 К. Плотность бензола 0,858 г/см3, межфазное поверхностное натяжение 26,13 мДж/м2, температурный коэффициент поверхностного натяжения бензола ds/dT = -0,13 мДж/ (м2∙К).
4. Найдите поверхностное натяжение жидкости, если в капилляре с диаметром 2 мм она поднимается на высоту 15 мм. Плотность жидкости 0,998 г/см3, краевой угол мениска равен 0°. Сделайте предположение о природе жидкости.
5. На поверхности некоторого твердого тела и вода (Н2О), и углеводород (СхНу) образуют острый краевой угол (схема 1 и 2). Избирательное смачивание в этой системе отражается схемой 3. Гидрофильно или гидрофобно данное тело? Обозначьте краевой угол на схеме 3.
6. По изотерме адсорбции азота определить удельную поверхность адсорбента
(Т=77 К, Sо=16,2·10-20 м2):
Р/Рs 0,04 0,09 0,16 0,20 0,30
А, моль/кг 2,20 2,62 2,94 3,11 3,58.
7. Вычислите по формуле Ленгмюра величину адсорбции изоамилового спирта концентрации c= 0,1 кмоль/м3 на поверхности раздела водный раствор – воздух при 292К по данным константам: Г¥ = 8,7∙10-9 кмоль/м2, b = 42.
Домашняя работа №1 по коллоидной химии
Тема: Поверхностные явления. Адсорбция
1. Вычислите величину поверхности масла, содержащихся в 10 г эмульсии масла в воде, если известно, что массовая доля масла равна 0,7, поверхность каждой частицы масла составляет 12,56∙10-8 см2, а ее масса равна 3,85∙10-12 г.
2. Из перечисленных ниже веществ укажите, какие относятся к ПАВ, ПИВ или ПНВ и нарисуйте изотермы поверхностного натяжения для каждого из них: нитрат натрия, ванилин, синильная кислота, гептанол-1.
3. Для определения поверхностного натяжения воды взвешивают капли, отрывающиеся от капилляра, и измеряют, диаметр капли в момент ее отрыва. Оказалось что масса 318 капель воды равна 5,0 г, а диаметр шейки капли – 0,7 мм. Рассчитайте поверхностное натяжение воды.
4. Насколько изменится разность уровней воды в двух сообщающихся капиллярах с диаметрами 0,1 и 0,3 мм при нагревании от 293 до 343 К, если поверхностное натяжение при этих температурах равно соответственно 72,75 и 64,0 мДж/м2.Плотность воды при 293 и 343 К составляет соответственно 0,998 г/см3 и 0,78 г/см3.
5. При каком условии частица материала будет удерживаться на поверхности воды (т. е. возможна флотация):
http://www.czl.ru/applications/opredelenie-udelnoy-poverhnosti-metod-bet/
http://pandia.ru/text/80/175/5595.php






