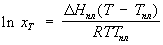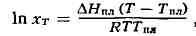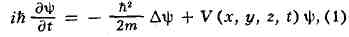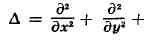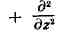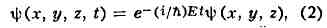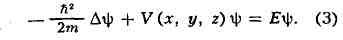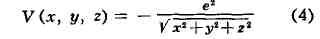Шредера уравнение
Шр е дера уравн е ние, математическое соотношение, выражающее связь между растворимостью кристаллического тела xt при температуре Т (в К), его теплотой плавления D Нпл (в кал/моль) и температурой плавления Тпл:
где R — газовая постоянная; D Нпл принимается постоянной в интервале Тпл — Т. Строгое применение Шредера уравнения ограничено идеальными растворами. Построив по Шредера уравнению кривые температурной зависимости растворимости для твёрдой фазы каждого из компонентов двойной системы, можно найти эвтектическую точку (см. Эвтектика) и получить растворимости диаграмму.
Шредера уравнение выведено в 1890 И. Ф. Шредером. Оно известно также под названием «логарифмики Шредера» и уравнения Шредера — Ле Шателье (А. Ле Шателье ранее получил зависимость растворимости от температуры в дифференциальной форме, на основании которой в 1894 вывел уравнение, аналогичное Шредера уравнению).
Лит.: Кипнис А. Я., Развитие химической термодинамики в России, М.—Л., 1964. См. также лит. при ст. Растворы.
Тема 1. Расчет тепловых эффектов физических и химических превращений
Задача №22
Два вещества (А и В) не образуют твердых растворов, но в расплавленном состоянии смешиваются друг с другом в любых соотношениях. Постройте диаграмму фазового состояния (диаграмму плавкости) двухкомпонентной системы (А — В), зная температуру начала кристаллизации системы (табл. 21, состав задан по веществу А, мольн.%).
1. Обозначьте точками: I – жидкий плав, содержащий а% вещества А при температуре T1; II – плав, содержащий а% вещества А, находящийся в равновесии с кристаллами химического соединения; III – систему, состоящую из твердого вещества А в равновесии с расплавом, содержащим б% вещества А; IV – равновесие трех фаз (табл. 22).
2. Определите составы химических соединений.
3. Определите качественные и количественные составы эвтектик.
4. Определите число фаз и число термодинамических степеней свободы системы при эвтектической температуре и содержании компонента А 95%.
5. При какой температуре начнет отвердевать расплав, содержащий в% вещества А? При какой температуре он отвердеет полностью? Каков состав первых выпавших кристаллов?
6. Вычислите теплоты плавления веществ А и В.
| Вариант | Система | Состав А, мольн.% | T, К начала кристаллизации |
| A – KCl B – SnCl2 | 52,5 | ||
| A – KJ B – CdJ2 |
Продолжение таблицы 21
| A – KCl B – MnCl2 | |
| A – SrBr2 B – LiBr | 66,6 |
Продолжение таблицы 21
| A – MgSO4 B – Cs2SO4 |
| A – RbCl B – SrCl2 |
Продолжение таблицы 21
| A – KCl B – PbCl2 | 33,5 |
| A – CsCl B – SrCl2 | 875,8 876,8 |
Продолжение таблицы 21
| A – KCl B – CaCl2 | 75,5 77,5 89,5 |
| A – FeCl3 B – TlCl |
Продолжение таблицы 21
| A – CuCl2 B – CsCl | 66,6 |
| A – CdCl2 B – TlCl | 36,5 57,5 67,5 |
Продолжение таблицы 21
| A – SrBr2 B – LiBr | 66,6 |
| A – InCl3 B – NaCl | 13,3 22,2 35,8 37,6 50,6 61,6 66,8 74,6 80,6 81,6 84,8 |
| A – MgCl2 B – TlCl | 33,3 66,6 |
Продолжение таблицы 21
| A – SrBr2 B – KBr | 33,3 66,7 |
| A – NiF2 B – KF | 4,9 9,2 13,4 15,2 18,4 21,8 23,8 30,3 37,9 46,7 50,5 |
Продолжение таблицы 21
| A – KJ B – KF | |
| A – PbCl2 B – TlCl | 15,5 36,5 66,6 |
Продолжение таблицы 21
| A – MgSO4 B – K2SO4 | 63,9 66,8 75,3 82,2 |
| A – MnCl2 B – RbCl |
Продолжение таблицы 21
| A – LiNO3 B – Pb(NO3)2 | 32,5 | 535,5 449,5 457,6 519,5 |
| A – MnCl2 B – RbCl | 17,5 22,7 23,7 25,9 30,4 33,1 35,5 36,2 37,5 43,8 58,1 68,3 78,7 |
Продолжение таблицы 21
| A – Li2SO4 B – Cs2SO4 | 18,5 |
| A – HgBr2 B – HgJ2 | 528,4 509,2 500,8 494,1 490,3 489,3 489,1 489,6 490,8 495,2 501,9 509,5 |
Продолжение таблицы 21
| A – Mg B – Cu |
| A – Si B –Cr |
Продолжение таблицы 21
| A – Mg B –Ca |
| A – KBr B – AgBr |
| A – LiCl B – KCl |
| Вариант | Т1, К | а, мол. % | б, мол. % | в, мол. % |
| – | ||||
| – | ||||
| – |
Проанализируем диаграмму «температура–состав» для бинарной системы Li2CO3 – K2CO3 (табл. 23).
Построим диаграмму плавкости (рис. 5) – зависимость температуры кристаллизации от состава системы. Соединим точки на диаграмме линией (линия С G E1 XC E2 D). Это – линия ликвидуса. Точка максимума на ней (точка ХС) отвечает образованию устойчивого химического соединения. Точки минимума E1 и E2 – эвтектические точки. Эвтектикой называется смесь двух веществ, кристаллизующаяся при единой температуре.
Сделаем дополнительные построения: опустим перпендикуляр из точки ХС, проведем две горизонтальные линии через точки E1 и E2. Горизонтальные линии МE1 и E2N – линии солидуса.
| Система | Состав А, молярн.% | T, К начала кристаллизации |
| A – Li2CO3 B – K2CO3 | 39,5 44,2 54,5 66,6 83,5 |
Линии делят диаграмму на ряд областей. Выше линии ликвидуса любая смесь находится в жидком (расплавленном) состоянии. Ниже линии солидуса система находится в твердом состоянии и представляет из себя смесь кристаллов двух видов. В левой части диаграммы это смесь кристаллов вещества В (K2CO3) и кристаллов химического соединения. В правой части диаграммы — смесь кристаллов вещества А (Li2CO3) и кристаллов химического соединения. В заштрихованных областях в равновесии находятся жидкая и кристаллическая фазы.
Рисунок 5 – Диаграмма плавкости для системы Li2CO3 – K2CO3
1. Обозначим точками:
I – жидкий плав, содержащий при температуре T1 = 923К 40% Li2CO3. Для этого найдем на оси абсцисс точку, соответствующую составу 40% Li2CO3 – это точка К. На оси ординат отмечаем температуру T1 = 923К. На пересечении линий получаем точку I, которая расположена в области выше линии ликвидуса, т.е. в области жидкого расплава;
II – плав, содержащий 40% Li2CO3, находящийся в равновесии с кристаллами химического соединения. Аналогичным образом найдем на оси абсцисс точку, соответствующую составу 40% Li2CO3 – это точка К. Восстановим перпендикуляр до пересечения с линией ликвидуса и получим точку II;
III – систему, состоящую из твердого Li2CO3 в равновесии с расплавом, содержащим 75% Li2CO3. Для этого найдем на оси абсцисс точку, соответствующую составу 75% Li2CO3 – это точка L. Восстановим перпендикуляр до пересечения с линией ликвидуса и получим точку III. На ветви ликвидуса DE2 в твердую фазу переходит компонент системы Li2CO3; расплав при этом обогащается компонентом K2CO3.
IV – равновесие трех фаз. Равновесие трех фаз имеет место в точках эвтектики E1 и E2.
2. Определим составы химических соединений.
На представленной диаграмме одно химическое соединение (ХС), характеризующееся составом 50% компонента Li2CO3 и 50% компонента K2CO3.
3. Определим качественные и количественные составы эвтектик.
Качественный состав: твердые эвтектики состоят из кристаллов K2CO3 и кристаллов химического соединения (E1) и из кристаллов Li2CO3 и кристаллов химического соединения (E2).
4. Определим по уравнению (68) число фаз и число термодинамических степеней свободы С системы при эвтектической температуре и 95% содержании компонента Li2CO3. При Т = 765 К (точка N) система трехфазна (Ф = 3) – в равновесии находятся две твердых фазы (кристаллы химического соединения и кристаллы K2CO3) и жидкий расплав; число компонентов К = 2, число внешних факторов n = 1, т.к. (p = const).Число степеней свободы
Сусл = 2 – 3 + 1 = 0.
Система безвариантна – в этой точке нельзя менять ни один параметр (температура, состав), не нарушив равновесия.
5. При какой температуре начнет отвердевать расплав, содержащий 10% Li2CO3? При какой температуре он отвердеет полностью? Каков состав первых выпавших кристаллов?
Для ответа на эти вопросы найдем на оси абсцисс точку, соответствующую составу 10% Li2CO3 – это точка F. Восстановим перпендикуляр до пересечения с линией ликвидуса в точке G, т.к. точки, лежащие на линии ликвидуса отвечают температуре начала кристаллизации. Для анализируемого состава получим температуру начала кристаллизации T = 1050 К. По линии GF осуществляется охлаждение расплава, содержащего 10% Li2CO3 до достижения линии солидуса в точке M. Расплав отвердеет полностью при эвтектической температуре T = 730 К. В процессе кристаллизации в твердую фазу переходит тот компонент, которого в системе больше (по сравнению с эвтектической точкой), на основании этого состав первых выпавших кристаллов – 100 % K2CO3.
6. Вычислим теплоты плавления веществ Li2CO3 и K2CO3.
Зависимость температуры кристаллизации расплава от состава расплава выражается уравнением Шредера:

где N – мольная доля вещества в смеси;


T – температура начала кристаллизации расплава с мольной долей N.
Рассчитаем теплоту плавления вещества Li2CO3.
Для расчета возьмем сплав, содержащий 90% Li2CO3. Мольная доля Li2CO3 в системе 
По уравнению Шредера вычислим теплоту плавления вещества Li2CO3:
Теплота плавления Li2CO3 составила 16,8 кДж/моль.
Аналогичным образом рассчитаем теплоту плавления вещества K2CO3. Для расчета возьмем сплав, содержащий 90% K2CO3. Мольная доля K2CO3 в системе 
По уравнению Шредера вычислим теплоту плавления вещества K2CO3:
Теплота плавления K2CO3 составила 11,1 кДж/моль.
Контрольные вопросы
Тема 1. Расчет тепловых эффектов физических и химических превращений
1. Сформулируйте и объясните I закон термодинамики.
2. Поясните физический смысл величин, входящих в I закон термодинамики.
3. В чем заключается отличие теплоты и работы?
4. В чем отличие теплоты и работы от внутренней энергии?
5. Сформулируйте закон Гесса и его следствия. Для каких физико-химических процессов он применяется?
6. Дайте определение теплового эффекта химической реакции. Какие виды тепловых эффектов вы знаете?
7. Что такое внутренняя энергия, каковы ее общие свойства?
8. Сформулируйте понятие энтальпии реакции. Охарактеризуйте ее свойства.
9. Как связаны между собой энтальпия и внутренняя энергия?
10. Что такое стандартный тепловой эффект?
11. Дайте определение теплоты образования и теплоты сгорания.
12. Какие методы расчета тепловых эффектов при стандартных условиях вы знаете?
13. Как найти тепловой эффект реакции при стандартных условиях с помощью теплот образования и сгорания?
14. В чем заключается метод расчета тепловых эффектов при стандартных условиях по термохимическим уравнениям и схемам?
15. Как произвести расчет теплового эффекта реакции по энергиям химических связей?
Используя уравнение шредера определите теплоту плавления


ШРЕДЕРА УРАВНЕНИЕ, математич. соотношение, выражающее связь между растворимостью кристаллич. тела xT при темп-ре T (в К), его теплотой плавления дhnл (в кал/моль) и темп-рой плавления Tnл:
где R — газовая постоянная; дhnл принимается постоянной в интервале Тпл-T. Строгое применение Ш. у. ограничено идеальными растворами. Построив по Ш. у. кривые температурной зависимости растворимости для твёрдой фазы каждого из компонентов двойной системы, можно найти эвтектическую точку (см. Эвтектика) и получить растворимости диаграмму.
Ш. у. выведено в 1890 И. Ф. Шредером. Оно известно также под назв. «логарифмики Шредера» и уравнения Шредера — Ле Шателье (A. Лe Шателье ранее получил зависимость растворимости от темп-ры в дифференциальной форме, на основании к-рой в 1894 вывел уравнение, аналогичное Ш. у.).
Лит. : Кипнис А. Я., Развитие химической термодинамики в России, M.- Л., 1964. См. также лит. при ст. Растворы.
M. X. Карапетьянц.
ШРЁДЕР-ДЕВРИЕНТ (Schroder-Devrient, урожд. Шредер) Вильгельмина (6.12.1804, Гамбург, — 26.1.1860, Кобург), немецкая певица (сопрано). Пению училась у Ю. Моцатти в Вене. В 1821 дебютировала в партии Памины («Волшебная флейта» Моцарта). Гастролировала в городах Италии, в Париже, Лондоне, Праге. Исполнила партию Леоноры («Фиделио» Бетховена, 1822, Вена), к-рая принесла ей славу выдающейся певицы Европы. В 1823-47 солистка придворной оперы в Дрездене. За участие в Дрезденском восстании 1849 была выслана из Саксонии и не выступала до 1856. Гастролировала в России. В иск-ве Ш.-Д. сочеталось вокальное мастерство с большой драм. одарённостью. Среди лучших партий: Сента («Летучий голландец» Вагнера), Агата («Вольный стрелок» Вебера).
Лит. : Серов A. H., Критические статьи, т. 3, СПБ, 1893, с. 1361-75; Wоlzоgеn A. vоn, Wilhelmine Schröder-Devrient, Lpz., 1863; Hagemann K., Wilhelmine Schr ö der-Devrient, Wiesbaden, 1947.
ШРЁДИНГЕР (Schrodinger) Эрвин (12. 8.1887, Вена, — 4.1.1961, там же; похоронен в Альпбахе, Тироль), австрийский физик, один из создателей квантовой механики. Окончил Венский ун-т (1910). С 1911 работал в Физ. ин-те Венского ун-та. В 1920 проф. Высшей технич. школы в Штутгарте, в 1921-Высшей технич. школы в Бреслау (Вроцлаве), в 1921-27 — Высшей технической школы в Цюрихе, с 1927 проф. Берлинского ун-та. В 1933-35 профессор Оксфордского ун-та, в 1936-38 — ун-та в Граце, в 1938-39 — в Генте, с 1940 проф. Королевской академии в Дублине, затем директор основанного им Ин-та высших исследований. С 1956 проф. Венского ун-та. Осн. труды по математич. физике, теории относительности, физике атома и биофизике. К ранним работам Ш. относятся исследования по теории кристаллич. решётки и создание в 1920 математич. теории цвета, к-рая легла в основу совр. колориметрии. Важнейшей заслугой Ш. является создание им волновой механики (кон. 1925 — нач. 1926): исходя из гипотезы Л. де Бройля о волнах материи, он показал, что стационарные состояния атомных систем могут рассматриваться как собственные колебания волнового поля, соответствующего данной системе; Ш. нашёл осн. ур-ние нерелятивистской квантовой механики (Шрёдингера уравнение) и дал его решение для ряда частных задач, а также общий метод его применения в теории возмущений.
Установил связь волновой механики с «матричной механикой» В. Гейзенберга, M. Борна и П. Иордана и доказал их физ. тождественность. Развитый Ш. математич. формализм и введённая им волновая функция пси явились наиболее адекватным математич. аппаратом квантовой механики и её применений. Нобелевская пр. (1933). Иностр. чл. АН СССР (1934).
Соч.: Abhandlungen zur Wellenmechanik, 2 Aufl., Lpz., 1928; в рус. пер. — Избр. труды по квантовой механике, M., 1976 (сер. «Классики науки»); Что такое жизнь? С точки зрения физика, 2 изд., M., 1972.
ШРЁДИНГЕРА УРАВНЕНИЕ, осн. динамич. уравнение нерелятивистской квантовой механики; названо в честь австр. физика Э. Шрёдингера, к-рый предложил его в 1926. В квантовой механике Ш. у. играет такую же фундаментальную роль, как уравнение движения Ньютона в классич. механике и Максвелла уравнения в классич. теории электромагнетизма. Ш. у. описывает изменение во времени состояния квантовых объектов, характеризуемого волновой функцией. Если известна волновая функция Y в начальный момент времени, то, решал Ш. у., можно найти Y в любой последующий момент времени t.
Для частицы массы т, движущейся под действием силы, порождаемой потенциалом V (х, у, Z, t), Ш. у. имеет вид:
где i = -(1) 1/2 , h = 1,05х10 -27 эрг-сек — Планка постоянная,
— Лапласа оператор (х, у, z-координаты), Это уравнение наз. временным Ш. у. Если потенциал V не зависит от времени, то решения Ш. у. можно представить в виде:
где E — полная энергия квантовой системы, а пси(х, у, z) удовлетворяет стационарному Ш. у.:
Для квантовых систем, движение к-рых происходит в огранич. области пространства, решения Ш. у. существуют только для нек-рых дискретных значений энергии: E1, E2, . Еп,···; члены этого ряда (в общем случае бесконечного) нумеруются набором целых квантовых чисел п. Каждому значению Enсоответствует волновая функция псиn (x, у, z), и знание полного набора этих функций позволяет вычислить все измеримые характеристики квантовой системы.В важном частном случае кулоновского потенциала
(где е — элементарный электрич. заряд) Т. у. описывает атом водорода, и En представляют собой энергии стационарных состояний атома.
Ш. у. является математич. выражением фундаментального свойства микрочастиц — корпускулярно-волнового дуализма, согласно к-рому все существующие в природе частицы материи наделены также волновыми свойствами (эта гипотеза впервые была высказана Л. де Бройлем в 1924). Ш. у. удовлетворяет соответствия принципу и в предельном случае, когда длины волн де Бройля значительно меньше размеров, характерных для рассматриваемого движения, содержит описание движения частиц по законам классич. механики. Переход от Ш. у. к классич. траекториям подобен переходу от волновой оптики к геометрической. Аналогия между классич. механикой и геометрич. оптикой, к-рая является предельным случаем волновой, сыграла важную роль в установлении Ш. у.
С математич. точки зрения Ш. у. есть волновое уравнение и по своей структуре подобно уравнению, описывающему колебания нагруженной струны. Однако, в отличие от решений уравнения колебаний струны, к-рые дают геометрич. форму струны в данный момент времени, решения пси (x, у, z, t) Ш. у. прямого физ. смысла не имеют. Смысл имеет квадрат волновой функции, а именно величина pn (х, у, z,t) =| псиn (х, y, z, t)| 2 , равная вероятности нахождения частицы (системы) в момент ( в квантовом состоянии и в точке пространства с координатами х, у, z. Эта вероятностная интерпретация волновой функции — один из осн. постулатов квантовой механики.
Математич. формулировка постулатов квантовой механики, основанная на Ш. у., носит название волновой механики. Она полностью эквивалентна т. н. матричной механике В. Гейзенберга, к-рая была сформулирована им в 1925.
Ш. у. позволяет объяснить и предсказать большое число явлений атомной физики, а также вычислить осн. характеристики атомных систем, наблюдаемые на опыте, напр., уровни энергии атомов, изменение спектров атомов под влиянием электрич. и магнитного полей и т. д. С помощью Ш. у. удалось также понять и количественно описать широкий круг явлений ядерной физики, напр., закономерности a-распада, y-излучение ядер, рассеяние нейтронов на ядрах и др.
Лит. : Шрёдингер Э., Новые пути в физике. Статьи и речи, M., 1971. См. также лит. к ст. Квантовая механика.
http://sdamzavas.net/2-59458.html
http://libelli.ru/05/2924.htm