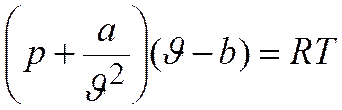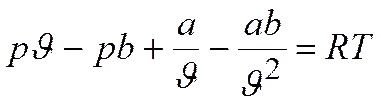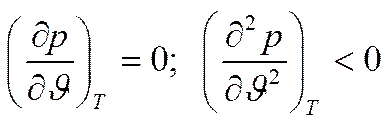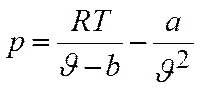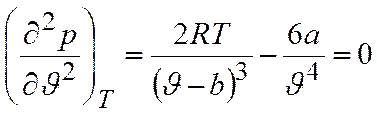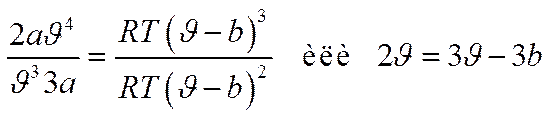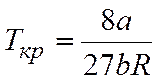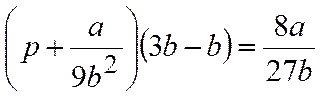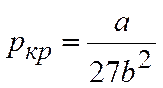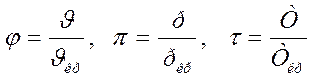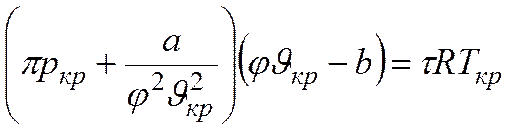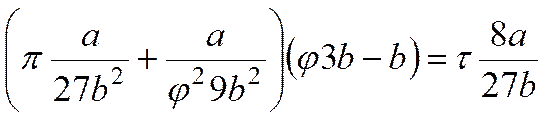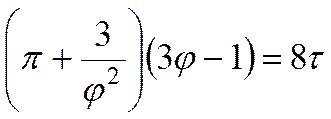Уравнение Ван-дер-Ваальса и его анализ
где постоянные поправки а и b зависят от природы газа.
Поправка b учитывает объем, недоступный для движения молекул в силу конечности объема самих молекул и наличия взаимодействия между ними. Величина b составляет примерно учетверенный объем самих молекул.
Поправка а учитывает силы взаимного притяжения. Полагая, что внутреннее давление газа изменяется пропорционально квадрату плотности или обратно пропорционально квадрату удельного объема газа, Ван-дер-Ваальс принял его равным а/J 2 , где а – коэффициент пропорциональности.
Раскрывая скобки в левой части:
Умножая равенство на J 2 и разделив на р:
Полученное уравнение имеет три корня, т.е. при заданных параметрах р и Т имеется три значения переменной J, которые превращают уравнение в тождество.
Рассмотрим в системе координат р–J изотермы, построенные по уравнению Ван-дер-Ваальса.

В этом случае между точками e и f находится область, в которой каждому давлению соответствует три значения удельного объема (давлению ра соответствуют удельные объемы Jb, Jс и Jd), которые и являются тремя действительными и различными корнями уравнения Ван-дер-Ваальса.
Участок 3-b соответствует изотермическому сжатию тела, 
Точка d соответствует такому состоянию тела, когда оно уже полностью превратилось в жидкость, в соответствии с чем участок d-4 представляет собой изотермическое сжатие жидкости.
Точка с соответствует промежуточному двухфазному состоянию тела. Участок кривой b-f соответствует неустойчивому состоянию пара, а участок d-e – неустойчивому состоянию жидкости.


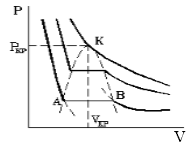
Точка k называется критической точкой, выше которой невозможно путем изотермического сжатия добиться перехода газа в жидкое состояние, а соответствующие ей параметры ркр, Jкр и Ткр называются критическими параметрами.
Аналитически условия критического состояния тела выражаются уравнениями
Первое из них показывает, что критическая изотерма в точке k имеет горизонтальную касательную, второе – что изотерма имеет в точке k перегиб.
Используя эти уравнения совместно с уравнением состояния, можно определить значения критических параметров состояния газа.
Критические параметры определяются следующим образом.
Преобразуем уравнение Ван-дер-Ваальса:
Определяем вторую производную:
Разделив первое уравнение на второе
и, следовательно 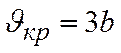
Далее, подставляя в уравнение Ван-дер-Ваальса, получаем:
откуда
Уравнение Ван-дер-Ваальса можно представить в безразмерном виде с подстановкой:
Подставляя в уравнение Ван-дер-Ваальса:
или
Окончательно
Уравнение Ван-дер-Ваальса в безразмерном виде показывает, что если у разных газов два приведенных параметра имеют одинаковое значение, то одинаковым будет и третий параметр.
Состояния разных газов, при которых их приведенные параметры 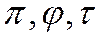
Реальные газы, находящиеся в соответственных состояниях, являются термодинамически подобными.
Если из данных эксперимента известны свойства какого-либо реального газа, то по ним без всякого эксперимента можно определить аналогичные свойства любого другого газа, находящегося с ним в соответственном состоянии.
Уравнение Ван-дер-Ваальса
Вы будете перенаправлены на Автор24
Что такое реальный газ
Реальным газом называют газ, между молекулами которого существуют заметные силы взаимодействия. В неидеальных, газах под высоким давлением, газах с большой плотностью взаимодействие молекул велико и его необходимо учитывать. Силы притяжения играют наиболее существенную роль на больших расстояниях между молекулами. Расстояние уменьшается, силы притяжения растут, но до определенного предела, затем они начинают уменьшаться и переходят в силы отталкивания. Притяжение и отталкивание молекул можно разделить и рассматривать и учитывать отдельно друг от друга.
Уравнение Ван-дер-Ваальса
Уравнение Ван-дер-Ваальса, описывающее состояние 1 моля реального газа, имеет вид:
где d- диаметр молекулы,
величина a вычисляется по формуле:
где $W_p\left(r\right)$- потенциальная энергия притяжения двух молекул. Необходимо заметить, что газовая постоянная имеет индивидуальное значение для каждого вещества. Она отличается от молярной газовой постоянной, причем она меньше, что говорит об объединении молекул вещества в комплексы около критического состояния. Вдали от критических состояний можно использовать универсальную газовую постоянную.
С увеличением объема роль поправок в уравнении (1) становится менее существенной. И в пределе уравнение (1) переходит в уравнение состояния идеального газа для 1 моля (4):
Уравнение (4) — уравнение Менделеева — Клайперона, где m- масса газа, $R=8,31\ \frac<Дж><моль\cdot К>$- универсальная газовая постоянная.
Это согласуется с тем фактом, что при уменьшении плотности реальные газы по своим свойствам приближаются к идеальным.
Уравнение (1) может быть записано в вириальной форме:
Для анализа изотерм уравнение (1) удобнее представить в виде:
Рассматриваемое уравнение может описывать и свойства жидкости, например плохую ее сжимаемость.
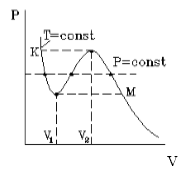
На рис.1 изображена изотерма Ван-дер-Ваальса для некоторого постоянного значения температуры T, построенная из соответствующего уравнения.
Такая зависимость на практике невозможна. Опыт показывает, что график должен иметь вид рис.2 то есть существуют области, в которых при изменении объема давление неизменно. В некоторых отрезках график изотермы параллелен оси V (рис 2). Это область фазового перехода. Жидкость и газ существую одновременно.
По мере увеличения температуры участок, отражающий состояние нахождения газа одновременно в двух фазах на графиках p(V), сужается и превращается в точку (рис. 2). Это особая точка К, в которой пропадает различие между жидкостью и паром. Это так называемая критическая точка.
Готовые работы на аналогичную тему
Итак, уравнение Ван-дер-Ваальса описывает поведение газов близких к реальным. Их можно применить к газообразной и жидкой фазам вещества. Эти уравнения отражают существование фазового перехода газ — жидкость. Показывают наличие критической точки перехода. Однако абсолютно точных количественных результатов расчеты, в которых используются вышеназванные уравнения, не дают.
Задание: Газ в количестве 1 моль находится в сосуде объемом V л при температуре $T_1$ давление газа $p_1$, а при $T_2$ давление газа $p_2$. Найти постоянные Ван-дер-Ваальса.
Запишем уравнение Ван-дер-Ваальса для одного моля реального газа для состояний 1 и 2:
Раскроем скобки в (1.1):
Вычтем $\left(1.4\right).\ из\ \left(1.3\right):$
Выразим a из (1.1):
Задание: Для реального газа, используя уравнение Ван-дер-Ваальса, получите уравнение адиабаты в параметрах V и T.
\[\delta Q=dU+\partial A=0\ \left(\ 2.1\right)\]
Так как процесс адиабатный, то он идет теплообмена. Перепишем уравнение (2.1) для ван-дер-ваальсовского газа, зная, что:
Из уравнения Ван-дер-Ваальса:
Подставим (2.5) в (2.4), разделим переменные:
Ответ: Уравнение адиабаты для заданного случая имеет вид: $<\left(V-b\right)>^<\frac<2>\nu >T=const.$
Получи деньги за свои студенческие работы
Курсовые, рефераты или другие работы
Автор этой статьи Дата последнего обновления статьи: 15 01 2022
Исследование уравнения ван дер ваальса
Предпринималось много попыток для учета отклонений свойств реальных газов от свойств идеального газа путем введения различных поправок в уравнение состояния идеального газа. Наибольшее распространение вследствие простоты и физической наглядности получило уравнение Ван-дер-Ваальса (1873).
Первая поправка в уравнении состояния идеального газа рассматривает собственный объем, занимаемый молекулами реального газа. В уравнении Дюпре (1864)
постоянная b учитывает собственный мольный объем молекул.
При понижении температуры межмолекулярное взаимодействие в реальных газах приводит к конденсации (образование жидкости). Межмолекулярное притяжение эквивалентно существованию в газе некоторого внутреннего давления 

(p + 
Ван-дер-Ваальс в 1873 г. дал функциональную интерпретацию внутреннего давления. Согласно модели Ван-дер-Ваальса, силы притяжения между молекулами (силы Ван-дер-Ваальса) обратно пропорциональны шестой степени расстояния между ними, или второй степени объема, занимаемого газом. Считается также, что силы притяжения суммируются с внешним давлением. С учетом этих соображений уравнение состояния идеального газа преобразуется в уравнение Ван-дер-Ваальса:
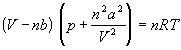
или для одного моля
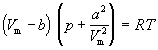
Значения постоянных Ван-дер-Ваальса a и b, которые зависят от природы газа, но не зависят от температуры, приведены в таблице 1.3.
Таблица 1.3. Постоянные Ван-дер-Ваальса для различных газов
| Газ | a, л 2 *бар* моль -2 | b,см 3 * моль -1 | Газ | a, л 2 * бар* моль -2 | b, см 3 * моль -1 |
| He | 0,03457 | 23,70 | NO | 1,358 | 27,89 |
| Ne | 0,2135 | 17,09 | NO2 | 5,354 | 44,24 |
| Ar | 1,363 | 32,19 | H2O | 5,536 | 30,49 |
| Kr | 2,349 | 39,78 | H2S | 4,490 | 42,87 |
| Xe | 4,250 | 51,05 | NH3 | 4,225 | 37,07 |
| H2 | 0,2476 | 26,61 | SO2 | 6,803 | 56,36 |
| N2 | 1,408 | 39,13 | CH4 | 2,283 | 42,78 |
| O2 | 1,378 | 31,83 | C2H4 | 4,530 | 5,714 |
| Cl2 | 6,579 | 56,22 | C2H6 | 5,562 | 63,80 |
| CO | 1,505 | 39,85 | C3H8 | 8,779 | 84,45 |
| CO2 | 3,640 | 42,67 | C6H6 | 18,24 | 115,4 |
Уравнение (1.6) можно переписать так, чтобы выразить в явном виде давление
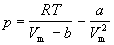
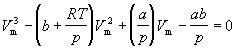
Уравнение (1.8) содержит объем в третьей степени и, следовательно, имеет или три действительных корня, или один действительный и два мнимых. При высоких температурах уравнение (1.8) имеет один действительный корень, и по мере повышения температуры кривые, вычисленные по уравнению Ван-дер-Ваальса, приближаются к гиперболам, соответствующим уравнению состояния идеального газа.
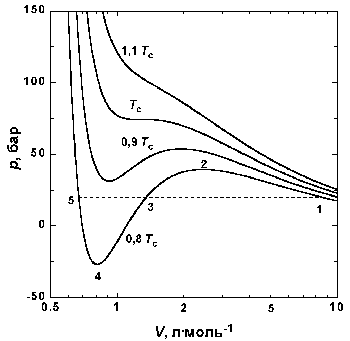 |
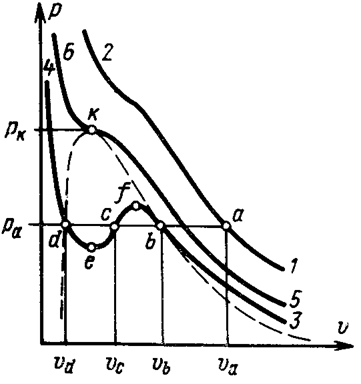
| Рис.1.4 Изотермы Ван-дер-Ваальса для СО2 |
На рис. 1.4 (стр. 7) приведены изотермы, вычисленные по уравнению Ван-дер-Ваальса для диоксида углерода (значения констант a и b взяты из табл. 1.3). Из рисунка видно, что при температурах ниже критической (31,04 °С) вместо горизонтальных прямых, соответствующих равновесию жидкости и пара, получаются волнообразные кривые 12345 с тремя действительными корнями, из которых только два, 1 и 5, физически осуществимы. Третий корень (точка 3) физически не реален, поскольку находится на участке кривой 234, противоречащем условию стабильности термодинамической системы 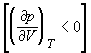
Согласно правилу Максвелла (the Maxwell construction), которое имеет теоретическое обоснование, для того, чтобы расчетная кривая соответствовала экспериментальной равновесной изотерме, нужно вместо кривой 12345 провести горизонтальную прямую 15 так, чтобы площади 1231 и 3453 были равны. Тогда ордината прямой 15 будет равна давлению насыщенного пара, а абсциссы точек 1 и 5 – мольным объемам пара и жидкости при данной температуре.
По мере повышения температуры все три корня сближаются, и при критической температуре Tc все три корня становятся равными. В критической точке изотерма Ван-дер-Ваальса имеет точку перегиба [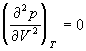
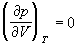
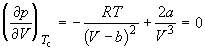
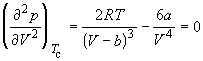
Совместное решение этих уравнений дает:
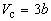
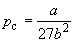
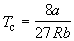
что позволяет определять константы уравнения Ван-дер-Ваальса из критических параметров газа. Соответственно, согласно уравнению Ван-дер-Ваальса, критический фактор сжимаемости Zc для всех газов должен быть равен
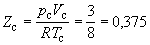
Из таблицы 1.2 видно, что хотя значение Zc для реальных газов приблизительно постоянно (0,27 – 0,30 для неполярных молекул), оно все же заметно меньше вытекающего из уравнения Ван-дер-Ваальса. Для полярных молекул наблюдается еще большее расхождение.
Принципиальное значение уравнения Ван-дер-Ваальса определяется следующими обстоятельствами:
1) уравнение было получено из модельных представлений о свойствах реальных газов и жидкостей, а не явилось результатом эмпирического подбора функции f(p,V,T), описывающей свойства реальных газов;
2) уравнение долго рассматривалось как некоторый общий вид уравнения состояния реальных газов, на основе которого было построено много других уравнений состояния (см. ниже);
3) с помощью уравнения Ван-дер-Ваальса впервые удалось описать явление перехода газа в жидкость и проанализировать критические явления. В этом отношении уравнение Ван-дер-Ваальса имеет преимущество даже перед более точными уравнениями в вириальной форме (см. 1.1, 1.2).
Причиной недостаточной точности уравнения Ван-дер-Ваальс считал ассоциацию молекул в газовой фазе, которую не удается описать, учитывая зависимость параметров a и b от объема и температуры, без использования дополнительных постоянных. После 1873 г. сам Ван-дер-Ваальс предложил еще шесть вариантов своего уравнения, последнее из которых относится к 1911 г. и содержит пять эмпирических постоянных. Две модификации уравнения (1.5) предложил Клаузиус, и обе они связаны с усложнением вида постоянной b. Больцман получил три уравнения этого типа, изменяя выражения для постоянной a. Всего известно более сотни подобных уравнений, отличающихся числом эмпирических постоянных, степенью точности и областью применимости. Выяснилось, что ни одно из уравнений состояния, содержащих менее 5 индивидуальных постоянных, не оказалось достаточно точным для описания реальных газов в широком диапазоне p, V, T, и все эти уравнения оказались непригодными в области конденсации газов. Из простых уравнений с двумя индивидуальными параметрами неплохие результаты дают уравнения Дитеричи и Бертло (см. табл. 1.4).


Сервер создается при поддержке Российского фонда фундаментальных исследований
Не разрешается копирование материалов и размещение на других Web-сайтах
Вебдизайн: Copyright (C) И. Миняйлова и В. Миняйлов
Copyright (C) Химический факультет МГУ
Написать письмо редактору
http://spravochnick.ru/fizika/molekulyarnaya_fizika/uravnenie_van-der-vaalsa/
http://www.chem.msu.su/rus/teaching/realgases/chap1(3).html