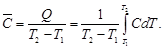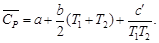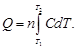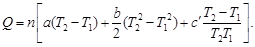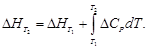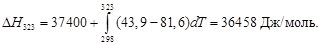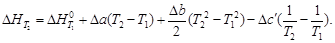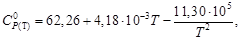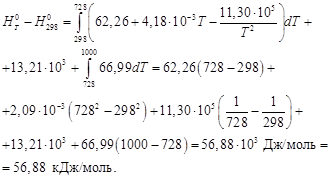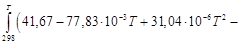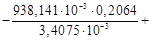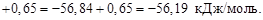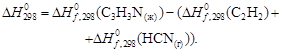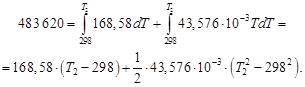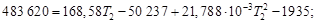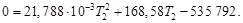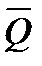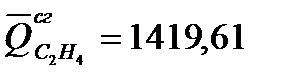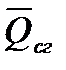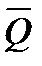Зависимость теплового эффекта от температуры. Уравнение Кирхгофа
Поскольку по закону Гесса тепловой эффект процесса (реакции) определяется начальным и конечным состоянием системы, очевидно, что для каждого из участников реакции (как исходных веществ, так и продуктов реакции) будут справедливы выражения (1.32) и (1.33). Тогда уравнение зависимости теплового эффекта реакции от температуры можно записать в виде
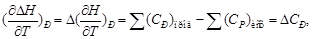
где DCP – разность молярных изобарных теплоемкостей реагентов, взятая с учетом стехиометрических коэффициентов.
Уравнение (1.36) называют уравнением Кирхгофа; оно выражает зависимость теплового эффекта реакции от температуры в дифференциальной форме. Это уравнение строго справедливо лишь при условии, что давление над каждым компонентом при искомой температуре будет таким же, как и при начальной температуре.
Из (1.36) следует, что чувствительность DH к изменению температуры определяется абсолютным значением DCP, а знак температурного коэффициента определяется знаком DCP. При DCP > 0 тепловой эффект реакции растет с повышением температуры; при DCP 2 + Dc′T – 2 + … (1.37)
Подставляя (1.37) в (1.36) и разделяя переменные, в общем виде получим
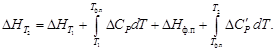
Предполагается, что в рассматриваемом интервале температур T2 ¸ T1 в системе происходит фазовое превращение (плавление, парообразование или сублимация), тепловой эффект которого DHф.п.
Интегрирование уравнения Кирхгофа можно проводить только в том случае, если известна величина 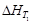
Наличие данных о стандартных тепловых эффектах образования или сгорания различных веществ значительно упрощает расчеты. Так, пользуясь величинами 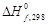
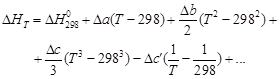
Для газов в сравнительно узком температурном интервале, а для твердых и жидких веществ в достаточно широком, можно считать DCP = const, что дает право пользоваться линейным уравнением
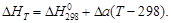
Принимая, что a » DCP,298, можно также записать
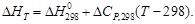
Если значение 
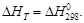
Пример 1.34.
Истинная молярная теплоемкость серебра в интервале температур от 273 до 1234 К выражается уравнением
СP = 23,97 + 5,28×10 –3 Т – 0,25×10 5 Т –2 Дж/(моль∙К).
Вычислить среднюю молярную теплоемкость 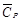
Среднюю теплоемкость в данном интервале температур рассчитывают по уравнению (1.30)
С учетом зависимости истинной теплоемкости от температуры СP = а + bT + c′ . T –2 получим выражение
Подставляя коэффициенты a, b, c′ и температуру из условия задачи, получаем
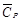
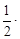
Средняя удельная теплоемкость рутила (TiO2) в интервале от 0 до t °С выражается уравнением
СP = 0,782 + 1,41∙10 –4 t – 0,557∙10 3 t –2 Дж/(г∙°С).
Рассчитать истинную удельную теплоемкость рутила при 500 °С.
Среднюю удельную теплоемкость вычисляем по уравнению (1.30) с учетом (1.34):
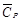
= 0,883 Дж/(г∙°С).
Определить количество теплоты, поглощенной при нагревании 1 кг корунда Al2O3 от 298 до 1000 К, если его молярная теплоемкость в интервале температур 298–1800 К выражается уравнением
СP =114,56 + 12,89·10 ─3 Т-34,31·10 5 Т ─2 Дж(моль·К).
Количество теплоты, затраченное на нагревание n моль вещества от Т1 до Т2,определяется из соотношения
Учитывая, что теплоемкость является функцией температуры, для расчета количества теплоты используем уравнение
Q = 1000/102 [114,56(1000 – 298) + ½ 12,89·10 –3 (1000 2 –
– 298 2 ) – 34,31 . 10 5 (1/298 –1/1000)] = 766 768 Дж = 766,8 кДж.
Молярная теплота испарения метилового спирта при 25 о C составляет 37,4 кДж/моль. Определить теплоту испарения метилового спирта при 50 о C, если молярная теплоемкость жидкого и газообразного метилового спирта соответственно равны 81,6 и 43,9 Дж/(моль∙К). Считать теплоемкость в интервале температур 25-50 о C практически постоянной.
Решение.
Воспользуемся уравнением Кирхгофа в интегральной форме:
T1 = 25 + 273 = 298 К, T2 = 50 + 273 = 323 К
Вычислить тепловой эффект реакции C(т)+CO2(г)=2CO(г) при 500 К, если при стандартных условиях он равен 172,5 кДж, а значения молярных теплоемкостей С, СО, СО2 соответственно следующие:
Воспользуемся уравнением Кирхгофа в интегральной форме:
Зависимость CP реагирующих веществ от температуры представлена уравнениями вида CP = a + bT + c′T –2 (для неорганических веществ), поэтому величину DСP рассчитывают по уравнению
DCP = Da + DbT +Dc′T –2 .
После подстановки в уравнение Кирхгофа и интегрирования получим
Da = 2·28,41 – 44,14 – 17,15 = -4,47,
Db = (2·4,10 – 9,04 – 4,27)10 -3 = -5,1110 –3 ,
Dc′ = [–2·0,46 – (-8,53) – (-8,79)]10 5 = 16,410 5 .
DH500 = 172,5×10 3 – 4,47×(500–298)– 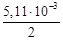
– 298 2 ) + 16,4×10 5 ( 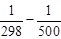
Вычислить изменение энтальпии при нагревании хлорида серебра от 298 до 1000 К при стандартном давлении и полную энтальпию хлорида серебра при 1000 К. При температуре 728 К происходит плавление хлорида серебра, ∆Нпл при температуре плавления 13,21 кДж/моль. Зависимость теплоемкости твердого хлорида серебра от температуры взять в Приложении. Теплоемкость жидкого хлорида серебра в интервале температур от 728 до 1000 К остается практически постоянной и равной 66,99 Дж/(моль·К).
По уравнению (1.38) определим теплоту нагревания хлорида серебра с учетом единственного фазового превращения в заданном интервале температур:
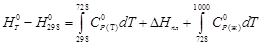
Вычисляем изменение энтальпии, справочные данные берем в приложении 12.
DН 0 = –126,8 + 56,88 = –69,92 кДж/моль.
Выразить уравнением зависимость теплового эффекта химической реакции
СН3ОН(г)+ 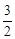
от температуры, которая справедлива в интервале 298–1000 К.
Тепловой эффект реакции в стандартных условиях 
Для получения уравнения зависимости 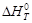
| Вещество | 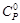 = f(T), Дж/(моль∙К) = f(T), Дж/(моль∙К) | Температурный интервал, К | |||
| а | b∙10 3 | c′∙10 ─5 | c∙10 6 | ||
| СО2(г) | 44,14 | 9,04 | –8,54 | 298–2500 | |
| Н2О(г) | 30,00 | 10,71 | 0,33 | 273–2500 | |
| СН3ОН(г) | 15,28 | 105,2 | –31,04 | 298–1000 | |
| О2(г) | 31,46 | 3,39 | –3.77 | 273–2000 | |
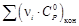 | 104,14 | 32,46 | –7,88 | 298–2500 | |
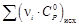 | 62,47 | 110,29 | –5,66 | –31,04 | 298–1000 |
Для данной реакции в интервале температур от 298 до 1000 К уравнение зависимости изменения теплоемкости от температуры будет иметь вид
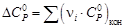
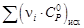
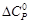
Подставляем под знак интеграла зависимость 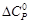
Т ≤ 1000; 
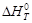

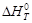
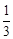

– 9,44 + 3,46 – 0,27 – 0,74)10 3 + 41,67 T – 38,91 ─3 T 2 +
+ 10,35∙10 ─6 T 3 + 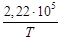
+ 41,67T – 38,91∙10 ─3 T 2 + 10,35∙10 ─6 T 3 + 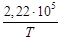
Таким образом, получено уравнение зависимости теплового эффекта реакции от температуры, справедливое в интервале температур от 298 до 1000 К:
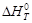
+ 10,36∙10 ─6 Т 3 + 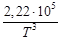
Обжиг известняка проводится при 1100 °С. Определить расход теплоты на обогрев 1 кг сырья до температуры процесса, если оно состоит в основном из карбоната кальция и поступает в печь обжига при 20 °С.
Теплоемкость известняка примем равной теплоемкости СаСО3. Значение средней молярной теплоемкости
СаСО3 рассчитаем по формуле (1.30) с учетом (1.34), значения коэффициентов а, b, c′ возьмем из приложения 12:
а = 104,52; b = 21,92∙10 ─3 ; c′ = –25,94∙10 5 .
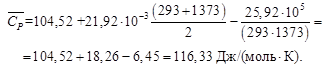
Удельная теплоемкость известняка
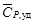
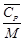
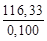
где М = 0,100 кг/моль – молярная масса СаСО3.
Тогда расход теплоты
Q = 1000∙1163,3(1373–293) = 1,259∙10 9 Дж = 1,259 ГДж.
Температура газов пиролиза на выходе из зоны реакции (плазмотрона) равна 1600 °С. Определить необходимый расход воды на закалку (быстрое охлаждение) этих газов в расчете на 1 кг, если их теплоемкость равна 4,15 кДж/(кг∙К), температура на выходе из зоны закалки 150 °С, а температура воды на входе в аппарат 20 °С и на выходе 100 °С. Теплоемкость воды 4,18 кДж/(кг∙К).
Используем уравнение теплового баланса.
Приход теплоты с реакционными газами
Qприх = 4,15(1600 – 150) = 6,02∙10 3 кДж/кг.
Расход теплоты с закалочной водой составляет
где Х – расход воды на закалку, кг.
Отсюда, согласно уравнению теплового баланса, имеем
Х = 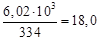
1. При экспериментальном определении энтальпии нейтрализации соляной кислоты гидроксидом натрия смешивали растворы HCl и NaOH в прецизионном калориметре, причем температура содержимого калориметра поднялась на 0,2064 °С. Количество воды, выделившееся в результате реакции, равно 3,4075 ммоль. Кроме того, электрические измерения показали, что удельная теплоемкость калориметра и его содержимого равна 938,141 Дж∙°С ─1 . Вычислить энтальпию нейтрализации на 1 моль соляной кислоты. Необходимо ввести поправку (+649,45 Дж) на 1 моль образовавшейся в конце процесса Н2О к энтальпии смешения растворов HCl и NaOH до того, как прошла реакция.
2. В другом опыте те же исследователи установили, что энтальпия нейтрализации HClO4 в пределах ошибки эксперимента та же, что и для HCl. Однако энтальпия нейтрализации уксусной кислоты гидроксидом натрия равна
–55,727 кДж/моль. Как объяснить тот факт, что энтальпии нейтрализации HCl и HClO4 одинаковы, но отличаются от энтальпии нейтрализации уксусной кислоты?
1. ∆Н = (СР∆Т/ число молей образовавшейся Н2О) + + поправка =
2. HCl и HClO4 – сильные кислоты, они полностью диссоциируют. Разница между наблюдаемыми энтальпиями равна энтальпии диссоциации уксусной кислоты.
Определить тепловой режим реактора синтеза акрилонитрила, если процесс в нем описывается уравнением
а производительность реактора равна 800 кг акрилонитрила в час. Рассчитать расход воды на охлаждение этого реактора, если она подается в аппарат при 18 °С и отводится из него при 82 °С. Теплоемкость воды 4180 Дж/(кг·К).
Температура процесса (82 °С) в данном случае достаточно близка к стандартной (25 °С), поэтому тепловой эффект рассматриваемой реакции можно принять равным стандартному тепловому эффекту и рассчитывать по стандартным теплотам образования реагирующих веществ:
| Вещество, агрегатное состояние | 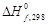 , кДж/моль , кДж/моль |
| С3Н3N(ж), акрилонитрил | 184,93 |
| С2Н2(г), ацетилен | 226,75 |
| НСN(г), циановодород | 132,00 |
Подставив значения в уравнение, получим

За один пробег реакции образуется 1 моль (0,053 кг) продукта; следовательно, значение теплоты Qуд в расчете на 1кг продукта будет состпвлять
Qуд = 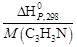
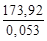
Следовательно, для обеспечения нормальной работы рассматриваемого реактора от него необходимо отводить теплоту:
Необходимый для этого расход охлаждающей воды в реактор
mв = 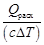
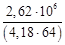
здесь с – удельная теплоемкость воды; ∆Т – повышение температуры воды при прохождении через аппарат,
∆Т = 82 – 18 = 64 °С.
В теплообменнике, питаемом водой, при нормальном давлении конденсируются пары этанола. Определить расход воды, если производительность аппарата 350 кг/ч этанола, температура воды на входе в аппарат 15 °С, на выходе из него 35 °С, а температура выходящего из аппарата этанола 53 °С. Теплоемкость воды равна 4,184 кДж/(кг∙К). Нормальная теплота испарения этанола Qисп = 42,18 кДж/моль.
Воспользуемся уравнением теплового баланса. Приход теплоты в аппарат происходит:
1) за счет конденсации паров этанола:
Qконд = 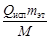
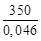
2) за счет остывания сконденсированного этанола от Ткип до 53 °С:
Qост = Сm (Ткип – 53) 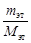
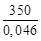
где Сm – молярная теплоемкость этанола, Сm = 111,96 Дж/(моль·К); Мэт – молярная масса этанола, кг/моль.
Расход теплоты из аппарата происходит за счет нагревания воды:
где mв – расход воды в аппарате, кг/ч.
Согласно уравнению теплового баланса имеем
= 3,209∙10 5 + 2,130∙10 4 = 3,422∙10 5 = mв∙83,68 кДж/ч.
mв= 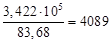
Определить максимально возможную температуру продуктов сгорания 2 объемных частей газообразного водорода и 5 объемных частей воздуха (20 об. % кислорода и 80 об. % азота), если температура зажигания равна 25 °С. Какое заключение можно сделать о полученном выражении для теплоемкости 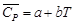
Воспользуемся справочными данными (см. приложение 12):
| Вещество | 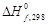 Дж/(моль∙К) Дж/(моль∙К) | a | b∙10 ─3 |
| H2(г) | – | 29,108 | –0,838 |
| O2(г) | – | 25,538 | 13,630 |
| N2(г) | – | 27,021 | 5,920 |
| H2O(г) | –241,81 | 30,247 | 9,834 |
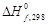
Таким образом, 483,62 кДж нагревают 2 моль Н2О(г) и 4 моль N2(г) от температуры 298 Кдо конечной температуры Т2.
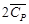
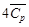
Решая квадратное уравнение и пренебрегая отрицательным корнем, получим Т2 = 2425 К. Этот результат справедлив, только если уравнение для средней теплоемкости применимо в интервале температур от 298 до 2425 К. При более высоких температурах результаты будут ошибочными.
При получении синтез-газа из гексана основная реакция идет по уравнению
Пренебрегая побочными явлениями, определить тепловой эффект процесса, если он протекает при 1350 °С в реакторе производительностью 2,50 т/ч синтез-газа состава СО : Н2 = 6 : 7 (по объему).
По закону Кирхгофа рассчитываем тепловой эффект реакции. Так как средние теплоемкости компонентов системы в заданном интервале температур (до 1623 К) не приводятся, то задачу решаем, пользуясь уравнением (1.39). Для этого воспользуемся справочными данными из приложения 12:
| Компонент i | νi | 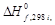 кДж/моль кДж/моль | ai | bi ∙10 3 | ci ∙10 6 | 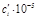 |
| С6Н14(г) | –176,19 | 8,66 | 505,85 | –184,43 | – | |
| О2(г) | 0,00 | 31,46 | 3,39 | – | 3,77 | |
| СО(г) | –110,53 | 29,41 | 4,10 | – | –0,46 | |
| Н2(г) | 0,00 | 27,28 | 3,26 | – | 0,50 | |
| Δ | –495,99 | 258,38 | –468,60 | 184,43 | –10,57 |
Проведем расчет стандартного теплового эффекта реакции ( 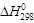
ΔН 0 Т = –495,99∙10 3 + 258,38(1623 – 298) +
+ 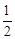
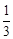
–298 3 ) + (–10,53∙10 5 )( 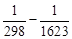
= –4,9170∙10 5 Дж/пробег = –491,70 кДж/пробег.
В результате одного пробега реакции образуется 6 моль СО и 7 моль Н2. Это составляет: m = 6∙0,028 + 7∙0,002 = = 0,182 кг синтез-газа указанного в условиях задачи состава. При образовании 1 кг такого газа в реакторе выделяется теплота Qуд:
Qуд = 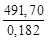
Следовательно, для нормальной работы рассматриваемой установки необходимо предусмотреть отведение тепла от реактора в количестве
Q = 2,702∙10 3 ∙2,50∙10 3 = 6,755∙10 6 кДж/ч = 1876 кВт.
Не нашли, что искали? Воспользуйтесь поиском:
Конспект лекций для бакалавров по направлению «металлургия» профиль «Технология литейных процессов»
Федеральное агентство по образованию РФ
Московский государственный институт стали и сплавов
для бакалавров по направлению «МЕТАЛЛУРГИЯ»
профиль «Технология литейных процессов»
Физическая химия, как показывает само название этой дисциплины, охватывает проблемы, находящиеся в пограничной области между физикой и химией.
Известно, что химические процессы, связанные с превращением веществ, сопровождаются и инициируются физическими.
Предметом физической химии является взаимосвязь химических и физических явлений.
Проблемы, решаемые ФХ:
Влияние физических параметров на химические превращения;
Влияние химического состава на физические свойства систем.
Методы решения этих проблем:
Круг конкретных практических задач, решаемых этими методами:
Вопросы скоростей процессов, лежащие в основе интенсификации и автоматизации технологических процессов.
Проблема получения материалов с заданными свойствами
Теоретической основой всего этого является физическая химия.
Традиционные, классические металлургия и металловедение непосредственно опираются на физическую химию, обосновывающую теорию химических процессов в металлургических агрегатах, позволяющую рассчитывать скорости этих процессов и определить пути их интенсификации.
Основные понятия термодинамики
Термодинамическая система – материальный объект, выделенный из внешней среды с помощью реально существующей или воображаемой граничной поверхности и способный обмениваться с другими телами энергией и (или) веществом.
Гомогенные – физически однородные системы, имеющие одинаковые физические свойства во всех своих частях;
Гетерогенные – системы, состоящие из нескольких однородных частей с разными физическими свойствами;
Изолированные, в которых нет обмена с окружением ни энергией, ни веществом.
Любая термодинамическая система является моделью реального объекта.
Состояние системы – совокупность физических и химических свойств, характеризующих систему.
Состояние термодинамической системы характеризуется термодинамическими параметрами. К ним относятся T, p, V, концентрации.
Термодинамическое равновесие – это такое состояние, в которое приходит система при неизменных внешних условиях, т.е. т/д параметрах.
Частные случаи т/д равновесия:
3. Термодинамический процесс. Если параметры, характеризующие состояние системы (p, T, V) меняются, то в системе будет протекать т/д процесс.
самопроизвольные, для осуществления которых не надо затрачивать энергию;
не самопроизвольные, происходящие только при затрате энергии;
обратимые, когда переход системы из одного состояния в другое и обратно может происходить через последовательность одних и тех же состояний, и после возвращения в исходное состояние ни в системе, ни в среде не остается никаких изменений.
равновесные, которые происходят под действием бесконечно малых изменений внешних параметров.
Термодинамические функции разделяют на:
Функции состояния зависят только от состояния системы и не зависят от пути по которому это состояние получено.
Примеры функций состояния:
U – внутренняя энергия;
F – энергия Гельмгольца;
G – энергия Гиббса;
Термодинамические переменные – объем V, давление p, температуру T – также можно считать функциями состояния, т.к. они однозначно определяют состояние системы
Функции перехода. Их значение зависит от пути, по которому происходит изменение системы.
Примеры функций перехода:
Математические свойства функций состояния и функций перехода различны.
Функции состояния характеризуются следующими свойствами:
бесконечно малое изменение функции состояния является полным дифференциалом

изменение функции состояния при переходе из состояния 1 в состояние 2 определяется только этими состояниями
Все выводы и соотношения термодинамики можно сформулировать на основании двух постулатов и трех законов.
Любая изолированная система с течением времени приходит в равновесное состояние и самопроизвольно не может из него выйти.
Самопроизвольный переход системы из неравновесного состояния в равновесное называется релаксацией.
Основной постулат ничего не говорит о времени релаксации.
В классической термодинамике вообще нет понятия времени.
Мы ознакомились с
значением физической химии для металлургии
основными понятиями термодинамики
Первый закон термодинамики.
Применение к различным процессам в идеальном газе
Формулировка I закона
Дифференциальная и интегральная формы записи закона
Применение I закона к различным процессам
Q – одна из форм передачи энергии. Связана с неупорядоченным движением молекул
W – другая форма передачи энергии. Связана с упорядоченным (организованным) движением молекул
В химической т/д рассматривается только работа расширения
Для элементарного процесса
Работа всего процесса
U – совокупность всех видов внутреннего движения системы
Для идеального газа —
Идеальный газ – газ, взаимодействием между молекулами которого и размерами молекул можно пренебречь.
Тепло, сообщаемое системе, расходуется на изменение внутренней энергии и работу, совершаемую системой.
Математическая запись I закона

Используется для процесса между двумя конечными состояниями системы

Используется для элементарного процесса, т.е. для процесса между двумя бесконечно близкими состояниями системы.
Комментарий 1. Ни теплота, ни работа (каждая в отдельности) не являются функциями состояний



Комментарий 2. Первый закон т/д связан с именами:
Майер Роберт Юлиус
Гельмгольц Герман Людвиг Фердинанд
Джоуль Джеймс Прескотт
Правило знаков в термодинамике
Работа W считается положительной , если система сама совершает работу над окружающими телами.
Теплоту Q принято считать положительной , если система получает тепло, и отрицательной , если система отдает тепло.
Приложения I закона к различным процессам
Изохорный процесс. Система – идеальный газ


Тепло, сообщаемое системе при 
Изобарный процесс. Система – идеальный газ
Обозначим 

Тепло, сообщаемое системе при изобарном процессе, расходуется на изменение энтальпии системы.
Для процесса между конечными состояниями системы
Работа при изобарном процессе
Теплоемкость системы при изобарном процессе
Получим уравнение зависимости энтальпии индивидуального вещества от температуры
Уравнение связи теплоемкостей 

Изотермический процесс. Система – идеальный газ

Оценим величину работы при изотермическом процессе


Тепло, сообщаемое системе при изотермическом процессе, расходуется на работу, совершаемую системой
Адиабатный процесс. Система – идеальный газ

При этом процессе вся работа совершается за счет убыли внутренней энергии системы
Без вывода (см. [2] стр. 15-16)

Отступление. О теплоемкости.
Теплоемкость системы – количество теплоты необходимое для нагревания данной массы вещества на 1 К





Истинной мольной теплоемкостью называют отношение бесконечно малого количества теплоты, которое нужно сообщить 1 молю вещества, к бесконечно малому приращению температуры, которое при этом наблюдается
Средней мольной теплоемкостью 


Связь средней и истинной теплоемкости
с другой стороны
Количество тепла, необходимое для нагревания тела будет одним и тем же
2 г воздуха изобарно нагревают от 






=
Истинная мольная теплоемкость оксида кальция выражается уравнением:
Определить количество тепла, необходимого для нагревания 10 кг СаО от 0 до 900°С

=
При расчетах необходимо учитывать, что:
Все уравнения термодинамики относятся к 1 молю вещества.
Температура – только по шкале Кельвина.
формулировка и математическая запись (в интегральной и дифференциальной формах) I закона термодинамики;
интерпретация закона применительно к различным процессам в идеальном газе.
получен ряд новых соотношений, вытекающих из I закона
связь теплоемкостей 
зависимость энтальпии индивидуального вещества от температуры
Основные определения и комментарии к ним;
Теоретическое обоснование закона Гесса
Методы расчета теплот химических реакций
Таблицы стандартных термодинамических величин
Тепловым эффектом химической реакции называется количество теплоты, которое выделяется или поглощается при полном протекании реакции. При этом температуры исходных веществ и продуктов реакции должны быть одинаковы






Связь величин 



для процесса при
если 


Термодинамическое обоснование закона Гесса
1.
2.
1.
Докажем, что тепловой эффект реакции не зависит от пути процесса; другими словами, он будет одним и тем же независимо от того, осуществляется ли реакция непосредственно или через несколько стадий

т.к. энтальпия есть функция состояния, то и тепловой эффект тоже будет функцией состояния, т.е. не будет зависеть от пути процесса.
1.
2.
Закон Гесса – математическое следствие I закона термодинамики
Методы расчета теплот химических реакций:
Метод комбинирования термохимических уравнений
Метод, основанный на следствии из закона Гесса, оперирующий энтальпиями (теплотами образования веществ)
Метод, основанный на следствии из закона Гесса, использующий теплоты сгорания веществ. В металлургической практике не используется.
Метод комбинирования термохимических уравнений
I
II
III
IV
III=I-II
IV=I-2(II)
Теплоты всех реакций должны относиться к одним и тем же условиям.
Следствие из закона Гесса
Энтальпия реакции равна разности между суммой энтальпий образования продуктов реакции и суммой энтальпий образования исходных веществ
Для произвольной химической реакции
Энтальпией образования вещества называется тепловой эффект реакции образования 

Измерена при 

Энтальпии образования простых веществ приняты равными нулю
За нуль принята энтальпия образования модификации, устойчивой при стандартных условиях
Первый и второй закон термодинамики. Термохимия
Теплоемкость веществ
Мерой теплоемкости является количество теплоты, выражаемое в джоулях и поглощаемое веществом при нагревании на 1 К. различают массовую, молярную и объемную теплоемкости веществ.
Массовая теплоемкость с представляет собой количество теплоты, необходимое для нагревания 1 кг вещества на один градус [кДж/(кг ∙ К)].
Под молярной теплоемкостью С понимают количество теплоты, необходимое для нагревания одного киломоля вещества на один градус [кДж/(кмоль ∙ К)]. Молярная и массовая теплоемкости связаны соотношением С = сМ.
Объемная теплоемкость с´ равна количеству теплоты, которое необходимо для нагревания на один градус массы вещества, заключенной в 1 м 3 газа при н. у. [кДж/(м 3 ∙ К)]. Массовая, объемная и молярная теплоемкости связаны между собой соотношениями:
У газов различают теплоемкость при постоянном объеме (изохорную) Сυ, сυ и при постоянном давлении (изобарную) Ср, ср; Ср>Сυ и ср>сυ на величину работы расширения
Для 1 кмоль идеального газа при нагревании его на 1º С при р = constA = R= 8,314 кДж(кмоль ∙ К). Следовательно,
Теплоемкость газов растет с повышением температуры. Исключение составляют лишь одноатомные газы (He, Ne, Arи др.), теплоемкость которых не зависит от температуры. В тепловых расчетах используют или истинные теплоемкости Сист, сист, т. е. теплоемкости веществ при данной температуре, или средней теплоемкости 
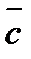
Когда средняя теплоемкость

Истинная теплоемкость Сист является пределом средней теплоемкости, когда разность температур Т2 – Т1 становится бесконечно малой величиной ∆Т:
При расчетах тепловых балансов производственных процессов, как правило, пользуются таблицами величинами средних теплоемкостей веществ от 0 до tº C. Точное значение средней теплоемкости для любых пределов температуры вычисляют, используя математическую зависимость истиной теплоемкости (массовой, молярной и др.) от температуры. Эта зависимость выражается степенными рядами двух видов:
Сист = 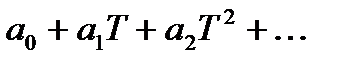
Сист = 
где 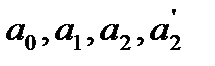
При расчетах обычно ограничиваются двумя-тремя членами этих рядов. Из формулы вытекает dQ=СистdТ. При повышении температуры от Т1 до Т2 количество поглощаемой теплоты вычисляют интегрированием:Q = 
Q = 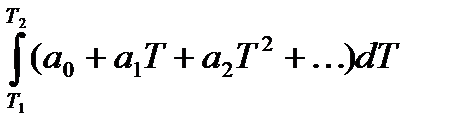
Из формулы можно определить то же количество теплоты Q, учитывая среднюю теплоемкость 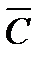
Q = 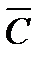
Приравняв правые части равенств и получим
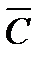
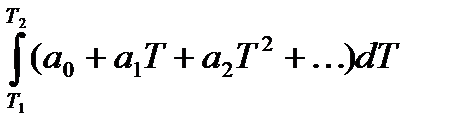
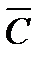

При интегрировании с учетом степенного ряда получим
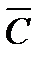
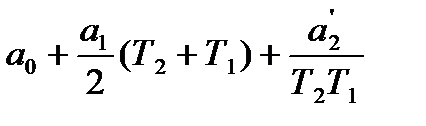
Для определения истиной теплоемкости по средней в пределах от 0 до Т необходимо умножить среднюю теплоемкость на Т и продифференцировать по Т:
Сист = (d/dT)( 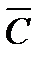
Если температура выражена в градусах Цельсия, то это уравнение записывают так:
Сист = (d/dT)( 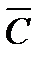
Теплоемкость газовых смесей суспензий, эмульсий, если между их составными частями не наблюдается химическое взаимодействие, является аддитивной величиной и для расчетов можно использовать формулу правила смешения
Ссмеси =
Ссмеси = 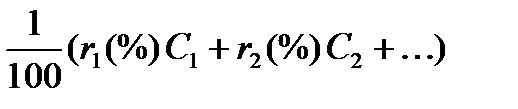
где т1(%)т2 (%), … — содержание компонентов в смеси в масс. долях (%); с1, с2, … — массовые теплоемкости соответствующих веществ; r1(%), r2(%), … — молярные (а для газов то же, что и объемные) доли (%) составных частей смеси; С1, С2, … — молярные теплоемкости. Влияние температуры на теплоемкость жидкостей и твердых веществ сказывается в меньшей степени, чем для газов (наблюдается незначительный рост теплоемкости жидкостей с повышением температуры). Теплоемкость твердых веществ при высоких температурах почти не изменяется. При низких температурах теплоемкость твердых веществ меняется очень сильно, приближаясь к нулю при температурах, близких к абсолютному нулю. Теплоемкость твердых веществ можно вычислять по эмпирической формуле, согласно которой теплоемкость твердых химических соединений равна алгебраической сумме теплоемкостей элементов, входящих в данное соединение:
где Свещ — теплоемкость твердого вещества; n – доля элемента, входящего в данное вещество; Ci – теплоемкость данного элемента в соединении. Формула пригодна для подсчета теплоемкостей сплавов. Теплоемкость растворов с повышением их концентрации в большинстве случаев падает и не подчиняется строго правилу аддитивности. Однако достаточно точно теплоемкость растворов в пределах концентраций до 40 – 50% можно определять по правилу смешения (аналогично газовым смесям). При растворении кислот и щелочей в воде наблюдаются глубокие физико-химические изменения и расчет теплоемкостей по правилу смешения допустим только при небольших концентрациях. Для определения теплоемкостей растворов кислот, щелочей и солей при различных концентрациях пользуются графиками в координатах теплоемкость – концентрация раствора, построенными по опытным данным.
Пример 1.Определить теплоту, которую отдадут 100 кг паров метилового спирта при охлаждении от 200 до 100º С при нормальном давлении.
Р е ш е н и е. Количество выделяемой теплоты можно рассчитать двумя способами: 1) использовать значение средней (массовой) теплоемкости между 200 и 100º С (с учетом массы паров спирта); 2) определив среднюю массовую теплоемкость паров метилового спирта от 0 до 200 и от 0 до 100º С. Подсчитав относительные количества теплоты при t1 = 200ºC и при t2 = 100º С (с учетом массы паров), вычитают одно из другого. Воспользуемся вариантом 2. Из таблицы находим для СН3ОН среднее молярные теплоемкости при нормальном давление: 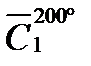
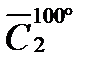
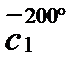


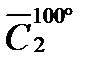
Q = 100 ( 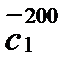
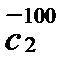
Пример 2.Определить теплоту, поглощающую при нагревании 100 г диоксида углерода от 15 до 100º С при постоянное объеме, если

Р е ш е н и е. Температуру можно взять в градусах Цельсия:
Q = 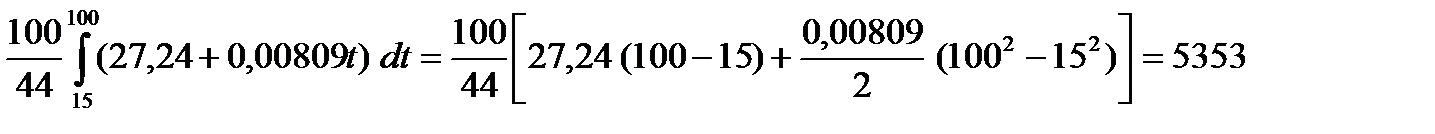
Пример 3.Рассчитать среднюю молярную теплоемкость водорода в интервале 400 — 500º С, если
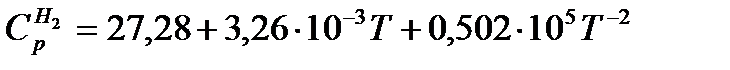
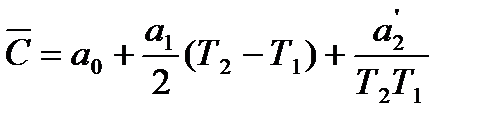
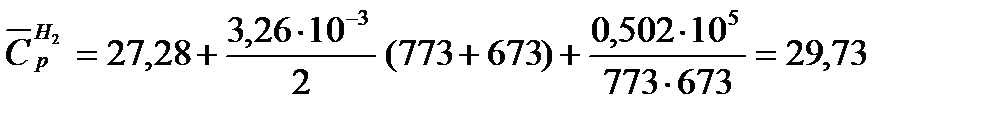
Пример 4.Вычислить массовую теплоемкость сплава состава (масс. доля, %): Bi 50,7; Pb 25,0; Cd 10,1; Sn 14,2 , если 
Р е ш е н и е. Вычисляем массовую теплоемкость:
ср = 0,507 ∙ 0,122 + 0,25 ∙ 0,129 + 0,101 ∙ 0,231 + 0,142 ∙ 0,221 = 0,148 кДж / (кг ∙ К).
31. Средняя массовая теплоемкость паров бензола в пределах температур 85 — 115º С (при нормальном атмосферном давлении) равна 1,257 кДж/(кг ∙ К). вычислить среднее молярные теплоемкости бензола при постоянных давлении и объеме и их соотношение 
32. Средняя массовая теплоемкость при постоянном (нормальном) давлении для водяного пара в пределах температур 100 — 500º С равна 2,01 кДж/(кг ∙ К). вычислить средние молярные теплоемкости водяного пара при постоянных давлении и объеме и их соотношение 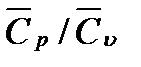
33. Температурная зависимость истинной молярной теплоемкости воздуха выражается уравнением
Вычислить: а) истинную молярную и массовую теплоемкости воздуха при постоянных давлении и объеме при 400º С, если соотношение 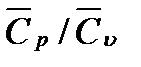
34. Молярная теплоемкость азота при н. у. равна 20,95 кДж / (кмоль ∙К). определить массовую и объемную теплоемкости азота при тех же условиях.
35. Зависимость молярной теплоемкости паров ацетона от температуры выражается уравнением
Ср= 31,59 + 154,94 ∙ 10 -3 Т – 30,38 ∙ 10 -6 Т 2 .
Вычислить расход теплоты (Дж) на нагревание 116,2 г ацетона от 298 до 500 К.
36. Вычислить количество поглощенной теплоты (кДж) при нагревании 1 кг этилового спирта от 127 до 327º С (при постоянном давлении) , если температурная зависимость истиной молярной теплоемкости [кДж/(кмоль ∙ К)] выражается формулой
37. Вычислить количество выделившейся теплоты при изобарного охлаждении 100 кг формальдегида от 500 до 200º С, если температурная зависимость молярной теплоемкости[кДж/(кмоль ∙ К)]выражается уравнением
38. Какое количество теплоты потребуется для нагревания 10 кг паров изопрена от 127 до 227º С при нормальном давлении если температурная зависимость истиной молярной теплоемкости [кДж/(кмоль ∙ К)] выражается формулой
39. Определить массовую теплоемкость железной руды состава (об. доли, %);Fe2O3 84,1; H2O 7,5; SiO2и пустая порода 8,4. Массовые теплоемкости [кДж/(кг ∙ К)] компонентов руды соответственно равны 0,610; 4,2; 1,17
40. Рассчитать массовую теплоемкость сплава, состоящего из 80% меди и 20% олова при 25º С. Средняя массовая теплоемкость меди в интервале 20 — 100º С равна 0,394 кДж/(кг ∙ К), а олова в интервале 19 — 99º С 0,231 кДж/(кг ∙ К). сравнить полученный результат с табличным: С = 0,3606кДж/(кг ∙ К).
Термохимия. Закон Гесса
Тепловым эффектом химической реакции называется теплота, выделения или поглощения в процессе, протекающем необратимо при постоянстве объема или давления (продукты реакции при этом имеют ту же температуру, что и исходные вещества). В термохимии (в отличие от термодинамики) выделяемая системой теплота считается положительной, а поглощаемая – отрицательной. Теплоту в термодинамическом понимании обозначают 

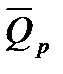

т.е. изохорный тепловой эффект химической реакции равен убыли внутренней энергии реагирующей системы. Изобарный тепловой эффект равен убыли энтальпии реагирующих веществ:
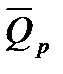
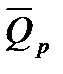

Формула позволяет по величине 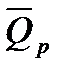

В термодинамических расчетах широко используют следующие два следствия закона Гесса:
1.Тепловой эффект химической реакции равен разности между суммой теплот образования продуктов( 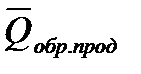
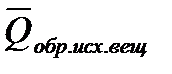
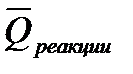
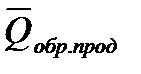
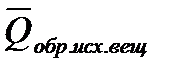
2. Тепловой эффект химической реакции равен разности между суммой теплот сгорания исходных веществ ( 

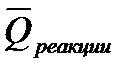
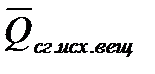

Закон Гесса и следствия (1,2) позволяют вычислять тепловые эффекты различных реакций на основе сравнительно небольшого количества табличных данных о теплотах образования неограниченных веществ и теплотах сгорания органических соединений при стандартных условиях (р = 101 325 Па, t = 25ºCили 298 К). Поскольку расчеты в химии и химической технологии чаще всего приходится производить для изобарных процессов, то можно использовать табличные значения 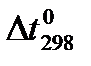

Для простых веществ условно 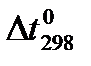
В основе расчетов тепловых эффектов по энергиям связей атомов, входящих в состав данного химического соединения, лежат следующие положения:
1) каждая определенная связь между атомами имеет более или менее постоянную энергию независимо от того, в какое химическое соединение эти атомы входят;
2) атомные связи обладают свойством аддитивности, т. е. энергия образования молекулы из свободных атомов в газообразном состоянии приблизительно равна сумме энергий связей отдельных ее частиц. Теплоты образования, вычисления по энергиям связи атомов в молекуле, в ряде случаев не совпадают с действительными данными, так как не всегда соблюдается аддитивность свойств энергии связей. Тепловое растворение ( 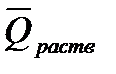
По интегральной теплотой растворения понимают теплоту растворения 1 моль вещества в большом количестве растворителя (число молей растворителя п→∞). при измерении 
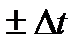

где т – масса раствора, т = G + g; М – молекулярная масса растворяемого вещества; ср искал– теплоемкости раствора и калориметра. Для вычисления теплоты растворения 1 моль минеральной кислоты в п моль воды пользуются эмпирическими формулами:

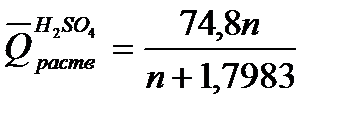
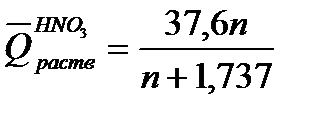
Теплотой сгорания называется теплота (кДж), выделяющаяся при полном сгорании 1 моль вещества в токе кислорода. Теплоты сгорания веществ определяют калориметрически или приближенно рассчитывают по формуле Д. П. Коновалова:
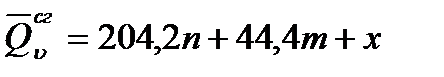
где п – число атомов кислорода, необходимых для полного сгорания одного моля данного вещества (по уравнению реакции); т – число молей воды, образующихся при сгорании (по уравнению реакции); х – термическая характеристика – величина постоянная для всех членов одного гомологического ряда. Чем больше в соединении непредельных связей, тем больше х. Если в молекулу входят различные группы и типы связей, то термическую характеристику определяют суммированием (∑х).
Пример 1.Определить теплоту сгорания этилена
С2Н4 + 3О2 = 2СО2 + 2Н2О(ж) +
исходя из следующих данных:
Р е ш е н и е. В данном случае можно воспользоваться двумя методами.
1-й метод.Комбинируя заданные термохимические уравнения, исключаем водород и углерод, которые не участвуют в реакции горения этилена.
Сгр + О2 = СО2 + 787,8
Полученный результат складываем почленно, предварительно умножив его на 2:
2-й метод. Применяем 1-е следствие Гесса, поскольку все приведенные в условии задачи тепловые эффекты являются теплотами образования соответственно этилена, диоксида углерода и жидкой воды из простых веществ: графита, водорода и кислорода:
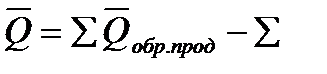

Пример 2.Рассчитать тепловой эффект сгорания диэтилового эфира (С2Н5)2О по энергиям разрыва связей при 298 К. Теплота испарения эфира 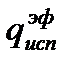
Р е ш е н и е. Реакция горения диэтилового эфира протекает по уравнению
Н—С—С—О—С—С—Н(ж) + 6О2 = СО2 + 5Н2О(ж) +
Тепловой эффект реакции равен разности теплот испарения и энергий разрыва связей продуктов реакции и исходных веществ. В молекуле эфира имеются связи: 10 С – Н, 2 С — С и 2 С – О. Находим энергии отдельных связей и вычисляем 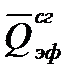
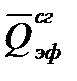
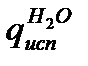
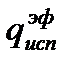
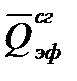
Пример 3.Какое количество теплоты выделится при растворении 200 г моногидрата Н2SO4 в 350 см 3 воды?
Р е ш е н и е. Для вычисления 
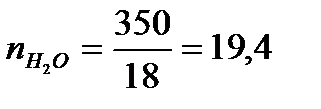
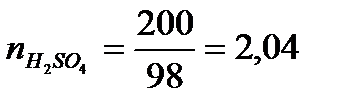
На 1 моль Н2SO4приходится 19,4 : 2,04 = 9,50 моль Н2О

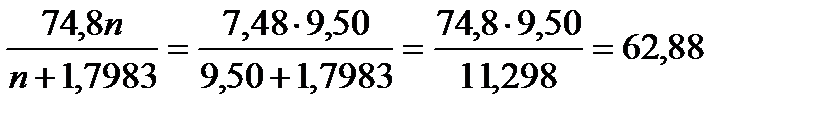
При растворении 200 г Н2SO4в 350 м 3 воды выделится теплоты
q = 62,88 ∙ 2,04 = 128,28кДж.
Пример 4.Вычислить теплоту сгорания газообразного гексана 
Р е ш е н и е. Горение гексана в калориметрической бомбе протекает постоянном объеме по уравнению
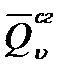
Для предельных углеводородов х = 0. При горении горении гексана п = 19, а т= 7. Тогда
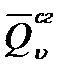
Значение 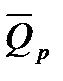
При подсчете ∆п учитываем только газообразные вещества:
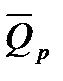
Табличная величина 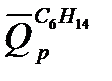
41. Определить теплоту сгорания спирта
С2Н5ОН + 3О2 = 2СО2 + 3Н2О(ж) +
исходя из следующих данных:
Н2 + 
2С + 3Н2 + 
42. Вычислить теплоту образования бензола
6С + 3Н2 = С6Н6 +
если теплоты сгорания водорода, углерода и бензола соответственно равны (кДж/моль) 285,0; 394,0; 3282,4 (вода образуется в жидкой состоянии).
43. Определить количество теплоты, выделяющейся при гашении 500 кг извести водой, если
Са + 
Н2 + 
44. Определить, какое количество теплоты потребуется для образования 100 г уксусноэтилового эфира по уравнению реакции
С2Н5ОН + СН3СООН → СН3СООС2Н5 + Н2О
если теплоты сгорания этилового спирта, уксусной кислоты и уксусноэтилового эфира соответственно равны 1374; 871,6 и 2256 кДж/моль.
45. Какое количество теплоты выделится при растворении 50 г моногидрата серной кислоты в 100 см 3 воды?
46. Какое количество теплоты выделится при растворении 200 г 38%-ной соляной кислоты в 400 см 3 воды?
47. Какое количество теплоты выделится при растворении 100 г 67%-ной азотной кислоты в 150 см 3 воды?
48. Вычислить по формуле Д. П. Коновалова теплоту сгорания жидкого этилового спирта и сравнить с табличным значением 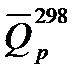
49. Вычислить по формуле Д. П. Коноваловатеплоту сгорания 
С6Н5—СН=СН—С + 21,2О2 = 9СО2 + 4Н2О +
и сравнить полученную величину с табличной — 4729кДж/моль.
http://refdb.ru/look/1580336.html
http://lektsia.com/2x34f7.html