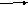Химия 9 класс Рабочая тетрадь Еремина — Еремин
а) NaCl; в) AlClg; б) MgClg; г) Al2(S04)g. Ш §11 Сильные и слабые электролиты 1. Формулы только сильных электролитов представлены в ряду: а) СаСОд, HNOg, LiCl; в) НС1, CUSO4, NagSiOg; б) BaClg, КОН, HgS; г) AgNOg, Fe(OH)g, COg. 2. Формулы только слабых электролитов представлены в ряду: А] а) Mg(OH)g, HgS04, HgO; б) HgCOg, Cu(OH)g, AgCl; в) KNOg, Alg(S04)g, Ba(OH)g; г) HgS, Zn(OH)g, KgSOg. 3. Напишите уравнения электролитической диссоциации веществ, формулы которых: а) НС1 б) HF в) HgS04 40 г) 2NaOH д) 3K2SO4. ; е) CaS04. ; ж) 2Ге(КОз)з ————————— ; з) Сиз(Р04)2. 4. Расположите формулы — Са(ОН)2» КОН, Ва(ОН)2, Ре(ОН)з — в ряд по возрастанию количества гидроксид-анионов, образующихся при диссоциации 1 моль каждого из веществ. Ответ подтвердите уравнениями электролитической диссоциации. 5. Заполните схему 7. Степень электролитической диссоциации Схема 7 41 6. Чему равна степень диссоциации электролита, если из каждых двухсот его молекул на ионы распались 40? Какой это электролит? 7. Угольная кислота — это слабая кислота, степень её диссоциации по первой ступени составляет 0,21% . Рассчитайте количество вещества катионов водорода, образующихся в растворе при диссоциации 6,2 г угольной кислоты. 8. Рассчитайте число ионов, образовавшихся при растворении в воде 0,01 моль уксусной кислоты, формула которой СНдСООН, если степень электролитической диссоциации кислоты равна 2%. 42 9*. Вы знаете, что дистиллированная вода не проводит электрический ток. Как вы можете объяснить наблюдение, сделанное немецким физикохимиком Ф. Кольраушем: электропроводность воды, оставленной в открытой платиновой чашке, повышается в 2 раза через 6 часов? Ш § 12 К ислотность среды. Водородный показатель 1. Заполните таблицу 8. Окраска индикаторов в различных средах Таблица 8 СООТНОШЕНИЕ ИОНОВ В РАСТВОРЕ ЗНАЧЕНИЕ pH ОКРАСКА ИНДИКАТОРА ФЕНОЛФТАЛЕИН МЕТИЛОРАНЖ ЛАКМУС v(H^)>v(OH-) v(OH-)>v(H^) v(H^) = v(OH-) 2. Верны ли следуюш;ие суждения? А. Кислую среду от нейтральной нельзя отличить с помош,ью фенолфталеина. 43 Б. В нейтральной среде количество вещества катионов водорода равно 10“^ моль. 1) Верно только А; 2) верно только Б; 3) верны оба суждения; 4) оба суждения неверны. 3. К растворам, содержащим: а) 0,01 моль соляной кислоты; б) 0,01 моль уксусной кислоты, добавили растворы, содержащие по 0,01 моль гидроксида натрия. Укажите pH (pH > 7,0, pH _____-Ь 3) Плавиковая кислота + щёлочь —> + 4) Серная кислота + нерастворимое в воде основание -> —> . _ . _+ . 5) Фосфорная кислота + соль — . + 2. Проанализируйте данные таблицы 10, в которой систематизированы сведения по химическим свойствам оснований: в клетках указаны реагенты и продукты взаимодействия оснований с различными веществами. Составьте уравнения химических реакций (молекулярные, полные и сокращённые 46 ионные), конкретизируюш;ие свойства оснований, перечисленные в таблице 10. Таблица 10 Химические свойства оснований № п/ п РЕАГЕНТ РЕЗУЛЬТАТ ВЗАИМОДЕЙСТВИЯ РЕАГЕНТА С ЩЕЛОЧАМИ С НЕРАСТВОРИМЫМИ ОСНОВАНИЯМИ 1 Растворы кислот а) Соль и вода б) Растворимая соль и вода 2 Оксиды неметаллов Соль и вода — 3 Растворы солей Нерастворимая соль и щёлочь или растворимая соль и нерастворимое основание 1)а) б) 2) 3) 47 3. Проанализируйте данные таблицы 11, в которой систематизированы сведения по химическим свойствам солей: в клетках указаны реагенты и продукты взаимодействия солей с различными веществами. Составьте уравнения химических реакций (молекулярные, полные и сокращённые ионные), конкретизирующие свойства солей, перечисленные в таблице 11. Таблица 11 Химические свойства солей № п/п РЕАГЕНТ РЕЗУЛЬТАТ ВЗАИМОДЕЙСТВИЯ РЕАГЕНТА С СОЛЬЮ 1 Более активный металл Менее активный металл + соль 2 Кислота Соль + кислота 3 Щёлочь Соль + основание 4 Соль Соль + соль 1) Цинк + сульфат меди(П) + 2) Сульфит натрия -)- кислота —> -Ь 3) Карбонат натрия -Ь гидроксид бария —> + 48 нитрат свинца(П) + гидроксид калия —> + 4) Приведите пример взаимодействия солей. 4. Прочитайте текст и выполните задание к нему. В начале XIX в. английский учёный М. Фарадей изучал явление электропроводности растворов. На основании своих экспериментов он сделал правильный вывод, что переносчиками тока в растворах являются ионы. Но М. Фарадей считал, что ионы образуются под действием электрического тока («ошибка Фарадея»). Какие факты вы можете привести в доказательство того, что ионы в растворах образуются не под действием электрического тока? 5. Составьте молекулярное уравнение реакции, соответствующее сокращённым ионным уравнениям: а) Fe2+ -Ь 20Н- = Fe(OH)2i б) Си(ОН)2 + 2Н+ = Cu2+ + 2Н2О в) 2H+ + S2- = H2St 49 6. Преобразуйте схемы в ионные уравнения. К полученным ионным уравнениям составьте молекулярные. а)Н+ + ОН——> . б) 2Я^ + SQ2—> в) ЗВа2+ + 2PQ3- —> 7. Составьте сокращённые ионные уравнения, вписав пропущенные формулы. По сокращённым ионным уравнениям составьте молекулярные уравнения реакций. а)_..„.„ + SOf = BaS04l б) _ -Ь___= Н.О в) 2Я^+ =H20 + C02t Ш 50 § 14 идролиз солеи 1. Заполните таблицу 12: — приведите 2—3 формулы оснований и кислот (сильных и слабых электролитов); — в каждую клетку впишите не менее двух формул солей: а) соль образована катионом сильного основания и анионом сильной кислоты; б) соль образована катионом сильного основания и анионом слабой кислоты; в) соль образована катионом слабого основания и анионом сильной кислоты; г) соль образована катионом слабого основания и анионом слабой кислоты. Укажите название иона, по которому идёт гидролиз в растворах указанных солей, и характер среды (кислая, основная, нейтральная). Таблица 12 Гидролиз солей, образованных различными по силе электролитами ФОРМУЛЫ ВЕЩЕСТВ КИСЛОТЫ (СИЛЬНЫЕ ЭЛЕКТРОЛИТЫ) КИСЛОТЫ (СЛАБЫЕ ЭЛЕКТРОЛИТЫ) ОСНОВАНИЯ (СИЛЬНЫЕ ЭЛЕКТРОЛИТЫ) б) гидролиз по pH 51 Окончание табл. 12 ФОРМУЛЫ ВЕЩЕСТВ КИСЛОТЫ (СИЛЬНЫЕ ЭЛЕКТРОЛИТЫ) КИСЛОТЫ (СЛАБЫЕ ЭЛЕКТРОЛИТЫ) ОСНОВАНИЯ (СЛАБЫЕ ЭЛЕКТРОЛИТЫ) гидролиз по pH гидролиз по pH——— 2. Напишите уравнения гидролиза, протекающего при растворении в воде: а) сульфида натрия б) хлорида цинка 3. Составьте молекулярные уравнения реакций, соответствующие сокращённым ионным уравнениям: а) Fe2^+ HgO ^ FeOH+ + Н-; б) СгЗ HgO ^ СгОН2+ + Н+; в) SiO§- -f HgO ^ HSiOi + ОН-; 52 е) CN- + HgO HCN + OH“; 4. Укажите pH среды растворов следующих солей: а) CuClg —. б) NaNOg —. в) KgSiOg — . е) FeClg —_________________________________ д) BaS —. 5. Составьте молекулярные и ионные уравнения реакций, протекающих между веществами, формулы которых: а) KgS + Al(NOg)g+ HgO ->__ б) Fe2(S04)g + NagCOg + HgO——> Ш § 15 о кисление и восстановление 1. «Химическая путаница». Расставьте слова в предложениях в правильном порядке. а) Степень окисления заряд условный, который на атоме возникает, если электроны все к более электроотрицательному атому смещаются общие. 53 б) Реакции, называются, в которых элементов окислительновосстановительными степени окисления изменяются. 2. Установите соответствие между термином и его определением. Термин: А) восстановление; Б) окисление; Б) восстановитель; Г) окислитель. Определение: 1) процесс отдачи электронов, сопровождающийся увеличением степени окисления; 2) принимает электроны, понижает степень окисления и восстанавливается; 3) отдаёт электроны, повышает степень окисления и окисляется; 4) процесс присоединения электронов, сопровождающийся уменьшением степени окисления; 5) отдаёт электроны, повышает степень окисления и восстанавливается; 6) принимает электроны, понижает степень окисления и окисляется. Ответ. А) ;Б). ; Б). ; Г). 3. Определите степени окисления атомов всех элементов в соединениях, формулы которых: а) СО; б)С02; в) OFg; г) HNOg; (9)Н280з; е) K2SO3; ж) H2SO4; 3) CaS04; и) NH4CI; к)* (NH4)2S04. 4. Дополните схемы полуреакций, указав число отданных или принятых электронов. Укажите, к какому процессу (окисления или восстановления) относится каждая полуреакция. 54 Образец: Р® + Зё — N-3 — 5ё — процесс восстановления; — процесс окисления. а) А1“_^ е — —> б) S+® ё —>; в) S+e ё —> г) S“ ё -^s 5) С“ ё -^с е) С-“ ё —> 1 > — процесс 1-2 процесс > S“2 — процесс 5. Процессу восстановления соответствует схема: в) N0 —> N-3; г) С+2 —> А а) НО б) СиО ^Н+1; —> Си+2; 6. Какая реакция из схем, приведённых ниже, не является окислительно-восстановительной? а) СиО + NHg —> Си + Ng + HgO; б) НС1 ч- NHg-> NH4CI; в) NHg -f Og -> NO + HgO; г) * NH4NOg —> NgO + HgO. 7. Установите соответствие между уравнением реакции и вепде-ством, являющимся в ней восстановителем. Уравнение реакции: A) Zn + S = ZnS; Б) S -Ь Og = SOg; B) Zn -f 2HC1 = ZnClg -b Hg; Л MnOg -H 4HC1 = Clg -H MnClg «b 2HgO. Восстановитель: 1) Zn; 2) Og; 3) HCl; 4) S; 5) MnOg; 6) Hg. Ответ. A)..; Б) ; B) ; Г) 8. Окислительно-восстановительные процессы происходят при В взаимодействии: а) алюминия и соляной кислоты; б) оксида натрия и соляной кислоты; 55 в) оксида натрия и воды; г) натрия и воды; д) меди и воды; е) меди и кислорода. Ответ. . Ш § 16 4-доставление уравнении окислительновосстановительных реакций 1. «Четвёртый лишний». Из групп уравнений реакций исключите (подчеркните) лишнее: а) МпОз -Ь 4НС1 = MnClg -Ь Clgl + 2Н2О; CuClg + 2NaOH = Cu(OH)2i + 2NaCl; 6NaOH + 3CI2 = NaClOg + 5NaCl -H ЗН2О; 2NaI + Cl2 = 2NaCl-hl2i; б) 2Fe -h 3CI2 = 2ГеС1з; K2CO3 + 2HC1 = 2KC1 -b H2O -b CO2!; NaOH + HCl = NaCl + H2O; CaO + CO2 = СаСОз; в) 2КМПО4 = К2МПО4 + МпОз + Оз!; 2Сп(КОз)2 = 2CuO + 4N021 + Оз1; 2А1(ОН)з = AI2O3 + ЗН2О; 2КС10з = 2КС1-ь3021. Укажите критерий, на основании которого вы исключили лишнее уравнение в каждой группе. а) . б) . 56 2. В схемах реакций расставьте коэффициенты методом электронного баланса. Укажите окислитель и восстановитель, процесс окисления и восстановления. а) С + HNOg —> СО2 + NO2 + Н2О б) СиО + NHg-> Си + N2 + Н2О в) КСЮд + S —> КС1 + SO. г) H2S + О2-> S + Н2О д) NHg + О2-> NO + Н2О 3. Схема реакции, в которой атомы одного элемента одновременно окисляются и восстанавливаются: а) АШгд + CI2 —> AICI3 + ВГ2; б) NaOH + CI2 —> NaClO + NaCl + Н2О; в) KClOg—> KCl + O2; г) MnOg + HCl —> MnClg + CI2 + HgO. 4. Схема реакции, в которой окислитель и восстановитель — одно вещество: а) СаСОд —> СаО + СОд; б) Си(ОН)2 —> СиО + НдО; в) HgCOg —> СО2 + HgO; 2> HNOg -^ NOg ”Ь Og + HgO. 57 5. Составьте уравнения окислительно-восстановительных реакций. Расставьте коэффициенты методом электронного баланса. а) А1 + I9 —^. — ______________ б) FeqO. + Ко —> в) Na + Н2О —> г) CSo + О9 —^. 6. В уравнении реакции горения алюминия в кислороде коэффициент перед формулой окислителя равен: а) 1; б) 2; в) 3; г) 4. А А 7. Лабораторный способ получения хлора — взаимодействие оксида марганца(1У) с соляной кислотой. При этом образуется хлор, хлорид марганца(П) и вода. Коэффициент перед формулой вещества-восстановителя равен: а) 1; б) 2; в) 3; г) 4. 8. Впишите в предложения пропущенные слова. В приведённых схемах химических реакций расставьте коэффициенты методом электронного баланса. 58 Формула пероксида водорода —. Атом кислорода в пероксиде водорода имеет степень окисления _____ Эта степень окисления для кислорода является промежуточной, так как низшая степень окисления для кислорода равна , а высшая —. Следовательно, атом кислорода в ходе химических реакций может и__________, и степень окисления. Следовательно, пероксид водорода может быть и , и_______________ В химической реакции, схема которой KI + HgOg-> I2 + КОН, пероксид водорода — это , так как степень окисления кислорода. В химической реакции, схема которой НСЮ + HgOg ——> —> НС1 -Ь Og + HgO, пероксид водорода — это , так как степень окисления кислорода. Ш §17 Химические источники тока. Электрохимический ряд напряжений металлов^ 1. «Химическая путаница». Расставьте слова в предложениях в правильном порядке. ^ Параграф, включающий дополнительный материал, необязательный для изучения. 59 а) Электрический ток — электронов или ионов заряженных движение упорядоченное частиц, например. б) Устройство, в котором элементом гальваническим химическая электрическую энергия превращается в, называется. 2. 4. Установите соответствие между термином и его определением. Термин: А)электрод; Б)катод; В) анод. Определение: 1) отрицательно заряженный металлический стержень, на котором происходит окисление; 2) металлический стержень, заряженный положительно или отрицательно; 3) положительно заряженный металлический стержень, на котором происходит окисление; 4) отрицательно заряженный металлический стержень, на котором происходит восстановление; 5) положительно заряженный металлический стержень, на котором происходит восстановление. Ответ. А) ; Б) \В) 3. Верны ли следующие суждения? А А. Цинк более сильный восстановитель, чем свинец. Б. Ион алюминия более сильный окислитель, чем ион серебра Ag*. 1) Верно только А; 3) верны оба суждения; 2) верно только Б; 4) оба суждения неверны. Закончите уравнения тех реакций, которые практически осуществимы. Уравнения реакций запишите в молекулярном, полном и сокращённом ионном виде. Если реакция не идёт, укажите почему. 60 А а) Си + НС1 —> .. б) Fe + CuClg —>. в) Hg + гп(К0з)2 —> г) Zn + Hg(N03)2^ 5. Через некоторое время после опускания в раствор нитрата серебра пластинки некоторого металла раствор становится голубого цвета. О каком металле идёт речь? Что произошло с пластинкой металла? Запишите уравнения реакций в молекулярном и ионном виде. Ш § 18 ‘лектролиз 1. «Химическая путаница». Расставьте слова в предложении в правильном порядке. Электролизом тока постоянного действием электрического окислительно-восстановительный процесс, вызванный называют. 61 2. Для диагностики желудочно-кишечных кровотечений лаборатории необходим хром, который получают электролизом расплава хлорида хрома(1П). Дополните рисунок 2, указав названия электродов, название процессов, протекающих на них, а также формулы частиц, движущихся к электродам. Рис. 2. Схема электролиза хлорида хрома(1П) 3. При производстве имплантов в ортопедии в качестве биосов-мостимого материала используют титан. Запишите уравнение электролиза расплава хлорида титана(П). Катод (-) Анод (-f) , процесс , процесс 4. Составьте уравнения электролиза расплавов веществ, формулы которых: 62 а) АШгд б) KI в) LiH 5. На каком из электродов — катоде или аноде — могут протекать процессы, схемы которых: а) Hg2+ + 2ё > HgO; в) S2- -2ё —> S; б) 2ЩО + 2ё >Я2 + 20Н-; г) 40Н- — 4ё >0^ + 2ЩО? На катоде протекают процессы_________________________; на аноде протекают процессы 6. При электролизе 194 г раствора хлорида ртути(П) на катоде образовалось 60,3 г металла. Вычислите массу раствора по окончании электролиза. 7*. В § 18 учебника написано: «Электролиз широко используют в разных отраслях промышленности. С его помопдью получают 63 многие ценные вещества: алюминии, натрий, калий, хлор, фтор, водород, щёлочи». Ещё электролиз используют в гальваностегии и гальванопластике. Найдите в литературе (энциклопедиях, справочниках) определения терминов. Гальваностегия —. Гальванопластика — Ш tOUi I епловые эффекты химических реакций 1. Заполните схему 8. Тепловой эффект Схема 8 64 2. «Четвёртый лишний». Из групп уравнений реакций исключите (подчеркните) лишнее: а) 2СиО(^з) -Ь + ^6 кДж; ^2(г) + ^2(г) = 2NO(j,) — 180,8 кДж; + Clg^r) = 2HCl(j,) -Ь 184 кДж; ^2^4(г) ^ ^^2(г)
^^^2(г) ^^2^(г) 1400 кДж; б) 2HgO = 2Hg + О2 — Q; 2AgBr = 2Ag + Brg — Q; CaO + HgO = Ca(OH)2 + Q; N2 + O2 = 2NO — Q; в) 2Сп(МОз)2 = 2CuO + 4NO2 + O2; P2O5 + ЗН2О = 2H3PO4; 2Na + 2H2O = 2NaOH + H2; 2KOH + H2SO4 = K2SO4 + 2H2O. Укажите критерий, на основании которого вы исключили лишнее уравнение в каждой группе. а) . б) . -. в) . 3. Термохимическое уравнение горения алюминия имеет вид: ^^2(г)
^-^^2^3(тв) 3352 кДж. Рассчитайте, сколько выделится теплоты при образовании: а) 0,5 моль оксида алюминия; б) 25,5 г оксида алюминия. 65 4. При прокаливании карбоната кальция было затрачено 626,5 кДж теплоты. Рассчитайте объём (н. у.) образовавшегося при этом углекислого газа, если термохимическое уравнение процесса имеет вид: СаСОз(^з) = СаО(^з) -Ь C02^^^ — 157 кДж. 5. При взаимодействии 4,6 г натрия с серой выделилось 37,03 кДж теплоты. Составьте термохимическое уравнение данной реакции. 6*. Туристы, рыбаки, садоводы, автомобилисты часто используют компактные газовые баллоны. Как правило, они заполняются пропаном. Однажды рыбаки неожиданно обнаружили, что газ стал заканчиваться. Рассчитайте, хватит ли 22 г оставшегося пропана для того, чтобы вскипятить 1,5 л воды для приготовления чая. Справочная информация. • Термохимическое уравнение горения пропана имеет вид: ^3^8(г) ^^2(г) ^^^2(г) 1223 кДж. 66 • Количество теплоты, необходимое для нагревания, рассчитывается по формуле: Q = cm At, где с — удельная теплоёмкость воды (с = 4200 Дж/°С • кг). • Температура воды, которую нужно нагревать, равна 20 °С. Ш §20 скорость химических реакции 1. Заполните схему 9. Скорость химической реакции Схема 9 67 2. В ходе некоторой реакции вещество А превращается в вещество Б. Уравнение реакции имеет вид: А —> Б. Постройте график (рис. 3), отражающий изменение количеств веществ в ходе химической реакции. Сделайте соответствующие подписи. Рис. 3. Изменение количества вещества в ходе химической реакции 3. С наибольшей скоростью с водой реагирует: А а) медь; б) магний; в) цинк; г) натрий. 4. Верны ли следующие суждения? |5| А. Горение веществ в кислороде протекает медленнее, чем на воздухе. Б. Скорость реакции с участием твёрдых веществ увеличивается при их измельчении. 1) Верно только А; 2) верно только Б; 3) верны оба суждения; 4) оба суждения неверны. 5. При 40 °С скорость некоторой химической реакции равна 0,05 моль/л • мин. При увеличении температуры на 10 °С скорость реакции возросла в 3 раза. Постройте график (рис. 4), выражающий зависимость скорости данной реакции от температуры. 68 Рис. 4. Зависимость скорости реакции от температуры 6. Заполните таблицу 13, преобразовав схемы реакций в уравнения. Таблица 13 Катализаторы, используемые в некоторых химических процессах НАЗВАНИЕ ХИМИЧЕСКОГО СХЕМА ХИМИЧЕСКОЙ ИСПОЛЬЗУЕМЫЙ ПРОЦЕССА РЕАКЦИИ КАТАЛИЗАТОР Н2О2 ^ Н2О + ©2! SO2 + О2 ^ SO3 V2O5 Синтез аммиака N2 + H2 ^МНз Ре NH3 + O2 >N0 + H20 Pt 7. Какие факторы влияют на скорость коррозии железа: 4Fe + ЗО2 -Н 6Н2О = 4Ге(ОН)з? Как можно уменьшить скорость этой реакции? 69 ш 1. §21 Обратимые реакции. Химическое равновесие^ «Четвёртый лишний». Из групп уравнений реакций исключите (подчеркните) лишнее: а) CuClg + 2NaOH = Cu(0H)2i + 2NaCl; K2CO3 -f 2HC1 = 2KC1 HgO -h С02?; NaOH -b HCl = NaCl -b H2O; H2 + I2 = 2HI; б) C-h CO2 2NH, N2 -H ЗН2 « 2SO2 + O2 ‘3’ :^2SO. Укажите критерий, на основании которого вы исключили лишнее уравнение в каждой группе. б) . . 2. «Химическая путаница». Расставьте слова в предложениях в правильном порядке. а) Химическое равновесие — реакции всех веществ количества не меняются состояние, при котором участвующих в обратимой во времени. ^ Параграф, включающий дополнительный материал, необязательный для изучения. 70 б) Если оказывать внешнее на систему, то равновесие в сторону находяш;уюся в состоянии сместится равновесия воздействие ослабления этого воздействия. 3. Приведены схемы реакций. Преобразуйте их в уравнения и определите, в какую сторону сместится равновесие при повышении температуры: а) N2 + О2 ^ N0 — Q . ; б) Ее + Н2О в) С + Н2О СО + Н2 — Q. 4. Приведены схемы реакций. Преобразуйте их в уравнения и определите, в какую сторону сместится равновесие при повышении давления: ^2 <г) ^2(г) ^ ^(т) ^^2(г) ^ в) CSo..^ + HpS. + Q '2(г) ' ■^^2'^(г) 5. Какие факторы способствуют увеличению выхода прямых реакций, схемы которых: ^^2(г) ^2(г) ^ - ^^3[г) + Q б) + Оз(р) С+4; 3) —>S-2; 2) N-3 > N+2; 4) CI-1 —> CIO. А12. В окислительно-восстановительной реакции, схема которой NHg + О2 —> NO -Ь HgO, коэффициент перед формулой восстановителя равен: 1)5; 2)4; 3)3; 4)2. А13. В окислительно-восстановительной реакции, схема которой NHg + О2 —> N2 + HgO, коэффициент перед формулой окислителя равен: 1)5; 2)4; 3)3; 4)2. А14. На катоде протекает процесс, схема которого: 1) S2- -2ё —>8; 3) 2С1- -2ё —> CI2; 2) 40Н- — 4ё-> О2 + 2Н2О; 4) Сп2+ -Ь 2ё-> Си°. А15. С наибольшей скоростью протекает реакция между раствором серной кислоты и металлом: 1) медью; 3) алюминием; 2) свинцом; 4) железом. АТб.Скорость реакции разложения пероксида водорода увеличится, если: 1) добавить оксид марганца(1У); 2) понизить температуру; 3) увеличить давление; 4) добавить в систему кислород. А17.В реакции, схема которой СО + Нд ^ СО2 + СН4 + Q, равновесие сместится вправо (->): 1) при увеличении количества веш;ества СН^; 2) при увеличении давления; 74 3) при повышении температуры; 4) при добавлении катализатора. А18.При одновременном понижении температуры и повышении давления равновесие сместится вправо в системе: ^2(г) ^2(г) ^ 2) ^ ±2NO(,)-Q; =±COCl2(,,-Q; 3) С02(р) + с 2CO/j,4 + Q; 4) 2S02(p) + 02(р) А19.Термохимическое уравнение синтеза аммиака Ng + ЗН2 = 2NH3 + 92 кДж. Количество теплоты, которое выделится при образовании 8,96 л аммиака, равно: 1) 1,84кДж; 3) 36,8 кДж; 2) 18,4 кДж; 4)12,ЗкДж. ЧАСТЬ 2 При выполнении заданий В1, В2 выберите правильные ответы и обведите их номера. Запишите выбранные цифры в порядке возрастания в строку «Ответ». В заданиях ВЗ, В4 на установление соответствия запишите в строку ответа выбранные вами цифры: каждой букве соответствует одна цифра. В1. Необратимо протекают реакции между растворами: 1) гидроксида бария и серной кислоты; 2) сульфата натрия и азотной кислоты; 3) нитрата бария и хлорида калия; 4) карбоната калия и соляной кислоты; 5) сульфата магния и нитрата натрия; 6) хлорида алюминия и гидроксида калия. Ответ. В2. Схеме преврапдения мических реакций: 1) 2802+ 0з?=^280з; 2) 2Н28 + Оо = 8 + 2Н2О; ^ 8’*»* соответствуют уравнения хи- 75 3) 4FeS + 7O2 = ЗГезОз + 4SO2; 4) 2H2S + ЗО2 = 2SO2 + 2H2O; 5) С + 2H2SO4 = СО2 + 2SO2 + 2Н2О; 6) 4Mg + 5H2SO4 = 4MgS04 + H2S + 4H2O. Ответ. ВЗ. Установите соответствие между исходными веществами и сокращённым ионным уравнением реакции. Исходные вещества: A) H2SO4 и Са(ОН)2; Б) СаСОд и HNOg; B) НС1 и Ва(ОН)2; Г) AgNOgHNaCl. Сокращённое ионное уравнение: 1) Ag+ + Cl- = AgCl; 2) + ОН- = HgO; 3) CaCOg + 2Н^ = Са2+ + COg + HgO; 4) 2Н»^ + SQ2- -f Са2^ -f 20Н“ = CaS04 + + Н2О; 5) Са2+ + SOf- = CaS04; 6) COl
+ 2H^ = CO2 + HgO. Ответ. A) ; Б) ;B) ; Л B4, Установите соответствие между ческой реакции и условиями в сторону прямой реакции. Уравнение реакции: (г) A) 2НВг B) ^2(г) ^^2(г) ^ В) Feg04(.j,g) + 4CO(j,) “ ^2(г) ^^2(ж) ±2NHg(,) + Q;
Задачи и упражнения по химии для работы на уроках и дома в 9 классе
учебно-методическое пособие по химии (9 класс)
В сборник включены упражнения и задачи, позволяющие лучше усвоить содержание и действия, предусмотренные программой по химии авторского коллектива под руководством В.В.Лунина.
В основе сборника – задания из рабочей тетради к учебнику В.В.Ерёмина, Н.Е.Кузьменко, А.А.Дроздова, В.В.Лунина. Из множества заданий выбраны те, которые направлены на усвоение самых сложных вопросов курса и отработку самых сложных учебных действий. Тексты заданий отредактированы так, чтобы школьники учились оформлять ответы и решения в своих тетрадях с помощью таблиц, схем, кратких ответов.
К каждой учебной паре уроков календарно-тематического плана приведены 6 — 10 упражнений или задач, часть из которых предполагается выполнять на уроке на этапах усвоения и совершенствования знаний, а часть – дома, при подготовке к следующему уроку. В большинстве случаев домашние упражнения помещены в каждый раздел последними и имеют обобщающий или творческий характер.
В сборнике представлены также задания для практических работ и ознакомительные варианты контрольных работ, необходимые для обобщения большого объёма информации и подготовки к тематическим контрольным работам.
В конце сборника имеются справочные материалы, которые разработаны и используются составителем сборника в течение уже многих лет при реализации самых разных УМК.
Скачать:
| Вложение | Размер |
|---|---|
| sbornik_uprazhneniy_9_klass_tekst.docx | 130.57 КБ |
Предварительный просмотр:
ЗАДАЧИ И УПРАЖНЕНИЯ ПО ХИМИИ
для работы на уроках и дома
В сборник включены упражнения и задачи, позволяющие лучше усвоить содержание и действия, предусмотренные программой по химии авторского коллектива под руководством В.В.Лунина.
В основе сборника – задания из рабочей тетради к учебнику В.В.Ерёмина, Н.Е.Кузьменко, А.А.Дроздова, В.В.Лунина. Из множества заданий выбраны те, которые направлены на усвоение самых сложных вопросов курса и отработку самых сложных учебных действий. Тексты заданий отредактированы так, чтобы школьники учились оформлять ответы и решения в своих тетрадях с помощью таблиц, схем, кратких ответов. Такой формат записей, по мнению составителя, в значительно большей степени способствует формированию УУД при изучении курса химии, чем заполнение тетради с печатной основой. Кроме этого, использованы задания, привлеченные составителем из других источников, в том числе собственные разработки.
К каждой учебной паре уроков календарно-тематического плана приведены 6 — 10 упражнений или задач, часть из которых предполагается выполнять на уроке на этапах усвоения и совершенствования знаний, а часть – дома, при подготовке к следующему уроку. В большинстве случаев домашние упражнения помещены в каждый раздел последними и имеют обобщающий или творческий характер. Такая структура сборника позволяет родителям контролировать полноту и регулярность учебной деятельности своих детей по освоению каждого раздела курса химии, а также способствует успешной подготовке тех учащихся, которые пропустили часть уроков по болезни или по иным причинам.
В сборнике представлены также задания для практических работ и ознакомительные варианты контрольных работ, необходимые для обобщения большого объёма информации и подготовки к тематическим контрольным работам.
В конце сборника имеются справочные материалы, которые разработаны и используются составителем сборника в течение уже многих лет при реализации самых разных УМК. Опыт показал, что использование этих материалов позволяет школьникам легче усвоить основные закономерности, выделить самое главное, избежать зазубривания при освоении терминов и формулировок.
Составитель сборника: учитель химии Клёнов Олег Анатольевич
Урок 1. Моль – единица количества вещества.
Урок 2. Молярная масса. (§1-2)
1. Сколько атомов ртути находится в одном медицинском термометре, если её количество составляет 0,5 ммоль?
2. Подсчитано, что в воздушном пространстве крупного города на каждого жителя приходится 9,03 · 10 25 молекул озона О 3 . Рассчитайте количество вещества озона, приходящегося на каждого горожанина.
3. Рассчитайте количество вещества аммиака (в молях) NH 3 , если известно:
а) число молекул аммиака равно 3,01 · 10 22
б) число атомов азота в молекулах аммиака равно 1,204 · 10 23
в) количество вещества атомов азота равно 0,12 моль
г) количество вещества атомов водорода равно 0,15 моль.
4. Сколько молекул и сколько атомов каждого элемента содержится в порциях веществ:
а) 0,5 моль газа водорода Н 2 в) 2,1 моль сахара С 12 Н 22 О 11
б) 1,2 моль воды Н 2 О г) 0,8 моль поваренной соли
5. Рассчитайте количество вещества:
а) в 3,15 г азотной кислоты HNO 3 в) в 48 г сульфата меди(II) CuSO 4
б) в 185 г гидроксида кальция Ca(OH) 2 г) в 2,25 г воды H 2 O
6. Рассчитайте массу:
а) 3,5 моль фосфорной кислоты H 3 PO 4
б) 2 моль гидроксида железа(III) Fe(OH) 3
в) 0,6 моль гидрокарбоната натрия NaHCO 3
г) 0,45 моль мела СаСО 3
7. Масса образца сероводорода H 2 S равна 1,7 г. Вычислите количество вещества сероводорода и число молекул в этой порции.
8. Определите массу:
а) 0,7 моль белого фосфора (Р 4 ); в) 5 ммоль пищевой соды (NaHCO 3 )
б) 3·10 22 молекул сульфата меди (СuSO 4 ); г) 2 кмоль воды H 2 O
9. Лекарственный препарат «Аспирин» содержит активное вещество ацетилсалициловая кислота (С 9 Н 8 О 4 ). Сколько молекул ацетилсалициловой кислоты имеется в одной таблетке «Аспирин», имеющей массу активного вещества 500 мг?
10. Образец вещества массой 66 г содержит 9,03 · 10 23 молекул. Вычислите молярную массу этого вещества.
-3- Урок 3. Расчёты по уравнениям реакций.
Урок 4. Решение задач с использованием уравнений реакций. (§3-4)
11. Какое количество вещества кислорода необходимо для сжигания 0,25 моль сероводорода, если реакция идёт согласно схеме: H 2 S + O 2 → SO 2 + H 2 O?
(Не забудьте расставить коэффициенты, чтобы превратить её в уравнение)
12. Какова масса осадка, выпадающего в реакции обмена между 0,06 моль гидроксида натрия и необходимым для реакции количеством сульфата меди(II)?
13. Вычислите массу алюминия, необходимого для получения 1,5 моль водорода в реакции замещения с соляной кислотой.
(Алюминий во всех реакциях трёхвалентен)
14. Определите массу карбоната калия, образовавшегося в результате пропускания углекислого газа в раствор, содержащий 28 г гидроксида калия.
15. Определите массу осадка, полученного при сливании 74 г 30%-ного раствора хлорида кальция с необходимым количеством раствора нитрата серебра.
16. Каталитическое окисление аммиака происходит в соответствии со схемой:
NH 3 + O 2 → NO + H 2 O. Расставьте коэффициенты в этой схеме.
В результате реакции получено 1,5 моль оксида азота(II).
Перечертите в тетрадь таблицу и, сделав необходимые вычисления, заполните её пустые ячейки:
Нестандартные задания по химии.
Использование нестандартных заданий на уроках позволяют снять эмоциональное напряжение, в то же время дать сведения развивающего и воспитательного плана, показать практическую значимость темы, побудить к активизации самостоятельной познавательной деятельности. Данные задания могут быть использованы на уроках и во внеурочное время для проведения интеллектуальных соревнований.
Просмотр содержимого документа
«Нестандартные задания по химии.»
Нестандартные задания по химии.
Задание: перед вами ряды с химическими формулами веществ. Внимательно посмотрите на каждый ряд и «исключите» из него какое-то явно «лишнее» вещество, при этом укажите признаки, по которым вы это вещество вычеркиваете из списка.
2. «Веселые перевертыши»
Задание: правильно прочитайте предложения.
1. Не все то аурум, что металлическим блеском обладает;
2. Куй феррум, пока температура высока;
3. Недонатрий хлористый – на столе, перенатрий хлористый – на спине ;
4. Уходит как аш-два-о в оксид кремния четырехвалентного;
5. Необычайно твердая аллотропная модификация углерода чистой аш-два-о;
6. Слово – аргентум, молчание – аурум;
7. Много оксида водорода утекло с тех пор.
8. Пролежал холод, сушь и оловянные трубы.
9. Звери живут за неметалл.
Задание: Оказывается, не только между людьми существуют родственные связи. Внимательно посмотрите на помещенный ниже список веществ, вспомните их классификацию и объедините в пары «по родству».
1. Гашеная известь
4. Соляная кислота
6. Медный купорос
7. Поваренная соль
8. Сода питьевая
10. Нашатырный спирт
Начав движение с верхней левой клетки и передвигаясь по горизонтали или вертикали, пройдите все клетки (клетка может быть использована один раз) таким образом, чтобы из букв, приведенных в клетках, получилось:
А) правило по мерам предосторожности при обращении с химическими реактивами;
Б) правило по технике безопасности, соблюдаемое при нагревании пробирки с жидкостью;
Задание: чтобы осуществить эти удивительные превращения, нужно свободные клетки заполнить словами так, чтобы каждое последующее слово отличалось от предыдущего на одну букву. Слова должны быть именами существительными в единственном числе и в именительном падеже. Промежуточные слова могут и не иметь прямого отношения к химии.
6. Слова давно забытых дней.
Задание: в химии многие вещества имеют как номенклатурные, так и тривиальные названия – полученные «из жизни». Вам надо найти нужное соответствие одинаковых веществ, но с разными «именами».
Угарный газ а) NaCl
Известняк б) NaHCO3
Болотный газ в) NH4Cl
Питьевая сода д) NaOH
Соляной спирт (морская кислота) е) N2O
Купоросное масло з) СаСО3
Бурый газ м) р-р HCl
Каменная соль о) SiO2
Кальцинированная сода п) CH4
Каустическая сода с) CO
Растворимое стекло т) NH4OH
Селитряная или крепкая водка у) H2SO4 (конц)
Задание: определите вещества Х и Y в цепочке превращений. Составьте уравнения реакций согласно приведенной схеме.


8. В каждой строчке вычеркните «лишнее» по приведенному признаку:
9. Заполнить кроссворд названиями химических элементов:
Задание: из русского языка вам известны омонимы. Расшифруйте записи по приведенным рисункам.
11. Задание: На каждую букву слова вспомнить и записать как можно больше химических терминов, понятий:
12. Задачи на сообразительность.
1) Трое друзей задержались после звонка в кабинете химии, стараясь найти правильный ответ на возникший в конце урока вопрос: «Что произойдет, если в банку с керосином опустить кусочек металлического калия?»
Николай, подумав, тихо заметил:
— Калий – металл крайне активный… Попади он в керосин – сразу вспыхнет. Словом, быть пожару!
Евгений не согласился:
— Да брось ты! Ничего не будет. Калий-то воспламеняется в воздухе. Его и до сосуда не донесут – сгорит без остатка.
А Алексей вздохнул и произнес:
— Успокойтесь, ребята. Кусочек калия просто упадет на дно и будет преспокойно лежать там.
Чье же мнение можно считать правильным?
2) Наши старые знакомые Николай, Евгений и Алексей пришли в кабинет химии, чтобы заняться лабораторной работой. На глаза им попалась склянка с белым порошком и наклейкой «СаО».
Николай глубокомысленно изрек:
— Это… воздушная известь.
— Конечно, известь. Кто в этом сомневается… Только не воздушная, а обожженная.
Алексей внимательно посмотрел на своих приятелей и бросил:
— Это негашеная известь.
Кто же из них прав?
3) Во время урока химии учитель предложил классу разобраться в следующей ситуации: в склянку, ярко освещенную солнечными лучами, ввели равное количество газов хлора и водорода, затем закрыли ее хорошо притертой пробкой – что может произойти в подобных условиях?
Николай задумался ненадолго и произнес:
— Гм… Водород соберется наверху, потому что он более легкий, а хлор… Хлор, бесспорно, останется внизу.
Евгений взглянул на товарища и бросил:
— Навряд ли. Пройдет часа три – и газы просто перемешаются.
Алексей, смущаясь, заметил:
— Знаете что, братцы-кролики, от такой баночки нужно держаться подальше: она может неожиданно взорваться.
Решите, кто из приятелей высказал правильное мнение.
13.Задание от алхимиков
Задание: согласно мнению алхимиков, семи планетам соответствовали семь металлов, известных науке средних веков, а также определенные дни недели. Ваша задача – найти правильные соотношения.
РТУТЬ СОЛНЦЕ ВОСКРЕСЕНЬЕ
МЕДЬ ЛУНА СРЕДА
СВИНЕЦ ЮПИТЕР ПЯТНИЦА
ОЛОВО МЕРКУРИЙ ЧЕТВЕРГ
ЖЕЛЕЗО САТУРН ПОНЕДЕЛЬНИК
ЗОЛОТО МАРС СУББОТА
СЕРЕБРО ВЕНЕРА ВТОРНИК
1. У Васи в кармане железный гвоздь, который весит 10г. Какое количество вещества железа лежит в кармане у Васи?
2. Один воздушный шарик вмещает 1 л кислорода. Может ли воздушный шарик содержать 0,5 моль этого вещества?
Ответ подтвердите расчетами.
Их получают путем горения,
Или сложных веществ разложением.
В них два элемента, один – кислород.
Я отнесу к ним и известь и лед.
Они имеют кислый вкус,
В них изменяет цвет лакмус,
А если активный металл попадет
Получим мы соль и еще водород.
http://nsportal.ru/shkola/khimiya/library/2020/11/16/zadachi-i-uprazhneniya-po-himii-dlya-raboty-na-urokah-i-doma-v-9
http://multiurok.ru/files/niestandartnyie-zadaniia-po-khimii.html