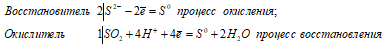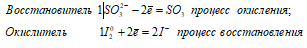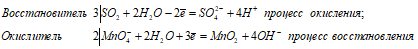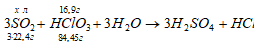Оксид серы (IV)
Оксид серы (IV) – это кислотный оксид . Бесцветный газ с резким запахом, хорошо растворимый в воде.
Cпособы получения оксида серы (IV)
1. Сжигание серы на воздухе :
2. Горение сульфидов и сероводорода:
2CuS + 3O2 → 2SO2 + 2CuO
3. Взаимодействие сульфитов с более сильными кислотами:
Например , сульфит натрия взаимодействует с серной кислотой:
4. Обработка концентрированной серной кислотой неактивных металлов.
Например , взаимодействие меди с концентрированной серной кислотой:
Химические свойства оксида серы (IV)
Оксид серы (IV) – это типичный кислотный оксид. За счет серы в степени окисления +4 проявляет свойства окислителя и восстановителя .
1. Как кислотный оксид, сернистый газ реагирует с щелочами и оксидами щелочных и щелочноземельных металлов .
Например , оксид серы (IV) реагирует с гидроксидом натрия. При этом образуется либо кислая соль (при избытке сернистого газа), либо средняя соль (при избытке щелочи):
SO2(изб) + NaOH → NaHSO3
Еще пример : оксид серы (IV) реагирует с основным оксидом натрия:
2. При взаимодействии с водой S O2 образует сернистую кислоту. Реакция обратимая, т.к. сернистая кислота в водном растворе в значительной степени распадается на оксид и воду.
3. Наиболее ярко выражены восстановительные свойства SO2. При взаимодействии с окислителями степень окисления серы повышается.
Например , оксид серы окисляется кислородом на катализаторе в жестких условиях. Реакция также сильно обратимая:
Сернистый ангидрид обесцвечивает бромную воду:
Азотная кислота очень легко окисляет сернистый газ:
Озон также окисляет оксид серы (IV):
Качественная реакция на сернистый газ и на сульфит-ион – обесцвечивание раствора перманганата калия:
Оксид свинца (IV) также окисляет сернистый газ:
4. В присутствии сильных восстановителей SO2 способен проявлять окислительные свойства.
Например , при взаимодействии с сероводородом сернистый газ восстанавливается до молекулярной серы:
Оксид серы (IV) окисляет угарный газ и углерод:
SO2 + 2CO → 2СО2 + S
Характеристика окислительно-восстановительных свойств диоксида серы и сернистой кислоты
Задача 859.
Дать характеристику окислительно-восстановительных свойств диоксида серы и сернистой кислоты. Ответ подтвердить примерами.
Решение:
Сера в SO2 и H2SO3 находится в своей промежуточной степени окисления +4, поэтому SO2 и H2SO3 могут проявлять как восстановительные, так и окислительные
свойства.
а) Сера как восстановитель
Здесь степень окисления серы повышается от +4 до +6.
б) Сера как окислитель
Здесь степень окисления серы понижается от +4 до 0.
Задача 860.
Закончить уравнения реакций:
а) H2S + SO2 ↔ ;
б) H2SO3 + I2 ↔ ;
в) KMnO4 + SO2 + H2O ↔ ;
г) HIO3 + H2SO3 ↔ .
Указать, какие свойства проявляют в каждой из этих реакций диоксид серы или сернистая кислота.
Решение:
а) H2S + SO2 ↔ 3S↓ + 2H2O
Уравнения ионно-молекулярного баланса:
2S 2- + SO2 + 4H + = 3S 0 + 2H2O
Таким образом, диоксид серы проявляет свойства окислителя, а сероводород — восстановителя.
Таким образом, сернистая кислота проявляет свойства восстановителя.
3SO2 + 2MnO4 — + 10H2O = 3SO4 2- + 2MnO2 + 12H + + 8OH —
Таким образом, диоксид серы проявляет свойства восстановителя.
Восстановитель 3|6|SO3 2- + H2O — 2e = SO4 2- + 2H + процесс окисления
Окислитель 1|2|IO3 — + 6H + + 6e = I — + 3H2O процесс восстановления
3SO3 2- + IO3 — + 3H2O + 6H + ↔ 3SO4 2- + I — + 6H + + 3H2O
Таким образом, сернистая кислота проявляет свойства восстановителя.
Задача 861.
Какие из перечисленных осушителей можно использовать для удаления влаги из SO2: Н2SO4(конц.), КОН(к.), Р2O5(к.), К2CO3(к.)?
Решение:
а) Н2SO4(конц.) бурно реагирует с водой с образованием гидратов, в основном моногидратов:
б) SO2 как кислотный оксид реагирует с кристаллическим КОН с образованием кислой соли:
в) SO2 как кислотный оксид реагирует с кристаллическим К2СО3 с образованием соли сернистой кислоты и диоксида углерода:
г) Р2О5 бурно реагирует с водой с образованием фосфорной кислоты:
Таким образом, Н2SO4(конц.) и Р2О5 можно применить для осушения SO2.
Задача 862.
Сколько литров SO2, взятого при нормальных условиях, надо пропустить через раствор НСIО3, чтобы восстановить 16,9 г ее до НСI?
Решение:
Уравнение реакции имеет вид:
Рассчитаем объем SO2, необходимый для восстановления HCO3 из пропорции:
84,45 : (3 . 22,4) = 16,9 : x; x = [16,9 . (3 . 22,4)]/84,45 = 13,45 л.
Ответ: V(SO2) = 13,45 л.
Из h2so4 получить so2 ионное уравнение
ХИМИЯ – это область чудес, в ней скрыто счастье человечества,
величайшие завоевания разума будут сделаны
именно в этой области.(М. ГОРЬКИЙ)
Таблица
Менделеева
Универсальная таблица растворимости
Коллекция таблиц к урокам по химии
Сернистый газ. Сернистая кислота и её соли
I. Cернистый ангидрид; сернистый газ, оксид серы (IV) SO2
1. Физические свойства
Бесцветный газ с резким запахом; хорошо растворим в воде (в 1V H2O растворяется 40VSO2 при н.у.); более чем в два раза тяжелее воздуха, ядовит; t°пл. = -75,5°C; t°кип. = -10°С.
Обесцвечивает многие красители, убивает микроорганизмы.
2. Получение
1) При сжигании серы в кислороде: S + O2 → SO2
3) Обработкой солей сернистой кислоты минеральными кислотами: Na2SO3 + 2HCl → 2NaCl + SO2 + H2O
4) При окислении металлов концентрированной серной кислотой: Cu + 2H2SO4(конц) → CuSO4 + SO2 + 2H2O
3. Химические свойства
1) Реакции окисления, SO2 — восстановитель (S +4 – 2ē → S +6 )
2) Реакции восстановления, SO2 — окислитель (S +4 + 4ē → S 0 )
SO2 + С → S + СO2 (при нагревании)
3) Сернистый ангидрид — кислотный оксид: взаимодействие с водой
При растворении в воде образуется слабая и неустойчивая сернистая кислота H2SO3 (существует только в водном растворе)
II. Сернистая кислота и ее соли
1. Сернистая кислота — неустойчивая двухосновная неорганическая кислота средней силы. Отвечает степени окисления серы +4. Химическая формула 
2. Химические свойства
1) Сернистая кислота диссоциирует ступенчато:
H2SO3 ↔ H + + HSO3 — (первая ступень, образуется гидросульфит – анион)
HSO3 — ↔ H + + SO3 2- (вторая ступень, образуется анион сульфит)
H2SO3 образует два ряда солей — средние (сульфиты) и кислые (гидросульфиты).
Качественной реакцией на соли сернистой кислоты является взаимодействие соли с сильной кислотой, при этом выделяется газ SO2 с резким запахом:
2) Раствор сернистой кислоты H2SO3 обладает восстановительными свойствами. Сернистая кислота взаимодействует с раствором йода, обесцвечивая его. При этом образуются йодоводородная и серная кислоты.
3) Как и все кислоты, сернистая кислота меняет цвет растворов индикаторов. Метиловый оранжевый в растворе кислоты становится красным. В старину дамские соломенные шляпки отбеливали сернистой кислотой. Раствор сернистой кислоты отбеливает ткани из растительного материала, шерсти, шелка. Видео: «Свойства сернистой кислоты»
4) Взаимодействие со щелочами
5) Взаимодействие с основными оксидами: SO2 + CaO = CaSO3
6) Водные растворы сульфитов щелочных металлов окисляются на воздухе:
III. Задания для закрепления
Задание №1 Закончите уравнения химических реакций, составьте электронный баланс, укажите процессы окисления и восстановления, окислитель и восстановитель:
Задание №2 Осуществите превращения по схемам. Уравнения реакций ионного обмена напишите в полном и кратком ионном виде.
http://buzani.ru/zadachi/khimiya-glinka/1281-dioksid-sery-i-sernistaya-kislota-zadachi-859-862
http://kardaeva.ru/89-dlya-uchenika/9-klass/194-sernistyj-gaz-sernistaya-kislota-i-ejo-soli