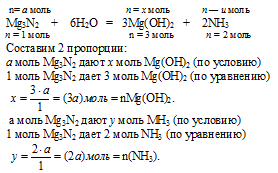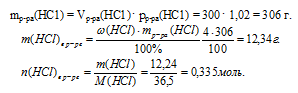Нитрид магния: способы получения и химические свойства
Нитрид магния (динитрид тримагния) Mg3N2 — cсоединение магния и азота. Желто-зеленый. При нагревании разлагается.
Относительная молекулярная масса Mr = 100,93; относительная плотность по тв. и ж. состоянию d = 2,71;
Способ получения
1. Нитрид магния можно получить при температуре 780 — 800º С путем взаимодействия магния и азота :
2. При температуре 600 — 850º C, в результате взаимодействия магния и аммиака, образуется нитрид магния и водород:
Химические свойства
1. Нитрид магния разлагается при температуре 700 — 1500º C, образуя магний и азот:
2. При взаимодействии с водой при кипении нитрид магния образует гидроксид магния и аммиак:
3. Нитрид магния вступает в реакцию с простыми веществами :
3.1. Нитрид магния при температуре 500 — 800º C реагирует с кислородом с образованием оксида магния и азота:
4. Нитрид магния может взаимодействовать со сложными веществами :
4.1. С разбавленной хлороводородной кислотой нитрид магния образует хлорид магния и хлорид аммония:
Как правильно рассчитать объем исходного раствора аммиака?
Данная задача интересна тем, что на первом этапе происходит одна реакция, продукты которой участвуют в двух параллельных реакциях.
Задача 3.8.
Определите массу нитрида магния, полностью подвергшегося разложению водой, если для солеобразования с продуктами гидролиза потребовалось 300 мл 4% -ного раствора соляной кислоты (р = 1,02 г/мл)
Дано:
объем соляной кислоты: Vр-ра(НС1) = 300 мл;
массовая доля НС1 в соляной кислоте: 
плотность соляной кислоты: рр-ра(НС1) = 1,02 г/мл.
Найти: массу Mg3N2.
Решение:
В условии задачи описано несколько последовательных химических реакций.
Оба продукта первой реакции будут взаимодействовать с соляной кислотой с образованием солей.
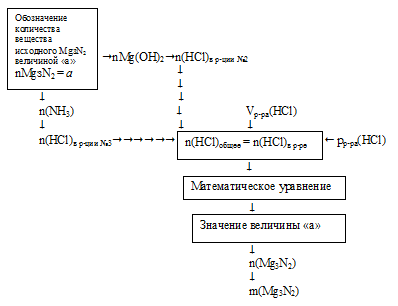
Решение данной задачи необходимо вести с составлением математического уравнения. Схематично алгоритм можно представить таким образом:
1. Обозначим количество вещества 1 исходного Mg3N2 величиной «а»: n(Mg3N2) = а моль.
Используя величину «а» как известную, по первому химическому уравнению определяем количество вещества каждого из продуктов:
2. По второй химической реакции определяем количество вещества НС1, которое расходуется на солеобразование с (3а) моль Mg(OH)2.
3. По третьей химической реакции определяем количество вещества НС1, которое расходуется на солеобразование с (2а) моль МН3.
4. Определяем общее количество НС1, которое расходовалось в реакциях №2 и №3 по результатам расчета в предыдущих двух действиях.
n(HCl)общее = n(HCl)в р-ции№2 + n(НС1)в р-ции№3 = 6а + 2а = (8а) моль.
5. Определяем количество вещества НС1, которое содержалось в 300 мл 4% -ного раствора (по данным условия):
6. Составляем математическое уравнение. Для этого приравниваем количество вещества НС1, определенное путем расчета по химическим уравнениям (из 4 действия), и значение, найденное в 5 действии:
Решая это математическое уравнение, находим значение величины «а»:
Величиной «а», мы обозначали количество вещества исходного Мg3N2: n(Мg3N2) = 0,042 моль.
7. Определяем массу исходного вещества:
Комментарии:
1 Величиной «а» можно было обозначить и массу исходного вещества. В этом случае в расчетах фигурировали бы более сложные значения, и возросла вероятность арифметической ошибки.
Получить из нитрида аммиак))?
Химия | 5 — 9 классы
Получить из нитрида аммиак)).
NH4NO3 + NaOH — — > ; NaNO3 + NH3 * H2O
Из 56 грамм азота получили 42, 5 грамм аммиака?
Из 56 грамм азота получили 42, 5 грамм аммиака.
Вычислите выход аммиака.
1 задание?
Напишите уравнения реакций, с помощью которых можно осуществить цепочку превращений : Аммиак — азот — нитрид магния — аммиак — хлорид магния — аммиак.
Вычислите массу аммиачной воды(25 % р — ра аммиака), которая получится при растворении в воде аммиака, выделившаяся при взаимодействии сульфата аммония массой 33 г и гидроксида кальция массой 37 г.
Как из нитрата аммония получить аммиак ?
Как из нитрата аммония получить аммиак ?
Аммиак — азот — нитрид магния — аммиак — хлорид аммония — аммиак по одному расписать?
Аммиак — азот — нитрид магния — аммиак — хлорид аммония — аммиак по одному расписать.
Напишите уравнения реакций, с помощью которых можно осуществить цепочку превращений веществ : а) азот — — — аммиак — — — аммоний сульфат — — — аммиак — — — азот — — — азота (II) оксид ; б) аммиак — — ?
Напишите уравнения реакций, с помощью которых можно осуществить цепочку превращений веществ : а) азот — — — аммиак — — — аммоний сульфат — — — аммиак — — — азот — — — азота (II) оксид ; б) аммиак — — — азот — — — магний нитрид — — — аммиак — — — аммоний хлорид — — — аммиак ; в) аммоний карбонат — — — аммиак — — — азот — — — литий нитрид — — — аммиак — — — аммоний ацетат.
Какая масса нитрида алюминия необходима для получения 3 л аммиака (условия нормальные)?
Какая масса нитрида алюминия необходима для получения 3 л аммиака (условия нормальные)?
Как из аммиачной воды получить аммиак?
Как из аммиачной воды получить аммиак?
Какой объём газообразного аммиака надо растворить в воде, чтобы получить 500 г 6% по массе раствора аммиака?
Какой объём газообразного аммиака надо растворить в воде, чтобы получить 500 г 6% по массе раствора аммиака?
Из 117г хлорида аммония было получено 17 г аммиака?
Из 117г хлорида аммония было получено 17 г аммиака.
Определите выход аммиака в процентах от теоретически возможного.
Из 56г азота, получено 48г аммиака?
Из 56г азота, получено 48г аммиака.
Каков выход аммиака в % к теоретическому?
На этой странице сайта вы найдете ответы на вопрос Получить из нитрида аммиак))?, относящийся к категории Химия. Сложность вопроса соответствует базовым знаниям учеников 5 — 9 классов. Для получения дополнительной информации найдите другие вопросы, относящимися к данной тематике, с помощью поисковой системы. Или сформулируйте новый вопрос: нажмите кнопку вверху страницы, и задайте нужный запрос с помощью ключевых слов, отвечающих вашим критериям. Общайтесь с посетителями страницы, обсуждайте тему. Возможно, их ответы помогут найти нужную информацию.
Mr(SO3) = 32 + 3 * 16 = 80 W(S) = 32 / 80 = 0. 4 = 40% Mr(SO2) = 32 + 2 * 16 = 64 W(S) = 32 / 64 = 0. 5 = 50% В 0, 8 раза.
M(CuSO4) = 64 + 32 + 4 * 16 = 160 г / моль n(CuSO4) = 1. 6 / 160 = 0. 01 моль.
Дано n(H2SO4) = 3 mol — — — — — — — — — — — — — — — — — — — — — — — — — — — — N(H2SO4) N = n * N(A) = 3 * 6. 02 * 10 ^ 23 = 1. 806 * 10 ^ 24 молекул ответ 1. 806 * 10 ^ 24 молекул.
Все легко. Простые вещества состоят из 1 химического элемента, например : Mg, Ca. Сложные вещества состоят из 2 и более химических элементов, например : KOH или MgO.
Вот, думаю понятно будет.
Ba(OH)2 + H2SO4 = BaSO4 + 2H2O M(H2SO4) = 98г / моль M(BaSO4) = 233г / ммоль m(H2SO4) = 100 * 5 / 100 = 5г n(H2SO4) = 5 / 98 = 0, 051моль nH2SO4 : nBaSO4 = 1 : 1 n(BaSO4) = 0, 051моль m(BaSO4) = 0, 051 * 233 = 11, 9г.
2H2 + O2 = 2h2o M(h2o) = 18 г / моль, v = 0, 5 моль( из уравнения) , m(h2o) = 18 * 0. 5 = 9 г.
http://buzani.ru/zadachi/ege-khimiya/835-opredelenie-massy-nitrida-magniya-khimiya-ege-testovye-zadachi
http://himia.my-dict.ru/q/161788_polucit-iz-nitrida-ammiak/