Получение водорода
История открытия водорода История водорода начинается с XVI века, когда было замечено, что при действии кислот на железо и другие металлы выделяется некий неизвестный газ. Первоначально его назвали «горючим воздухом». Такое название газ получил из-за способности гореть. Во второй половине XVIII века английский ученый Генри Кавендиш получил водород при действии соляной кислоты HCl на цинк:
Zn + 2HCl = ZnCl2 + H2
Что же такое кислота с точки зрения химии? Кислота – это сложное вещество, в состав которого всегда входят атомы водорода. В формулах кислот атомы водорода принято писать на первом месте. Атомы, следующие в формуле за водородом, называют кислотным остатком. Так, в соляной кислоте HCl кислотный остаток – Cl.
Например, в серной кислоте H2SO4, кислотный остаток – SO4. Кислота – сложное вещество, в состав которого входят атомы водорода и кислотный остаток Генри Кавендиш изучил свойства «горючего воздуха». Он установил, что этот газ намного легче воздуха, а при сгорании на воздухе образует прозрачные капли жидкости. Этой жидкостью оказалась вода.
Генри Кавендиша считают первооткрывателем водорода. Вывод о том, что «горючий воздух» представляет собой простое вещество, был сделан в 1784 году французским химиком Антуаном Лораном Лавуазье. Антуан Лоран Лавуазье дал этому веществу латинское название (Hydrogenium), которое происходило от греческих слов «хюдор» – вода и «геннао» – рождаю. В те годы под элементами подразумевали простые вещества, которые нельзя далее разложить на составные части. Поэтому у химического элемента водорода такое же название, как и у просто вещества H2. Русское слово водород – это точный перевод латинского названия Hydrogenium.
Получение водорода в лаборатории
Современный лабораторный способ получения водорода не отличается от того, которым его получал Генри Кавендиш. Это реакции металлов с кислотами. В лаборатории водород получают в аппарате Киппа (рисунок 152).
Аппарат Киппа изготовляется из стекла и состоит из нескольких частей:
- реакционная колба с резервуаром;
- воронка с длинной трубкой;
- газоотводная трубка.
Реакционная колба имеет верхнюю шарообразную часть с отверстием, в которое вставляется газоотводная трубка, снабженная краном или зажимом, и нижний резервуар в виде полусферы. Нижний резервуар и реакционная колба разделены резиновой или пластиковой прокладкой с отверстием, через которое проходит в нижний резервуар длинная трубка воронки, доходящая почти до дна. На прокладку через боковое отверстие шпателем насыпают твёрдые вещества (мрамор, цинк). Отверстие закрывается пробкой с газоотводной трубкой. Затем при открытом кране или зажиме в верхнюю воронку заливается раствор кислоты. Когда уровень жидкости достигает вещества на прокладке, начинается химическая реакция с выделением газа. При закрытии крана давление выделяющегося газа выдавливает жидкость из реактора в верхнюю часть воронки. Реакция прекращается. Открытие крана приводит к возобновлению реакции. Поместим в реакционную колбу кусочки цинка. В качестве кислоты воспользуемся серной кислотой. При контакте цинка и серной кислоты протекает реакция:
Zn + H2SO4 = ZnSO4 + H2
Водородом можно заполнить мыльный пузырь.
Для этого необходимо опустить газоотводную трубку в мыльный раствор. На конце трубки начнется формирование мыльного пузыря, заполненного водородом; со временем пузырь отрывается и улетает вверх, что доказывает легкость водорода. Соберем выделяющийся водород. С учетом того, что водород намного легче воздуха, для сбора водорода сосуд, в котором собирается газ, необходимо располагать вверх дном, или производить собирание методом вытеснения воды. Как обнаружить водород? Заполним пробирку водородом, держа ее вверх дном, по отношению к газоотводной трубке. Поднесем пробирку отверстием к пламени спиртовки – слышится характерный хлопок.
Хлопок – это признак того, что в пробирке содержится водород. При поднесении пробирки к пламени водород вступает в реакцию с кислородом, содержащимся в воздухе. При малых количествах реакция кислорода и водорода сопровождается хлопком. Более подробно об этой реакции будет рассказано в следующем параграфе.
Получение водорода в промышленности
Одним из промышленных способов получения водорода является реакция разложения воды под действием электрического тока:
2H2O эл.ток → 2H2 + O2.
Данный метод позволяет получить чистый водород и кислород. Процесс превращения химических веществ в другие вещества под действием электричества называется электролизом.
Электролиз – химическая реакция, протекающая под действием электрического тока Проведем электролиз воды. В стакан наполненный водой, опустим металлические электроды. Поверх электродов опустим в стакан пробирки, заполненные водой. Подсоединим электроды к источнику тока – батарейке. В пробирках наблюдается выделение газов – водорода и кислорода, которые вытесняют воду. Наблюдая за процессом электролиза, можно заметить, что в одной из пробирок газа собирается в два раза больше, чем в другой. Проанализировав уравнение реакции электролиза воды, можно сделать вывод, в какой пробирке выделяется водород, а в какой – кислород. Попробуйте это сделать самостоятельно.
Существуют и другие способы получения водорода. Железо-паровой метод долгое время широко применялся в промышленности. Через электрическую трубчатую печь проходит трубка из нержавеющей стали, заполненная железными стружками. Через трубку с железными стружками пропускают водяной пар. При температуре около 800°С пары воды взаимодействуют с железом, образуя оксид Fe3O4 (железную окалину) и газообразный водород:
3Fe + 4Н2О = 4Н2 + Fe3O4.
Можно получить Н2, пропуская Н2О через слой раскаленного угля. При этом образуется смесь двух газов – СО и Н2 (водяной газ):
Н2О + С = CO + Н2
В настоящее время водород получают взаимодействием углеводородов (в основном метана, СН4) с водяным паром или неполным окислением метана кислородом:
2СН4 + О2 = 2СО + 4Н2
Итог статьи:
- В лаборатории водород получают в аппарате Киппа
- Исходными веществами для получения водорода в лаборатории являются некоторые металлы и кислоты
- Собирать водород нужно методом вытеснения воды, или методом вытеснения воздуха, расположив пробирку вверх дном по отношению к газоотводной трубке
- Кислота – сложное вещество, в состав которого входят атомы водорода и кислотный остаток
- Обнаружить водород можно по характерному хлопку при поднесении пробирки с водородом к пламени
- Одним из промышленных способов получения водорода является электролиз воды
- Электролиз – химическая реакция, протекающая под действием электрического тока
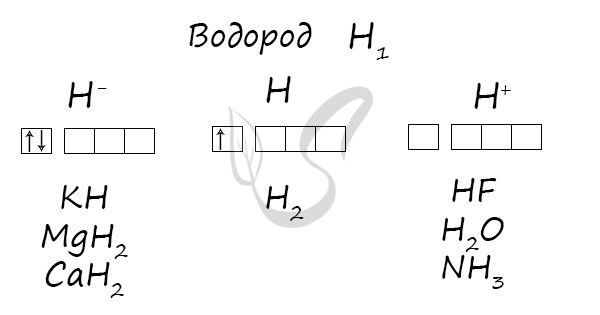
Водород
Водород (лат. hydrogenium = греч. ὕδωρ — вода + γεννάω — рождаю) — самый легкий химический элемент, при обычных условиях — газ без цвета, запаха и вкуса. В соединении с кислородом образует воду.
Водород — самый распространенный элемент Вселенной, входит в состав всего живого и небесных тел (73% массы Солнца).
Степени окисления
Проявляет степени окисления: -1, 0, +1.
Получение
В промышленности водород получают различными методами:
- Конверсия с водяным паром при t = 1000 °C
Методом газификации угля, торфа, сланца
Электролизом водных растворов щелочей
Каталитическим окислением кислородом (неполное окисление)
Лабораторные методы традиционно отличаются от промышленных своей простотой. В лаборатории водород получают:
- Вытеснением водорода из кислот
Взаимодействием активных металлов с водой
Реакцией цинка или алюминия с раствором щелочи
Химические свойства
В реакциях водород проявляет себя как восстановитель и окислитель. Как восстановитель реагирует с элементами, электроотрицательность которых выше, чем у водорода:
Как восстановитель реагирует с кислородом, галогенами, азотом, серой, оксидами металлов. При комнатной температуре из перечисленных реакция идет только со фтором.
H2 + F2 → HF (со взрывом в темноте)
H2 + Cl2 → (t) HCl (со взрывом только на свету)
Na + H2 → NaH (гидрид натрия)
Химические свойства:
- Реакция с металлами
Металлы, стоящие в ряду активности до водорода, вытесняют водород из воды.
Реакции с основными и кислотными оксидами
Реагирует с основными оксидами — с образованием оснований (реакция идет, если основание растворимо), и с кислотными оксидами — с образованием соответствующих кислот. Не забывайте сохранять степени окисления!
Отмечу здесь реакцию двойного гидролиза, которая заключается в гидролизе одной соли по катиону (CrBr3), а другой — по аниону (Na2CO3).
Реакция с гидридами активных металлов
Реакции с C, CO, CH4
Cl2 + H2O → HCl + HClO (соляная и хлорноватистая кислоты — без нагревания)
Cl2 + H2O → HCl + HClO3 (соляная и хлорноватая кислоты — при нагревании)
Кристаллогидраты
Кристаллогидраты — кристаллические соединения, содержащие молекулы воды как самостоятельные структурные единицы. Вода, входящая в состав кристаллогидратов, называется кристаллической. Примеры: CaSO4*2H2O, Na2SO4*10H2O.
При нагревании кристаллогидраты теряют воду. Одним из наиболее известных кристаллогидратов является медный купорос: CuSO4*5H2O. Медный купорос имеет характерный голубой цвет, а безводный сульфат меди — белый.
В задачах бывает дана масса медного купороса. Надо помнить о том, что часто в реакции не участвует кристаллическая вода. В таком случае следует вычесть кристаллизационную воду и найти массу безводного сульфата калия.
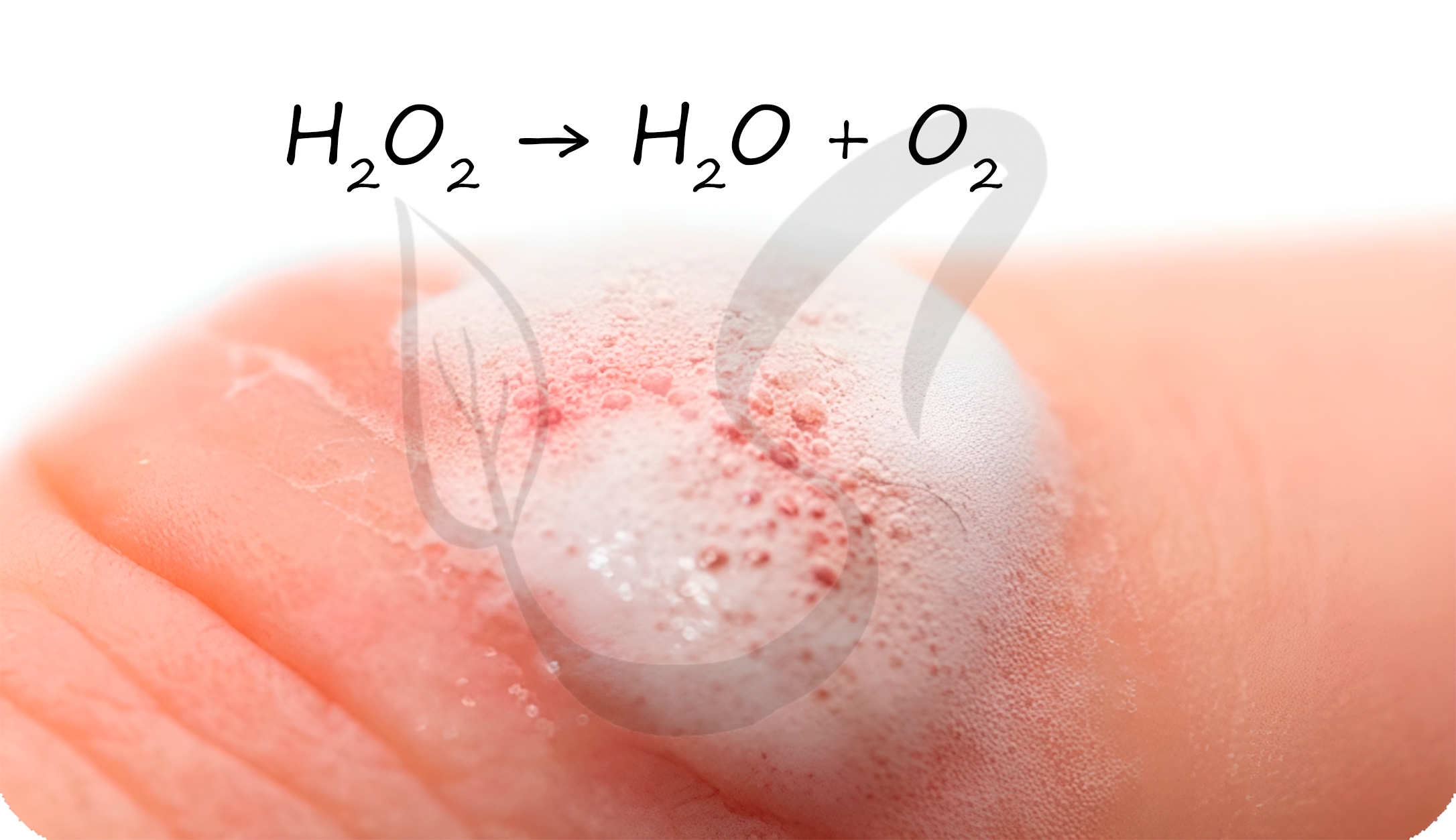
Пероксид водорода
Представляет собой бесцветную жидкость с металлическим вкусом. Концентрированные растворы пероксида водорода взрывоопасны.
Получают пероксид водорода в реакции с пероксидами и супероксидами металлов.
В разбавленных растворах пероксид водорода легко разлагается:
Также перекись проявляет окислительные свойства:
Перекисью водорода обрабатывают раневую поверхность. Выделяющийся при разложении атомарный кислород разрушает бактериальные клетки, предотвращая осложнение в виде бактериальной инфекции.
© Беллевич Юрий Сергеевич 2018-2022
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Водород – рождающий воду
Содержание
При горении водорода в кислороде образуется чистое, некоптящее и не имеющее четких границ пламя температурой до 2800°С.
Теоретически для полного сгорания 1 мг водорода требуется 0,5 мг кислорода. Практически в горелку на 1 мг водорода подается 0,25 мг кислорода.
История открытия водорода
Доподлино установить кто открыл водорода невозможно, поскольку он известен с XVI века. Алхимики заметили, что при взаимодействии железных опилок с соляной или серной кислотой выделяется «горючий воздух», или «искусственный воздух». Однако его все-таки считали воздухом, получившим почему-то способность гореть.
Но вот сторонник точных измерений Генри Кавендиш (Henry Cavendish) выделил водород из серной и соляной кислот железом, цинком, оловом. Он собирал его в газометре и узнал, что при горении «горючего воздуха» образуется чистая вода. Поэтому считается, что лавры открытия водорода принадлежат именно ему.
Однако окончательное суждение о «горючем газе», так же как и о кислороде, принадлежит Антуану Лорану Лавуазье (Antoine Laurent de Lavoisier). Он повторил опыт Кавендиша, поставил новые опыты и доказал, что «горючий воздух» — это простое вещество, что вода не простое тело, а химическое соединение двух элементов — водорода и кислорода. Лавуазье дал имя «горючему воздуху» hydrogene (от греч. «рождающий воду») .
Интересны первые русские наименования водорода: «водотворный газ», «водотвор». Легкость водорода, пожалуй, поразила первых наблюдателей больше, чем остальные его свойства. Думали даже, что он и есть тот таинственный с «отрицательным весом» флогистон, который, проникая в тела, сообщает им способность гореть.
В 1794 г. к водороду возник чисто военный интерес. В то время уже были изобретены воздушные шары, наполненные горячим воздухом, — монгольфьеры Их называли так в честь братьев французов Монгольфье, совершивших первый полет на таком аэростате в 1783 г.
Преимущества водорода перед нагретым воздухом были очевидны. Нагретый воздух обладал подъемной силой, пока он не остывал до температуры окружающего воздуха. Следовательно, чтобы совершить более или менее длительный полет, надо было под отверстием аэростата в гондоле пилота поддерживать огонь, подогревать воздух. Конечно, это было опасно и приводило к трагическим катастрофам. А водород всегда будет легче воздуха более чем в 14 раз. И его не надо нагревать, наоборот — беречь от огня.
Лавуазье разработал промышленный способ получения водорода, названный «железо-паровым». Заключался он в следующем. Пары воды из котла поступали в железные трубы, наполненные железными стружками. Трубы накалялись в жаровнях — протекала химическая реакция вытеснения водорода железом из воды с образованием железной окалины:
Избыток водяных паров, непрерывно поступающих в трубу, проходил через холодильник, а водород по трубам направлялся в аэростат и надувал его.
Когда железо израсходуется, его опять можно получить из накаленной окалины, если через трубу пропустить светильный газ. Уравнение показывает, что 3?56=168 г железа могут вытеснить 8 г водорода, или 4?22,4=89,6 л водорода.
Аэростаты, наполненные водородом, применили впервые революционные войска Франции в битве при Флёрюсе в 1794 г.
В войнах 1904-1905 и 1914-1918 гг. привязанные канатами аэростаты служили главным образом для наблюдения за прицельностью артиллерийского огня, за передвижением войск. Во время Великой Отечественной войны 1941-1945 гг. они защищали военные объекты от авиации противника. Летчики, опасаясь столкновений с аэростатом и канатами, летали на большой высоте, поэтому их бомбовые удары в значительной мере теряли прицельность.
Первый в мире полет на аэростате с научной целью совершил ученый Захаров Яков Дмитриевич в 1804 г. А в 1887 г. для наблюдения солнечного затмения и изучения воздуха поднялся в воздух Менделеев Дмитрий Иванович.
Получение водорода
В промышленности технический водород получают:
- электролизом воды;
- методом глубокого охлаждения газовых смесей, содержащих водород;
- железо-паровым способом;
- из водяного газа путем окисления содержащейся в нем окиси углерода водяным паром в присутствии катализатора;
- в специальных водородных генераторах воздействием серной кислоты на железную стружку и цинк.
Получение водорода из кислот
На первых порах источником для получения водорода служили кислоты. Так и в наше время в лабораториях часто получают его средневековым способом — действием цинка на серную кислоту. Реакция протекает по уравнению:
Вместо цинка можно взять железо в виде стружек или алюминий. Водород получается, загрязненный побочными продуктами разложения серной кислоты, и, если это требуется, его приходится очищать.
Добыча водорода из промышленных газов
Огромные количества водорода, необходимые современной промышленности, получают сейчас электролизом раствора щелочи и извлекают из промышленных газов — коксовальных печей, газов, получаемых при переработке нефти и др.
При переработке каменного угля на кокс дополнительно получается деготь и коксовый газ. В состав газа входит до 50-60% водорода (H2), 20-25% метана (СН4), окись углерода (СО), азот (N) и др.
В статье о свойствах гелия и способах его производства описан процесс получения гелия методом фракционной конденсации. Так же поступают и с коксовым газом. Но чтобы отделить водород от других составных частей, требуется очень глубокое охлаждение из-за низкой критической температуры водорода.
Производство водорода из воды
Наиболее широко распространенным способом производства водорода является — электролиз дистиллированной воды. В результате чего получают водород, кислород и некоторые примеси.
Единственным исходным сырьем для добычи водорода электролитическим методом служит вода. Чистая, дистиллированная вода обладает огромным сопротивлением и почти совершенно не проводит электрический ток. Вот почему для того чтобы сделать воду электропроводной, в ней нужно растворить какую-нибудь соль, кислоту или основание, которые дают ионы.
Через водный раствор щелочи (например: каустическая сода) пропускают постоянный электрический ток. При этом вода разлагается, и на отрицательном электроде (катоде) выделяется водород, а на положительном электроде (аноде) — кислород, также являющийся важным промышленным продуктом.
В результате получения 2 м 3 водорода, как побочный продукт получается 1 м 3 кислорода.
Большой расход электроэнергии является главным недостатком данного способа, поэтому применение водорода полученного при помощи электролиза целесообразно при одновременном использовании вместе с кислородом. В связи с этим в последнее время портативные водородные сварочные аппараты для газовой сварки и пайки пользуются все большей популярностью.
Применение водорода
Основными направлениями применения водорода являются:
- химическая промышленность – синтез аммиака, метанола, углеводородов;
- пищевая промышленность – получение пищевых белков;
- нефтехимия – нефтепереработка (гидрогенезационная очистка нефтепродуктов);
- автотранспорт – автомобили на газообразном и жидком водороде;
- машиностроение – для сварки и резки металлов.
Применение водорода в сварке
Водород использовался в качестве защитного газа еще при первых попытках защиты дугового пространства от воздуха. Однако водород может оказать в ряде случаев вредное воздействие. Это объясняется тем, что при применении водорода в металле сварных швов образуются дефекты в виде пор, а также является одним из главных факторов образования холодных трещин. С увеличением толщины свариваемых элементов пористость в металле сварных швов становится значительной. Поэтому его использование в дальнейшем было значительно ограничено. В чистом виде (и в виде водородно-азотных смесей, получаемых при диссоциации аммиака) он в настоящее время применяется при атомно-водородной сварке (хотя и сам этот способ заменен теперь другими, в частности сваркой неплавящимся электродом).
Если струю водорода пропускать через пламя вольтовой дуги, то водород диссоциирует на атомы с поглощением значительного количество тепла (103,6 ккал/моль) что приводит к значительному увеличению напряжения дуги. Она становится устойчивой только при повышении напряжения источника тока. Так, например, при режимах атомно-водородной сварки наиболее эффективной «звенящей» дугой при вольфрамовых электродах и силе тока 10-20 А напряжение дуги составляет около 100 А, напряжение холостого хода питающего источника должно быть не менее 200-220 В (обычно около 300 В). В этом случае водород является не только защитным газом, но и переносит тепловую энергию из дуги на поверхность не включенного в цепь тока изделия.
Образовавшийся атомный водород направляют на твердую свариваемую поверхность, где происходит нагревание и расплавление металла за счет поглощения тепла, которое выделяется при рекомбинации атомов до молекулярного водорода. Ассоциация атомарного водорода на холодной поверхности металла (в том числе и расплавленной, так как температура плавления большинства металлов ниже температуры возможного существования заметных количеств атомарного водорода) приводит к выделению тепла, потребленного в дуге на диссоциацию. За счет выделяющегося тепла температура свариваемой поверхности металла повышается до 3528-4028°С. Такая атомно-водородная сварка позволяет обрабатывать и сваривать самые тугоплавкие металлы, высококачественные стали, коррозионно-устойчивые материалы, цветные металлы.
Несмотря на то, что атмосфера, окружающая металл, при атомно-водородной сварке представляет собой смесь молекулярного и атомарного водорода, при отсутствии на металле значительного количества окислов швы получаются достаточно плотными и применительно к низкоуглеродистой стали не имеют большого количества диффузионно-подвижного и остаточного водорода.
При струйной защите иногда используется водяной пар. Однако в этом случае получается значительно меньшая стабильность качества сварных швов, чем при сварке с защитой дуги углекислым газом. В связи с этим такой процесс широкого распространения не получил.
При TIG сварке аустенитной нержавеющей стали с целью увеличения напряжения дуги, увеличения теплоэффективности и снижения оксидирования используют аргоно-водородные смеси газов (15% Н2). Более высокая температуру и сжатие дуги, в свою очередь увеличивает глубину проплавления металла. Однако при этом необходимо учитывать возможность вредного влияния растворяющегося в металле водорода. Более широко водород применяют в специальных областях сварки и металлургии, например в порошковой металлургии при спекании изделий из порошковых материалов.
В других случаях применение водорода и водородосодержащих газов, как защитных при дуговой сварке, нецелесообразно.
Применяют водород для составления плазмообразующих смесей при плазменной сварке и резке. Так, для защиты сварочной ванны от окисления при плазменной сварке легированной стали, меди, никеля и сплавов на его основе используют смесь аргона с 5-8% водорода.
Аргоно-водородную смесь, имеющую до 20% Н2, применяют при микроплазменной сварке. Наличие водорода в смеси обеспечивает сжатие столба плазмы, делает его более сконцентрированным. Кроме того, водород создает необходимую в ряде случаев восстановительную атмосферу.
Взрывоопасность водорода
При работе с водородом особое внимание следует обращать на герметичность аппаратуры и газовых коммуникаций, так как водород способен проникать через мельчайшие неплотности, образовывать с воздухом взрывоопасные концентрации. В смеси с кислородом (2:1) образует взрывчатую смесь, называемую гремучим газом.
- с воздухом 4-75 %
- с кислородом 4-96%
Температура самовоспламенения 510°С. Водород физиологически инертен, при высоких концентрациях вызывает удушье. При высоком давлении проявляется наркотическое действие. При работе в среде водорода необходимо пользоваться изолирующим противогазом (кислородным или шланговым).
Хранение и транспортировка водорода
Водород технический поставляют по ГОСТ 3022. Хранят и транспортируют водород в стальных баллонах вместимостью 40 и 50 дм 3 по ГОСТ 949 под давлением 15 МПа. Баллон окрашивается в темно-зеленый цвет с красной надписью «ВОДОРОД».
Характеристика водорода
Характеристики H2 представлены в таблицах ниже:
Коэффициенты перевода объема и массы H2 при Т=15°С и Р=0,1 МПа
| Масса, кг | Объем | |
|---|---|---|
| Газ, м 3 | Жидкость, л | |
| 0,0841 | 1 | 1,188 |
| 0,0708 | 0,842 | 1 |
| 1 | 11,891 | 14,126 |
Коэффициенты перевода объема и массы H2 при Т=0°С и Р=0,1 МПа
| Масса, кг | Объем | |
|---|---|---|
| Газ, м 3 | Жидкость, л | |
| 0,09 | 1 | 1,258 |
| 0,0708 | 0,975 | 1 |
| 1 | 11,124 | 14,126 |
Водород в баллоне
| Наименование | Объем баллона, л | Масса газа в баллоне, кг | Объем газа (м 3 ) при Т=15°С, Р=0,1 МПа |
|---|---|---|---|
| H2 | 40 | 0,54 | 6,0 |
Благодаря этой таблице теперь можно легко дать ответы на вопросы, которые очень часто задают сварщики:
- Сколько кубов (м 3 ) водорода в 40 литровом баллоне?
Ответ: 6,0 м 3 - Сколько кг водорода в баллоне?
Ответ: 0,54 кг - Сколько весит баллон с водородом?
Ответ:
58,5 кг — масса пустого баллона из углеродистой стали согласно ГОСТ 949;
0,54 — кг масса водорода в баллоне;
Итого: 58,5 + 0,54 = 58,94 кг вес баллона с водородом.
Рекомендуем к просмотру видео об открытии водорода, его характеристиках и производстве.
http://studarium.ru/article/162
http://weldering.com/vodorod-rozhdayushchiy-vodu