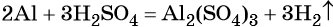Изменения,
происходящие с веществами
Химическое превращение, химическая реакция
есть главный предмет химии.
Н.Н.Семенов
Цели и задачи урока.
О б у ч а ю щ и е. Систематизировать знания учащихся о химических реакциях, повторить простейшие расчеты по химическим уравнениям.
Р а з в и в а ю щ и е. Продолжить развитие умений объяснять смысл изученных понятий, применять эти понятия, устанавливать причинно-следственные связи, делать выводы, наблюдать и объяснять результаты демонстрационного эксперимента.
В о с п и т а т е л ь н ы е. Продолжить формирование научного мировоззрения, таких качеств личности, как ответственное отношение к порученному делу, умение объективно оценивать результаты своего труда.
Методы и методические приемы.
2. Графический диктант.
3. Выполнение упражнений.
4. Демонстрация опытов.
5. Решение задач.
Оборудование и реактивы. Kодоскоп со слайдами, пробирки, спиртовка, пробиркодержатель, спички, лучина; гидрокарбонат натрия (твердый), медная проволока.
Подготовка к уроку. За две недели до урока дается задание сочинить сказку, в которой говорилось бы о каких-либо типах химических реакций, а на предыдущем уроке – повторить данную тему по учебнику О.С.Габриеляна «Химия. 8 класс» (М.: Дрофа, 2001), § 25–28.
Учитель. На предыдущих уроках мы с вами изучали изменения, происходящие с веществами, познакомились с различными классификациями химических реакций, выражали их сущность с помощью химических уравнений, проводили по ним расчеты. На этом уроке нам нужно повторить и систематизировать полученные знания. В течение занятия вы будете выполнять задания, проверять правильность их выполнения и оценивать. Отметки за выполнение задания будете заносить в лист самоконтроля.
2. Вводное слово
Учитель. Все многообразие химических веществ возникло благодаря процессам, называемым химические реакции. Они – подлинная душа химии, ее главное содержание. Невозможно даже приблизительно подсчитать, сколько химических реакций происходит в мире, скажем, в течение всего лишь одной секунды. Мы говорим, думаем, радуемся, печалимся – и за всем этим скрываются миллионы химических реакций.
3. Фронтальная беседа
Учитель. Kакие явления называют химическими?
Ученик. Химическими явлениями называют такие явления, при которых из одних веществ образуются другие, новые.
Учитель. Чем химические явления отличаются от физических?
Ученик. При физических явлениях происходит изменение агрегатного состояния, формы, размера частиц, но не меняется состав веществ, а при химических явлениях из одних веществ образуются другие, новые.
Учитель. Kогда вещества вступают во взаимодействие друг с другом, они обычно дают знать об этом. Назовите признаки, по которым мы можем определить, что произошла химическая реакция.
Ученик. Признаки химических реакций:
появление или исчезновение запаха;
выпадение или исчезновение осадка;
выделение или поглощение теплоты.
4. Графический диктант
Учитель. Сейчас давайте проверим, как вы поняли, какие явления относят к физическим, а какие – к химическим. Проведем графический диктант. Если вы считаете правильным ответом «физическое явление», то ставите знак «–», а если – «химическое явление», ставите знак «^».
Задание 1. Определите, какие явления в приведенном перечне являются физическими, а какие – химическими:
• кипение воды;
• образование на деревьях инея;
• скисание молока;
• ржавление гвоздя;
• таяние льда;
• горение бенгальских огней;
• гниение растений;
• приготовление сахарного сиропа;
• приготовление сахарной пудры из сахара;
• горение свечи.
Учащиеся меняются работами с соседями по парте, проверяют правильность выполнения работ и выставляют отметки, используя предложенные критерии:
Правильный ответ: 
Ответ проецируется на экран с помощью кодоскопа.
5. Фронтальная беседа
Учитель. Для протекания химических реакций необходимо создать определенные условия. Назовите эти условия.
Ученик. Для протекания химических реакций необходимы следующие условия:
измельчение (растворение) веществ;
пропускание электрического тока;
Учитель. Сущность химических реакций выражается с помощью химических уравнений. Что мы называем xимическим уравнением?
Ученик. Химическим уравнением называют условную запись химической реакции с помощью химических формул и коэффициентов перед ними, а также математических знаков.
Учитель. На основе какого закона составляют химические уравнения?
Ученик. Химические уравнения составляют на основе закона сохранения массы веществ при химических реакциях.
Учитель. Сформулируйте закон сохранения массы веществ.
Ученик. Масса веществ, вступивших в реакцию, равна массе веществ, получившихся в результате этой реакции.
Учитель. Kем был открыт закон сохранения массы веществ?
Ученик. Закон сохранения массы веществ при химических реакциях был открыт великим русским ученым М.В.Ломоносовым.
3адание 2. Определите, какие из предложенных ниже записей можно назвать химическим уравнением:
а) H2 + Сl2 
б) 2Са + O2 
в) Сu(ОН)2 
г) Zn + НСl 
Ответ. уравнения химических реакций – б), в).
Ответ проецируется с помощью кодоскопа на экран. Учащиеся осуществляют самопроверку и самооценку результатов работы.
Учитель. Распределение объектов и явлений по классам, группам, семействам на основе их общих признаков называют классификацией. Kлассификация облегчает изучение объектов и явлений. При изучении химии вы встречались с классификацией химических элементов, веществ, а также химических реакций. По каким признакам классифицируют химические реакции?
Ученик. Химические реакции классифицируют по тепловому эффекту, а также по числу исходных веществ и продуктов реакции.
Учитель. На какие типы делят химические реакции по тепловому эффекту?
Ученик. По тепловому эффекту реакции делят на экзотермические, протекающие с выделением теплоты, и эндотермические, протекающие с поглощением теплоты.
Учитель. Приведите примеры экзо- и эндотермических реакций.
Ученик. Экзотермические реакции: горение бенгальских огней, горение свечи. Эндотермические реакции: разложение воды, разложение малахита.
6. Выполнение упражнений
Задание 3. Определите, какие реакции в данном перечне относятся к экзо-, а какие к эндотермическим:
в) Fе + S = FеS + 95,4 кДж;
д) СаСO3 + 175,7 кДж = СаО + CO2.
Ответ. экзотермические реакции – б), в); эндотермические реакции – а), г), д).
Ответ с помощью кодоскопа проецируется на экран. Учащиеся осуществляют самопроверку и самооценку результатов работы. Для наглядности демонстрируется схема.
7. Фронтальная беседа
Учитель. В классификации по числу и составу исходных веществ и продуктов реакции вы познакомились с такими типами химических реакций, как реакции разложения, соединения, замещения и обмена. Kакие реакции называют реакциями разложения? Приведите примеры.
Ученик. Реакциями разложения называют такие реакции, при которых из одного вещества образуется два или несколько новых. Например, разложение малахита, разложение воды.
Учитель. Kакие реакции называют реакциями соединения? Приведите примеры.
Ученик. Реакциями соединения называют такие реакции, при которых из нескольких веществ образуется одно новое вещество. Например, образование воды из кислорода и водорода, получение сульфида железа из железа и серы.
Учитель. Kакие реакции называют реакциями замещения? Приведите примеры.
Ученик. Реакциями замещения называют такие реакции, при которых атомы простого вещества замещают атомы одного из элементов в сложном веществе. Например, получение водорода в реакции цинка с соляной кислотой, взаимодействие железного гвоздя с раствором сульфата меди(II).
Учитель. Kакие реакции называют реакциями обмена? Приведите примеры.
Ученик. Реакциями обмена называют такие реакции, при которых два сложных вещества обмениваются своими составными частями. Например, взаимодействие соляной кислоты с гидроксидом натрия.
8. Выполнение упражнений
Учитель. Сейчас послушаем сказку и определим, о каких типах реакций в ней говорится.
Ученица (Л.Хайсарова читает сказку «Семейные узы»). Жил-был мальчик алюминчик (Al). У него была мечта жениться на прекрасной Золушке – Соляной Kислоте (HCl). И вот его мечта сбылась: он встретил свою Золушку и женился на ней.
Через положенный срок у них родились двойняшки – Хлорид Алюминия и Водород:
Трудно было найти двух более несхожих двойняшек: Хлорид Алюминия был степенный и неприметный, а Водород – легкий и взрывоопасный. Дети росли, а родители старели.
Перед смертью отец с матерью пообещали оставить все свое богатство тому, у кого первого родится наследник. И это произошло ровно через 25 лет после рождения двойняшек. У молодых родителей АlCl3 и NаОН родились наследники:
Один из них – гидроксид алюминия (Al(ОН)3) – имел амфотерный характер, мог ладить и с кислотами, и со щелочами.
Другой же – Хлорид Натрия (NaCl) – был истинным представителем класса солей. Дети выросли, завели свои семьи, но всю жизнь помнили своих родственников.
Учитель. О каких типах химических реакций идет речь в сказке?
Ученик. Речь идет о реакциях замещения и обмена.
9. Демонстрация опытов
Учитель. А сейчас ученики-лаборанты продемонстрируют нам опыты. Ваша задача – определить тип химической реакции.
1-й лаборант (проделывает опыт и комментирует его). Пробирку, в которой находится порошок гидрокарбоната натрия (питьевая сода), укрепляю в пробиркодержателе и нагреваю на пламени спиртовки. Обратите внимание, что на стенках пробирки образуются капельки воды. Подношу к отверстию пробирки горящую лучинку. Лучинка гаснет, т.к. один из продуктов реакции – углекислый газ. После реакции в пробирке остается еще твердое вещество – карбонат натрия Na2CO3:
2NaHCO3 

Ученик. Данная реакция относится к реакциям разложения.
2-й лаборант. Нагреваю медную проволоку на пламени спиртовки. Ее поверхность покрывается черным налетом – оксидом меди(II):
2Сu + O2 
Ученик. Данная реакция относится к реакциям соединения.
10. Выполнение заданий
Учитель. При выполнении следующего задания необходимо показать свое умение расставлять коэффициенты.
Задание 4. Расставьте коэффициенты в схемах реакций и определите их тип:
а) Li + N2 
б) Zn + H2SO4 
в) H2SO4 + BaCl2 
г) KNO3 
Ответы с помощью кодоскопа проецируются на экран. Учащиеся осуществляют самопроверку и самооценку результатов работы.
а) 6Li + N2 = 2Li3N – реакция соединения;
г) 2KNO3 = 2KNO2 + O2 – реакция разложения.
Учитель. Для выполнения следующего задания нужно уметь по названиям веществ составлять их химические формулы.
Задание 5. Напишите уравнения реакций по схемам, определите типы химических реакций:
а) оксид кальция + вода 
б) оксид меди(II) + углерод 
в) серная кислота + гидроксид калия 
г) хлорид серебра 
Ответы с помощью кодоскопа проецируются на экран. Учащиеся осуществляют самопроверку и самооценку результатов работы.
а) СаО + Н2О = Са(ОН)2 – реакция соединения;
б) 2СuO + C = 2Cu + CO2 – реакция замещения;
г) 2AgCl = Cl2 + 2Аg – реакция разложения.
11. Расчеты по химическим уравнениям
Учитель. При выполнении следующих заданий необходимо показать свое умение производить расчеты по химическим уравнениям.
Задание 6. Выполните расчеты.
В а р и а н т 1. Вычислите массу оксида алюминия, который образуется при сгорании 54 г порошкообразного алюминия.
В а р и а н т 2. Kакую массу воды нужно подвергнуть разложению электрическим током, чтобы получить 1,12 л (н.у.) водорода?
В а р и а н т 3. Вычислите количество вещества кислорода, которое потребуется для сжигания порошка магния массой 12 г.
Ответы с помощью кодоскопа проецируются на экран. Учащиеся осуществляют самопроверку и самооценку результатов работы.
Ответы. В а р и а н т 1 – 102 г; в а р и а н т 2 – 0,9 г; в а р и а н т 3 – 0,25 моль.
12. Заключительная часть
Учитель. Используя лист самоконтроля, выставьте себе оценку за урок.
Домашнее задание. Заполните таблицу – запишите уравнения реакций, укажите их тип.
| Реагенты | Mg | Al | Cu |
|---|---|---|---|
| O2 | |||
| HCl | |||
| CuCl2 |
Л и т е р а т у р а
Власов Л., Трифонов Д. Занимательно о химии. М.: Молодая гвардия, 1968;
Габриелян О.С. Химия-8. М.: Дрофа, 2001;
Габриелян О.С., Смирнова Т.В. Изучаем химию в 8 классе. М.: Блик и Kо, 2001;
Габриелян О.С. Настольная книга учителя химии. 8 класс. М.: Блик и K°, 2001;
Долгань Е.K. Инновации и современные технологии в обучении химии. Kалининград:
Изд-во KГУ, 2000;
Журин А.А. Химические уравнения, дидактический материал. М.: Аквариум, 1998;
Малышкина В. Занимательная химия (сер. «Нескучный учебник»). СПб.: Тригон, 1998;
Савич Т.З. Формирование понятий о химической реакции. М.: Просвещение, 1978;
Сгибнева Е.П., Скачков А.В. Современные открытые уроки химии. 8–9 классы. Ростов-на-Дону: Феникс, 2002;
Фадеев Г.Н. Химические реакции. М.: Просвещение, 1980.
Изменения происходящие с веществами химические уравнения
Контрольная работа 3 по химии в 8 классе «Изменения, происходящие с веществами» с ответами (2 варианта). УМК Габриелян О.С. (Дрофа). Поурочное планирование по химии для 8 класса (Ястребова О.Н). Урок 44. Контрольная работа по теме «Изменения, происходящие с веществами». Цитаты из пособия использованы в учебных целях. Химия 8 Габриелян Контрольная работа № 3.
Контрольная работа № 3
«Изменения, происходящие с веществами»
Цели урока : проверка знаний и умений учащихся, степени усвоения ими учебного материала.
Тип урока : урок развивающего контроля.
Оборудование : карточки с заданиями, справочные таблицы.
ХОД УРОКА
1. Организационный момент
Мотивация к учебной деятельности. Учитель сообщает тему урока, формулирует цели урока.
2. Выполнение контрольной работы
Контрольная работа по химии. Вариант 1
Базовый уровень
A1. Физическое явление — это
1) скисание молока; 2) горение керосина;
3) плавление железа; 4) подгорание пищи.
А2. Укажите на признак реакции, протекающей при гниении белка.
1) растворение осадка; 2) выделение энергии;
3) появление запаха; 4) образование осадка.
А3. Укажите уравнение эндотермической реакции.
1) 2SO2 + O2 = 2SO3 + Q; 2) СаСO3 → СаО + СO2 – Q;
3) 2НСl + Zn = ZnCl2 + H2 + Q; 4) N2 + H2 → NН3 + Q.
A4. Какая из реакций является реакцией замещения?
А5. Составьте уравнение реакции по схеме: Аl + O2 = Аl2O3, и определите сумму всех коэффициентов.
1) 4; 2) 6; 3) 9; 4) 1.
А6. Укажите фактор, влияющий на скорость химической реакции.
1) вода; 2) воздух; 3) температура; 4) свет.
А7. Найдите объем водорода, который полностью прореагирует в реакции H2 + Сl2 = 2НСl с 0,5 моль хлора (н. у.).
1) 5,6 л; 2) 11,2л; 3) 22,4 л; 4) 44,8 л.
А8. Укажите схему, являющуюся уравнением химической реакции.
1) СаСO3 → СаО+ СO2, 2) Са + O2 → СаО;
3) Mg + НСl → MgCl2 + H2; 4) СО + O2 → СO2.
А9. По левой части уравнения ZnO + 2НСl = … восстановите его правую часть.
A10. Атомы простого вещества замещают атомы одного из элементов в сложном веществе в реакции:
1) соединения; 2) обмена; 3) разложения; 4) замещения.
Повышенный уровень
В1. По схеме запишите уравнение и укажите тип реакции: гидроксид натрия + хлорид меди (II) = гидроксид меди (II) + хлорид натрия.
В2. По уравнению реакции Fe(OH)2 = FeO + H2O определите массу оксида железа (II), образовавшегося при разложении 75 г исходного вещества.
В3. Расставьте коэффициенты в схемах, укажите типы химических реакций:
1) МnO2 + H2 → Мn + H2O; 2) Аl + Cl2 → AlCl3.
В4. Запишите план разделения смеси речного песка и поваренной соли.
В5. Восстановите символы в уравнениях реакций, укажите типы реакций:
Контрольная работа по химии. Вариант 2
Базовый уровень
A1. Химическое явление – это:
1) дробление камня; 2) испарение керосина;
3) плавление железа; 4) подгорание пищи.
А2. Укажите признак реакции, протекающей при горении парафина.
1) растворение осадка; 2) выделение энергии;
3) появление запаха; 4) образование осадка.
А3. Укажите уравнение экзотермической реакции.
1) 2SO3 = 2SO2 + O2↑ – Q; 2) 2HgO = 2Hg + O2↑ – Q;
3) Zn + 2HCI = ZnCl2 + H2 + Q; 4) CaCO3 → CaO + CO2 – Q.
A4. Укажите уравнение реакции обмена.
А5. Определите сумму всех коэффициентов в уравнении Р + O2 = Р2O5.
1) 7; 2) 9; 3) 11; 4) 1.
А6. Какие факторы влияют на скорость химической реакции?
1) вода; 2) воздух; 3) свет; 4) катализатор.
А7. Найдите объем хлора, который полностью прореагирует в реакции H2 + Сl2 = 2НСl с 0,5 моль водорода (н. у.).
1) 5,6 л; 2) 11,2л; 3) 22,4 л; 4) 33,6 л.
А8. Укажите схему, являющуюся уравнением химической реакции.
1) Р + О2 = Р2O5; 2) Са + S → CaS;
3) Mg + НСl → MgCl2 + H2; 4) СО + O2 → СO2.
А9. По левой части уравнения СаО + 2НCl = … восстановите его правую часть.
A10. Реакция, в результате которой из одного сложного вещества образуется два или несколько веществ, называется реакцией
1) замещения; 2) обмена; 3) разложения; 4) соединения.
Повышенный уровень
В1. По схеме запишите уравнение и укажите тип реакции: натрий + вода = гидроксид натрия + водород.
В2. По уравнению реакции Cu(OH)2 = СuО + H2O определите массу оксида меди (II), образовавшегося при разложении 98 г исходного вещества.
В3. Расставьте коэффициенты в схемах, укажите типы химических реакций:
1) СuО + H2 → Сu + H2O; 2) Cr + Cl2 → СrСl3.
В4. Запишите план разделения смеси древесных, железных опилок и поваренной соли.
В5. Восстановите символы в уравнениях реакций, укажите типы реакций:
1) … + H2SO4 → CuSO4 + H2O; 2) 2Аl + … → 2АlСl3.
3. Рефлексия учебной деятельности
В конце урока учитель раздает на каждую парту краткую запись с ответами на контрольную работу.
Ответы на контрольную работу. Вариант 1
Базовый уровень
A1. 3) плавление железа.
А2. 3) появление запаха.
А3. 2) СаСO3 → СаО + СO2 – Q.
A4. 2) СuО + H2 = Сu + H2O.
А5. 3) 9.
А6. 3) температура.
А7. 2) 11,2 л.
А8. 1) СаСO3 → СаО+ СO2.
A10. 4) замещения.
Повышенный уровень
В1. 2NaOH + CuCl2 = Сu(ОН)2 + 2NaCl. Реакция обмена.
В2. Решение.
n(FeO) = n(Fe(OH)2) = m(Fe(OH)2) : M(Fe(OH)2) = 75 г : 90 г/моль = 0,833 моль;
m(FeO) = n(FeO) • M(FeO) = 0,833 моль • 72 г/моль = 60 г.
Ответ: m(FeO) = 60 г.
В3.
1) МnO2 + 2H2 → Мn + 2H2O реакция замещения;
2) 2Аl + 3Cl2 → 2AlCl3 реакция соединения.
В4. Смесь можно разделить растворением соли в воде, фильтрованием песка и выпариванием соли.
В5.
1) Zn + H2SO4 = ZnSO4 + H2 реакция замещения;
2) 4Al + 3O2 = 2Аl2O3 реакция соединения.
Ответы на контрольную работу. Вариант 2
Базовый уровень
A1. 4) подгорание пищи.
А2. 2) выделение энергии.
А3. 3) Zn + 2HCI = ZnCl2 + H2+ Q.
А5. 3) 11.
А6. 4) катализатор.
А7. 2) 11,2 л.
А8. 2) Са + S → CaS.
A10. 3) разложения.
Повышенный уровень
В1. 2Na + 2H2O = 2NaOH + H2. Реакция замещения.
В2. Решение.
n(СuО) = n(Сu(ОН)2)= m(Сu(ОН)2) : М(Сu(ОН)2) = 98 г : 98 г/моль = 1 моль;
m(CuO) = n(СиО) • M(CuO) = 1 моль х 80 г/моль = 80 г.
Ответ: m(СuО) = 80 г.
В3.
1) СuО + H2 → Сu + H2O реакция замещения;
2) 2Cr + 3Cl2 → 2СrСl3 реакция соединения.
В4. Смесь можно разделить, отделив железные стружки магнитом, затем растворением соли и древесных опилок в воде, отстаиванием и фильтрованием опилок и последующим выпариванием соли.
В5. Восстановите символы в уравнениях реакций, укажите типы реакций:
1) СuО + H2SO4 → CuSO4 + H2O реакция замещения;
2) 2Аl + Сl2 → 2АlСl3 реакция соединения.
Вы смотрели: Химия 8 Габриелян Контрольная работа № 3 по химии в 8 классе с ответами (2 варианта). УМК Габриелян О.С. (Дрофа). Поурочное планирование по химии для 8 класса (Ястребова О.Н). Урок 44. Контрольная работа по теме «Изменения, происходящие с веществами» + ОТВЕТЫ.
Вернуться к Списку уроков Тематического планирования по химии в 8 классе.
Химическая реакция. Условия и признаки протекания химических реакций. Химические уравнения. Сохранение массы веществ при химических реакциях
Химической реакцией называют взаимодействия, приводящие к изменению химической природы участвующих в них частиц. При этом происходит изменение их состава и (или) строения. В химических реакциях могут участвовать атомы, молекулы, ионы и радикалы.
В ходе химических реакций атомные ядра не затрагиваются и число атомов каждого химического элемента сохраняется.
Химические реакции протекают при определённых условиях (температура, давление, наличие или отсутствие растворителя, катализа, ультрафиолетовое излучение).
Признаками протекания химических реакций являются выделение или поглощение газа, образование или растворение осадка, изменение цвета, выделение или поглощение теплоты.
Описание качественных реакций, используемых для определения некоторых катионов и анионов, приводится в приложении в конце урока.
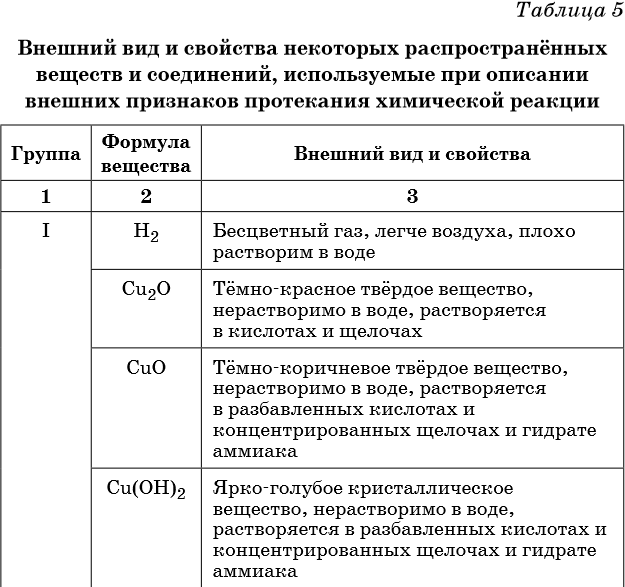
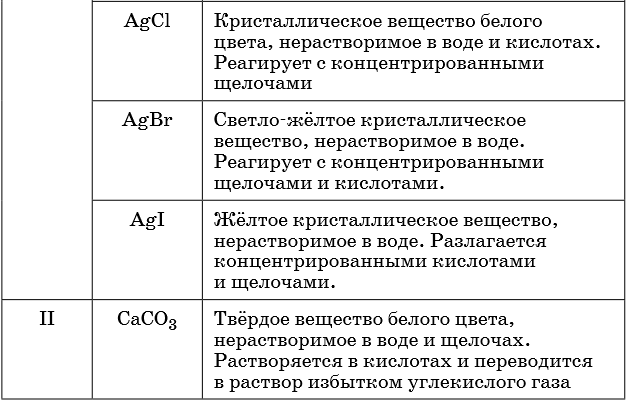
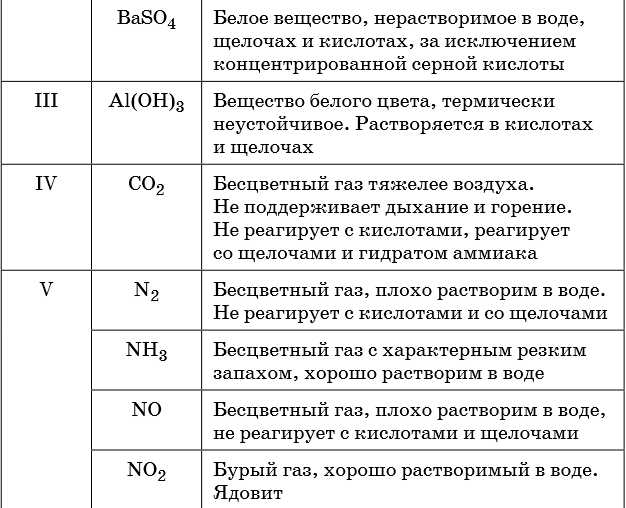
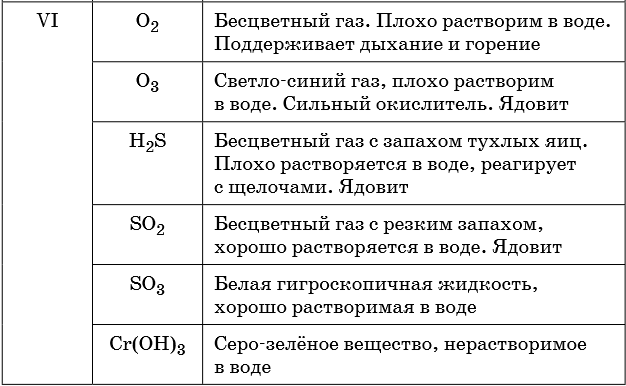
В таблице 5 представлены сведения о внешнем виде и свойствах некоторых распространённых веществ и соединений, используемых при описании внешних признаков протекания химической реакции.
Для описания химических реакций используют химические уравнения, в левой части которых указывают исходные вещества, а в правой — продукты реакции. Обе части химического уравнения соединяют стрелкой (в случае необратимых химических превращений), а если химическая реакция является обратимой, то это показывают с помощью прямой и обратной стрелок.
В неорганической химии, если количество атомов химических элементов в левой и правой частях уравнено с помощью стехиометрических коэффициентов, части уравнения часто соединяют знаком равенства.
Стехиометрией называют учение о количественных соотношениях между реагентами и продуктами реакции.
Коэффициенты стехиометрические — действительные натуральные (то есть положительные, как правило, целые) числа, стоящие перед формулой химического вещества в уравнении реакции. Коэффициенты показывают минимальное количество структурных единиц вещества (атомов, молекул, ионов, радикалов), участвующих в данной реакции.
В вышеприведённой реакции два атома алюминия реагируют с тремя молекулами серной кислоты, в результате чего образуется одна молекула сульфата алюминия (коэффициент, равный одному, перед формулой не ставят) и три молекулы водорода.
В соответствии с законом сохранения массы (закон Ломоносова — Лавуазье) масса всех веществ, вступивших в химическую реакцию, равна массе всех продуктов реакции.
Этот закон подтверждает, что атомы являются неделимыми и в ходе химических реакций не изменяются. Молекулы при реакциях претерпевают изменения, но общее число атомов каждого вида не изменяется, и поэтому общая масса веществ в процессе реакции сохраняется.
Тренировочные задания
1. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ПРИЗНАКИ РЕАКЦИИ:
1) растворение осадка
2) выделение чёрного осадка
3) отсутствие внешних признаков
4) выделение синего осадка
2. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ПРИЗНАКИ РЕАКЦИИ:
1) выделение жёлтого осадка
2) растворение осадка
3) выделение белого осадка
4) выделение синего осадка
3. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ПРИЗНАКИ РЕАКЦИИ:
1) отсутствие внешних признаков
2) выделение жёлто-зелёного газа
3) выделение жёлтого осадка
4) растворение осадка
4. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ПРИЗНАКИ РЕАКЦИИ:
1) появление оранжевой окраски
2) выделение газа с характерным запахом
3) растворение осадка
4) отсутствие внешних признаков
5. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ПРИЗНАКИ РЕАКЦИИ:
1) выделение жёлтого осадка
2) отсутствие внешних признаков
3) выделение белого осадка
4) выделение чёрного осадка
6. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ВЕЩЕСТВА:
А) AgNO3 и NaI
Б) Zn и KOH
В) HCl и FeS
ПРИЗНАКИ РЕАКЦИИ:
1) выделение жёлтого осадка
2) выделение газа с характерным запахом
3) выделение бесцветного газа
4) выделение чёрного осадка
7. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ПРИЗНАКИ РЕАКЦИИ:
1) отсутствие внешних признаков
2) выделение газа с характерным запахом
3) выделение белого осадка
4) растворение осадка
8. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ПРИЗНАКИ РЕАКЦИИ:
1) выделение бесцветного газа
2) выделение газа с характерным запахом
3) выделение белого осадка
4) выделение синего осадка
9. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ПРИЗНАКИ РЕАКЦИИ:
1) выделение синего осадка
2) растворение осадка
3) выделение белого осадка
4) выделение бурого осадка
10. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ВЕЩЕСТВА:
А) AgNO3 и NaI
Б) Al и NaOH
В) HCl и K2SO3
ПРИЗНАКИ РЕАКЦИИ:
1) выделение бесцветного газа
2) выделение газа с характерным запахом
3) выделение белого осадка
4) выделение жёлтого осадка
11. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ПРИЗНАКИ РЕАКЦИИ:
1) выделение бесцветного газа
2) выделение газа с характерным запахом
3) выделение белого осадка
4) отсутствие внешних признаков
12. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ВЕЩЕСТВА:
А) Cu и HNO3 (конц.)
Б) Cu и H2SO4 (конц.)
В) BaCO3 и HCl
ПРИЗНАКИ РЕАКЦИИ:
1) выделение бурого газа
2) выделение газа с характерным запахом
3) выделение белого осадка
4) выделение бесцветного газа
13. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ПРИЗНАКИ РЕАКЦИИ:
1) выделение бесцветного газа
2) выделение газа с характерным запахом
3) выделение белого осадка
4) выделение синего осадка
14. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ПРИЗНАКИ РЕАКЦИИ:
1) выделение бурого осадка
2) выделение газа с характерным запахом
3) выделение белого осадка
4) выделение синего осадка
15. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ПРИЗНАКИ РЕАКЦИИ:
1) выделение бесцветного газа
2) выделение бесцветного газа
3) выделение белого осадка
4) выделение чёрного осадка
16. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ПРИЗНАКИ РЕАКЦИИ:
1) выделение бесцветного газа
2) выделение газа с характерным запахом
3) выделение белого осадка
4) выделение синего осадка
17. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ПРИЗНАКИ РЕАКЦИИ:
1) отсутствие внешних признаков
2) выделение газа с характерным запахом
3) выделение белого осадка
4) выделение чёрного осадка
18. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ПРИЗНАКИ РЕАКЦИИ:
1) выделение бесцветного газа
2) выделение бесцветного газа с характерным запахом
3) выделение белого осадка
4) растворение осадка
19. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ПРИЗНАКИ РЕАКЦИИ:
1) выделение бесцветного газа
2) выделение бесцветного газа с характерным запахом
3) выделение белого осадка
4) выделение студенистого бесцветного осадка
20. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ПРИЗНАКИ РЕАКЦИИ:
1) выделение бурого газа
2) выделение газа с характерным запахом
3) выделение белого осадка
4) выделение жёлтого осадка
http://uchitel.pro/%D1%85%D0%B8%D0%BC%D0%B8%D1%8F-8-%D0%B3%D0%B0%D0%B1%D1%80%D0%B8%D0%B5%D0%BB%D1%8F%D0%BD-%D0%BA%D0%BE%D0%BD%D1%82%D1%80%D0%BE%D0%BB%D1%8C%D0%BD%D0%B0%D1%8F-3/
http://himi4ka.ru/ogje-2018-po-himii/urok-7-himicheskaja-reakcija-uslovija-i-priznaki-protekanija-himicheskih-reakcij-himicheskie-uravnenija-sohranenie-massy-veshhestv-pri-himicheskih-reakcijah.html