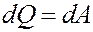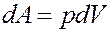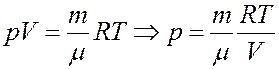Первое начало термодинамики. Применение I начала термодинамики к изопроцессам. Адиабатный процесс. Уравнение Пуассона. Скорость звука в газах.
Первое начало термодинамики является обобщением закона сохранения и превращения энергии для тепловых процессов. Первое начало было установлено, после того как экспериментально была доказана взаимосвязь теплоты и работы.
Первое начало термодинамики: количество теплоты, полученное системой, идет на изменение ее внутренней энергии и совершение работы над внешними телами.
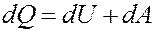
где dQ – элементарное количество теплоты, dA – элементарная работа, dU – приращение внутренней энергии.
Если dQ > 0 система получает теплоту, dQ 0 – система выполняет работу над внешними телами, dA 0, если тепловой поток направлен в сторону термодинамической системы. Величина A > 0, если система совершает положительную работу над окружающими телами.
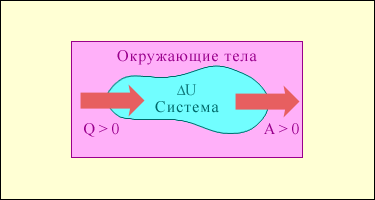 |
Рис.1. Обмен энергией между термодинамической системой и окружающими телами в результате теплообмена и совершаемой работы.
Первый закон термодинамики является обобщением опытных фактов. Согласно этому закону, энергия не может быть создана или уничтожена; она передается от одной системы к другой и превращается из одной формы в другую.
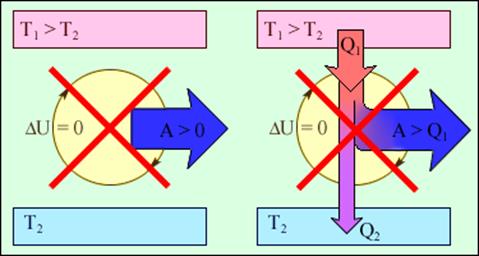
Важным следствием первого закона термодинамики является утверждение о невозможности создания машины, способной совершать полезную работу без потребления энергии извне и без каких-либо изменений внутри самой машины. Такая гипотетическая машина получила название вечного двигателя (perpetuum mobile) первого рода. Многочисленные попытки создать такую машину неизменно заканчивались провалом. Любая машина может совершать положительную работу A над внешними телами только за счет получения некоторого количества теплоты Q от окружающих тел или уменьшения ΔU своей внутренней энергии (рис.2).
Рис.2. Циклически работающие тепловые машины, запрещаемые первым законом термодинамики: 1 – вечный двигатель 1 рода, совершающий работу без потребления энергии извне; 2 – тепловая машина с коэффициентом полезного действия η > 1.
Внутренняя энергия изолированной системы постоянная величина. Для такой системы dQ = 0, dA = 0, следовательно, dU = 0 и значит U = const.
Какие бы процессы не протекали в изолированной системе, ее внутренняя энергия остается постоянной.
Если незамкнутая система выполняет круговой процесс, т.е. в результате его система возвращается в первоначальное состояние, то dU = U2—U1 = 0, следовательно, из (1) dQ = dA. То есть вся теплота, полученная системой, идет на выполнение работы. Отсюда вытекает невозможность создания вечного двигателя первого рода.
Применим I начало термодинамики к изопроцессам.
1). Изотермический процесс: T = const.
Внутренняя энергия идеального газа определяется выражением:
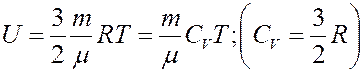
где CV – молярная теплоемкость при постоянном объеме. Определим изменение внутренней энергии.
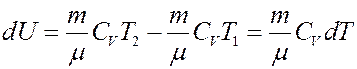
Если T = const, то dU = 0 и из I начала термодинамики получим:
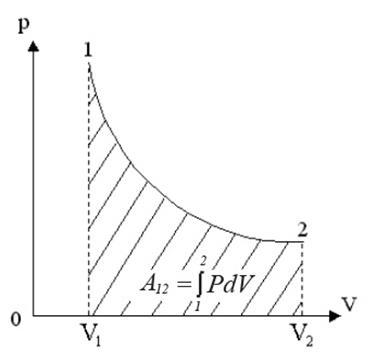
Теплота, полученная системой, идет на выполнение работы над внешними телами. Определим величину этой работы (рис.3).
Рис.3. Работа при изотермическом процессе
Элементарная работа определяется выражением:
Из уравнения Клапейрона-Менделеева:
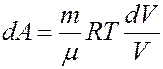
Проинтегрировав (4) найдем работу:
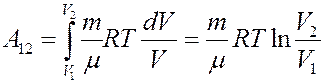
Работа численно равна площади под кривой 1 → 2. При расширении V2 > V1, и A12 > 0 система выполняет работу. При сжатии V2 V1 и A12 > 0, газ выполняет работу. При сжатии V2 T1, то Q12 > 0 газ получает тепло и его внутренняя энергия увеличивается, а если T2
| | | следующая лекция ==> | |
| Устройство пола из древесины | | | Политропический процесс. Теплоемкость. Принцип равномерного распределения энергии по степеням свободы и границы его применимости. |
Дата добавления: 2015-05-21 ; просмотров: 7307 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
Адиабатический процесс и уравнения адиабаты для идеального газа. Пример задачи
Адиабатический переход между двумя состояниями в газах не относится к числу изопроцессов, тем не менее, он играет важную роль не только в различных технологических процессах, но и в природе. В данной статье рассмотрим, что представляет собой этот процесс, а также приведем уравнения адиабаты идеального газа.
Кратко об идеальном газе
Идеальным называется такой газ, в котором нет взаимодействий между его частицами, и их размеры равны нулю. В природе, конечно же, не существует идеальных на сто процентов газов, поскольку все они состоят из имеющих размеры молекул и атомов, которые взаимодействуют друг с другом всегда как минимум с помощью ван-дер-ваальсовых сил. Тем не менее, описанная модель часто выполняется с достаточной для решения практических задач точностью для многих реальных газов.

Главным уравнением идеального газа является закон Клапейрона-Менделеева. Он записывается в следующей форме:
Это уравнение устанавливает прямую пропорциональность между произведением давления P на объем V и количества вещества n на абсолютную температуру T. Величина R — газовая константа, которая играет роль коэффициента пропорциональности.
Что это адиабатический процесс?
Адиабатический процесс — это такой переход между состояниями газовой системы, при котором обмена энергией с внешней средой не происходит. При этом изменяются все три термодинамических характеристики системы (P, V, T), а количество вещества n остается постоянным.
Различают адиабатическое расширение и сжатие. Оба процесса происходят только за счет внутренней энергии системы. Так, в результате расширения давление и особенно температура системы сильно падают. Наоборот, адиабатическое сжатие приводит к положительному скачку температуры и давления.
Чтобы не происходил обмен теплом между окружающей средой и системой, последняя должна обладать теплоизолированными стенками. Кроме того, сокращение длительности протекания процесса значительно уменьшает тепловой поток от и к системе.
Уравнения Пуассона для адиабатического процесса
Первый закон термодинамики записывается в таком виде:
Иными словами, сообщенная системе теплота Q идет на выполнение системой работы A и на повышение ее энергии внутренней ΔU. Чтобы написать уравнение адиабаты, следует положить Q=0, что соответствует определению изучаемого процесса. Получаем:
При изохорном процессе в идеальном газе все тепло идет на повышение внутренней энергии. Этот факт позволяет записать равенство:
Где CV — изохорная теплоемкость. Работа A, в свою очередь, вычисляется так:
Где dV — малое изменение объема.
Помимо уравнения Клапейрона-Менделеева, для идеального газа справедливо следующее равенство:
Где CP — изобарная теплоемкость, которая всегда больше изохорной, так как она учитывает потери газа на расширение.
Анализируя записанные выше равенства и проводя интегрирование по температуре и объему, приходим к следующему уравнению адиабаты:
Здесь γ — это показатель адиабаты. Он равен отношению изобарной теплоемкости к изохорной. Это равенство называется уравнением Пуассона для процесса адиабатического. Применяя закон Клапейрона-Менделеева, можно записать еще два аналогичных выражения, только уже через параметры P-T и P-V:
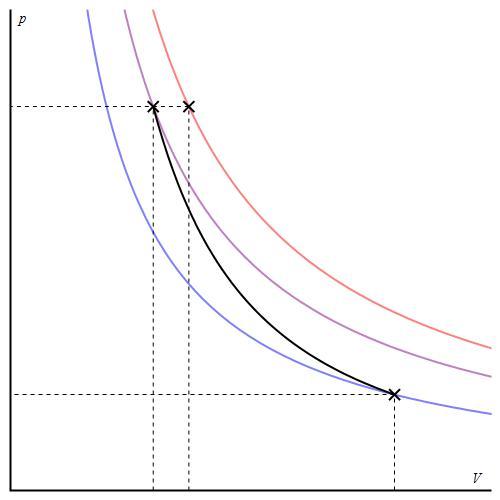
График адиабаты можно привести в различных осях. Ниже он показан в осях P-V.
Цветные линии на графике соответствуют изотермам, черная кривая — это адиабата. Как видно, адиабата ведет себя более резко, чем любая из изотерм. Этот факт просто объяснить: для изотермы давление меняется обратно пропорционально объему, для изобаты же давление изменяется быстрее, поскольку показатель γ>1 для любой газовой системы.
Пример задачи
В природе в горной местности, когда воздушная масса движется вверх по склону, то ее давление падает, она увеличивается в объеме и охлаждается. Этот адиабатический процесс приводит к снижению точки росы и к образованию жидких и твердых осадков.
Предлагается решить следующую задачу: в процессе подъема воздушной массы по склону горы давление упало на 30 % по сравнению с давлением у подножия. Чему стала равна ее температура, если у подножия она составляла 25 oC?
Для решения задачи следует использовать следующее уравнение адиабаты:
Его лучше записать в таком виде:
Если P1 принять за 1 атмосферу, то P2 будет равно 0,7 атмосферы. Для воздуха показатель адиабаты равен 1,4, поскольку его можно считать двухатомным идеальным газом. Значение температуры T1 равно 298,15 К. Подставляя все эти числа в выражение выше, получаем T2 = 269,26 К, что соответствует -3,9 oC.
Изопроцессы адиабатный процесс уравнение пуассона
1. Изотермический процесс. Изменение внутренней энергии при изотермическом процессе не происходит. Все количество теплоты, переданное системе, согласно формуле (48), идет на совершение работы: ΔQ=A.
Полная работа A, совершаемая газом при изменении его объема от V1 до V2:
2. Изобарный процесс — процесс, протекающий при постоянном давлении. Первое начало термодинамики для изобарного процесса:
3. Изохорный процесс. При изохорном процессе газ не совершает работы. Первое начало термодинамики для изохорного процесса: ΔQ=ΔU.
Изменение внутренней энергии системы при изохорном процессе:
4. Адиабатический процесс — процесс, при котором отсутствует теплообмен между системой и окружающей средой (ΔQ=0). Все быстропротекающие процессы можно отнести к адиабатическим.
Уравнения состояний системы для адиабатического процесса:
Диаграмма адиабатического процесса (адиабата) в координатах (p,V) изображается более крутой гиперболой, чем изотерма (рис. 15). Это объясняется тем, что при адиабатическом сжатии увеличение давления газа обусловлено не только уменьшением его объема, как при изотермическом сжатии, но и повышением температуры. Первое начало термодинамики для адиабатического процесса (внешняя работа совершается за счет изменения внутренней энергии системы):
5. Политропический процесс – процесс, в котором теплоемкость остается постоянной:
где n — показатель политропы.
Из уравнения политропы получаются уравнения рассмотренных выше процессов:
Изобарный процесс: n=0, P=const.
Изотермический процесс: n=1, PV=const.
Адиабатный процесс: n=λ, PV λ =const.
Изохорный процесс: n=±∞, PV n =const.
http://1ku.ru/obrazovanie/58101-adiabaticheskij-process-i-uravnenija-adiabaty-dlja-idealnogo-gaza-primer-zadachi/
http://testent.ru/publ/studenty/fizika/izoprocessy_adiabatnyj_process_politropnyj_process/37-1-0-1791