Изотерма адсорбции уравнение ленгмюра уравнение фрейндлиха
Адсорбция. Изотермы адсорбции Лэгмюра, Фрейндлиха. Уравнение БЭТ и его анализ.
Поверхностная энергия стремится самопроизвольно уменьшиться. Это выражается в уменьшении межфазной поверхности или поверхностного натяжения ( s ).
Вследствие этого стремления происходит адсорбция.
Адсорбция – процесс самопроизвольного перераспределения компонентов системы между поверхностным слоем и объемной фазой. То есть адсорбция может происходить в многокомпонентных системах, в слой переходит тот компонент, который сильнее уменьшает поверхностное натяжение. В общем случае адсорбция может быть результатом химического взаимодействия компонентов с поверхностью – хемосорбция.
Адсорбент – фаза, определяющая форму поверхности, она более плотная, может быть твердой или жидкой.
Адсорбат – вещество, которое перераспределяется (газ или жидкость).
Десорбция — переход вещества из поверхностного слоя в объемную фазу.
Для количественного описания адсорбции применяют две величины. Одна измеряется массой адсорбента, то есть числом молей или граммов, приходящихся на единицу площади поверхности или на единицу массы адсорбента. Эту величину обозначают «А» (метод «слоя конечной толщины»). Другая характеристика величины адсорбции определяется избытком вещества в поверхностном слое по сравнению с его количеством в таком же объеме фазы также отнесенным к единице площади или единице массы адсорбента.
Физико – химическая классификация.
1. физическая (молекулярная),
Наиболее широко распространена физическая адсорбция.
При физической адсорбции происходит взаимодействие адсорбата и адсорбента за счет сил Ван-дер-Ваальса и водородных связей. Силы Ван-дер-Ваальса включают три вида взаимодействия: диполь-дипольное, индукционное и дисперсионное. Для всех видов взаимодействия выполняется один закон изменения энергии притяжения от расстояния между атомами.
Адсорбция – изменение концентрации вещества на границе раздела фаз по сравнению с объемом. Этим термином обозначают также и процесс поглощения и количество поглощенного вещества Г, отнесенного к единице площади поверхности или массы адсорбента (ммоль/м 2 или ммоль/г).
Адсорбция идет с выделением энергии, следовательно, этот процесс самопроизвольный.
Адсорбент – вещество, на поверхности которого происходит адсорбция.
Адсорбат – адсорбирующееся вещество.
Адсорбция физическая – адсорбция, обусловленная силами межмолекулярного взаимодействия (как правило, обратима).
Хемосорбция – поглощение газов, паров или растворенных веществ твердыми или жидкими поглотителями, сопровождающееся образованием химических соединений.
Теплота адсорбции – отнесенная к одному молю вещества теплота, которая выделяется при его адсорбции.
Адсорбция – экзотермический процесс ( Q >0) . При постоянной адсорбции(Г, Q = const ):


Величина Q является косвенным критерием определения типа адсорбции: если Q Q >40 кДж/моль – хемосорбция.
Изотерма адсорбции – функциональная зависимость количества адсорбированного поверхностью вещества от давления или концентрации этого вещества в другой фазе Г= f ( p ) T = const , Г= f (с) T = const .При монослойной локализованной адсорбции на однородной поверхности Г= f ( p ) описывается изотермой Ленгмюра.
Уравнение изотермы абсорбции (1916 –1918 г) получено исходя из следующих предположений:
1.) поверность адсорбента энергетически однородна, т.е. адсорбция молекул на любом ее участке проходит с одинаковым тепловым эффектом
2.) отсутствует взаимодействие между адсорбированными молекулами, т.е. молекулы покрывают адсорбент только мономолекулярным слоем. Максимум адсорбции наблюдается тогда, тогда когда вся поверхность покрыта мномолекулярным слоем
3.) адсорбция обратима, т.е. между адсорбционным слоем и газовой (жидкой) фазой восстанавливается термодинамическое равновесие.
При равновесии скорость адсорбции V ад должна равняться скорости десорбции V дес .
Для того, чтобы молекула адсорбировалась, она должна удариться о поверхность и попасть на незанятое место. Так как число ударов пропорционально концентрации С, а вероятность попасть на незанятое место пропорциональна числу незанятых мест, то
где k 1 – константа скорости адсорбции. q — доля занятых мест, 1– q – доля не занятых мест.
Молекула десорбируется, когда ее энергия окажется достаточной для того, чтобы оторваться от поверхности. Число таких молекул пропорционально числу адсорбированных молекул, поэтому
где k 2 – константа десорбции.
отсюда 

Если число мест на адсорбенте равно z , то адсорбция Г= z q и уравнение изотермы будет

Исследуем это уравнение:
1.) адсорбция мала: либо мала k 1 , либо мала С, тогда bC zbC = 

2.) Адсорбция велика: bc >> 1, тогда Г= z , т.е. наступает предельная адсорбция Г ¥ . Отношение 


Отсекаемые на оси координат отрезки и наклоны этих прямых позволяют определить константы уравнения Ленгмюра z и b . Однако уравнении Ленгмюра неудовлетворительно истолковывает данные по адсорбции. Отклонение от теории Ленгмюра является результатом неоднородной поверхности, которая характеризуется наличием неодинаковых адсорбционных центров обладающих различным сродством с адсорбируемым веществом. Если поверхность энергетически неоднородна, используют эмпирическое уравнение Френдлиха

где х – количество адсорбированного вещества,
m – масса адсорбента,
С – равновесная концентрация после адсорбции,
k , n – константы (аппроксимационные параметры).
Константа k – представляет собой количество вещества, адсорбированное 1 г. адсорбента при С = 1моль/литр. Для каждого адсорбатива k имеет свое значение при одном и том же адсорбенте, т.е. она характеризует способность данного адсорбата адсорбироваться определенным адсорбентом

где n – наклон прямой, а k – антилогарифм отрезка прямой. Уравнение Фрейндлиха можно вывести предположив, что поверхность энергетически неоднородна и что адсорбция на каждом из типов адсорбционных центров подчиняется уравнению Ленгмюра. Тогда константа k отвечает константе адсорбционного равновесия, а n – степени агрегативности. Согласно уравнению Фрейндлиха количество адсорбируемого вещества неограниченно возрастает с увеличение концентрации и давления, поэтому это уравнение не является удовлетворительным для высоких заполнений поверхностей.
При многослойной адсорбции изотерма адсорбции описывается уравнением БЭТ (Брунаэр, Эммет, Теллер). Они предположили, что на поверхности адсорбента имеются однородные локализованные адсорбционные центры и что адсорбция на одном центре не оказывает никакого влияния на адсорбцию на соседних центрах, также как и в теории Ленгмюра. Далее они предположили, что молекулы могут адсорбирваться во втором, третьем и n -ом молекулярном слоях, причем доступная площадь для молекул n -го слоя равна площади покрытой ( n -1) слоем.
где ps – давление насыщенного пара адсорбата,
p – давление адсорбата в другой фазе.
Отличительной чертой адсорбции паров является переход к объемной конденсации при предельном давлении, равном давлению насыщенного пара жидкости, p = ps . Целью этого уравнения является нахождение Г ¥ с помощью которой можно рассчитать доступную поверхность адсорбента.
Изотерма адсорбции уравнение ленгмюра уравнение фрейндлиха
Любые гетерогенные процессы, например, разложение или образование химического соединения, растворение твердых тел, газов или жидкостей, испарение, возгонка и т.п., а также многие другие процессы проходят в присутствии поверхностей раздела фаз (твердое тело — газ, твердое тело — жидкость, газ – жидкость). Состояние вещества у поверхности раздела соприкасающихся фаз отличается от его состояния внутри этих фаз вследствие различия молекулярных взаимодействий в разных фазах. Это различие вызывает особые поверхностные явления на границе раздела фаз.
Представим себе поверхность твердого тела на границе с газом. Внутри твердого тела частицы (атомы, ионы или молекулы), образующие его решетку, правильно чередуются в соответствии с кристаллической структурой, причем их взаимодействия уравновешены. Состояние же частицы, находящейся на поверхности, иное — взаимодействия таких частиц не уравновешены, и поэтому поверхность твердого тела притягивает молекулы вещества из соседней газовой фазы. В результате концентрация этого вещества на поверхности становится больше, чем в объеме газа, газ адсорбируется поверхностью твердого тела.
Таким образом, адсорбция представляет собой концентрирование вещества на поверхности раздела фаз. Вещество, на поверхности которого происходит адсорбция ‒ адсорбент , а поглощаемое из объемной фазы вещество — адсорбат .
Адсорбент поглощает из объемной фазы тем больше вещества, чем больше развита его поверхность. Поверхность, приходящаяся на 1 г адсорбента, называют удельной поверхностью. Величина удельной поверхности у различных адсорбентов может быть весьма различной. Непористые тела имеют удельную поверхность от нескольких м 2 /г до сотен м 2 /г. Большое увеличение поверхности связано обычно с наличием в твердом теле узких пор. Примерами таких высокодисперсных пористых тел с удельной поверхностью до нескольких тысяч м 2 /г являются активированный уголь и силикагель.
Количественно адсорбция может быть выражена с помощью нескольких величин:
- величиною а, представляющей собой количество адсорбата, находящегося в объеме адсорбционного слоя, отвечающего единице массы адсорбента (моль/г).
- величиною Г, представляющей собой избыток числа молей адсорбата в объеме поверхностного слоя площадью 1 см 2 по сравнению с числом его молей в том же объеме, если бы у межфазной границы не происходило изменение концентрации адсорбата (Г>0 — адсорбция, Г адсорбционного равновесия , аналогичное равновесию между испарением и конденсацией. Адсорбционное равновесие — это динимическое равновесие которое наступает тогда, когда скорость процесса адсорбции равна скорости обратного процесса десорбции. Понятно, что чем выше концентрация адсорбата, тем больше адсорбция. Также ясно, что чем выше температура, тем меньше физическая адсорбция. Для каждой температуры существует свое адсорбционное равновесие.
Адсорбцию принято характеризовать зависимостью количества адсорбированного вещества а от концентрации (или равновесного давления). Графики а=f(c) или а=f(р) при Т=const называют изотермами адсорбции . Вид обычной изотермы показан на рис.9.1.
Рисунок 9.1 ‒ Типичный вид изотермы адсорбции
Как можно видеть, изотерма имеет три характерных участка. Начальный круто поднимающийся вверх почти прямолинейный участок кривой показывает, что при малых концентрациях адсорбция пропорциональна концентрации. Это область, в которой выполняется закон Генри:[TEX]а=К\cdot<с>[/TEX], где К – константа Генри, не зависящая от концентрации с. В области I поверхность адсорбента в значительной степени свободна.
Почти горизонтальный участок III соответствует большим концентрациям и отвечает поверхности адсорбента, полностью насыщенной адсорбатом. В. этих условиях, если на поверхности может образоваться лишь мономолекулярный слой адсорбата, количество его практически перестает зависеть от концентрации. Средний участок II кривой соответствует промежуточным степеням заполнения поверхности.
Важной задачей теории адсорбции является вывод уравнения изотермы адсорбции. В настоящее время эта задача еще далека от разрешения. Для описания изотермы адсорбции предложен ряд эмпирических формул. Из них наиболее широко используется уравнение Фрейндлиха :
где X — количество адсорбированного вещества, моль; m — масса адсорбента; с — равновесная концентрация, b и 1/n – константы.
Константы b и 1/n уравнения Фрейндлиха легко найти графически по изотерме, построенной в логарифмических координатах:
Это уравнение прямой. Тангенс угла наклона этой прямой равен 1/n, а отрезок, отсекаемый прямой на оси ординат, равен lnb. Константа b обычно колеблется в широких пределах. Физический смысл ее становится ясным, если принять с=1, тогда b представляет собой величину адсорбции при равновесной концентрации адсорбата 1 моль/л. Показатель 1/n принимается постоянным, лежащим в пределах 0,2 -1,0 для адсорбции из газовой среды и 0,1 — 0,5 для адсорбции из растворов. Поэтому уравнение Фрейндлиха пригодно лишь для концентраций, меньших 0,5 моль/л.2.
Мономолекулярная адсорбция. Изотерма адсорбции Ленгмюра
Фундаментальным вкладом в учение об адсорбции явилась теория Ленгмюра . Эта теория позволяет учесть наиболее сильные отклонения от закона Генри, связанные с ограниченностью поверхности адсорбента. Это обстоятельство приводит к адсорбционному насыщению поверхности адсорбента по мере увеличения концентрации адсорбируемого вещества. Это положение является основным в теории Ленгмюра и уточняется следующими допущениями:
- адсорбция локализована на отдельных адсорбционных центрах, каждый из которых взаимодействует только с одной молекулой адсорбата. На поверхности адсорбента образуется поэтому мономолекулярный слой адсорбата;
- адсорбционные центры энергетически эквивалентны;
- адсорбированные молекулы не взаимодействуют друг с другом.
Для вывода изотермы адсорбции Ленгмюра учтем, что при установлении в системе адсорбционного равновесия скорость адсорбции ([TEX]V\downarrow [/TEX])должна равняться скорости десорбции( [TEX]V\uparrow [/TEX] ). Для того, чтобы молекула адсорбировалась, она должна удариться о поверхность и попасть на незанятое место. Учитывая, что число ударов пропорционально концентрации С, а вероятность попасть на незанятое место пропорционально их числу, имеем
где[TEX]\Theta[/TEX]- доля занятых мест,[TEX]k_1[/TEX]- константа скорости адсорбции. Скорость десорбции прямо пропорциональна числу адсорбированных молекул:
где[TEX]k_2[/TEX]- константа скорости десорбции.
где[TEX] K=k_1/k_2[/TEX]- константа адсорбционного равновесия.
Обозначим символом[TEX]a_\infty[/TEX]максимальную адсорбцию или емкость адсорбционного монослоя. Тогда
Это уравнение носит название изотермы адсорбции Ленгмюра. Для газов и паров концентрацию можно заменить пропорциональным ей значением давления и изотерма адсорбции примет вид
Константы адсорбционного равновесия К и[TEX]K_p[/TEX]характеризуют энергию взаимодействия адсорбата с адсорбентом. Чем сильнее это взаимодействие, тем больше значение константы адсорбционного равновесия.
Важны экстраполяционные следствия уравнения изотермы Ленгмюра. При[TEX]C\rightarrow<0>[/TEX]имеем[TEX]a=a_\infty<\cdot>K\cdot
Эти выражения соответствуют закону Генри: величина адсорбции линейно растет с увеличением концентрации. Таким образом уравнение Ленгмюра является более общим соотношением, включающим и уравнение Генри.
При больших концентрациях, когда[TEX] K_c\gg1[/TEX]
Эти соотношения отвечают насыщению, когда вся поверхность адсорбента покрывается мономолекулярным слоем адсорбата. Экспериментальные результаты по определению изотермы адсорбции обычно обрабатывают с помощью уравнения Ленгмюра, записанного в линейной форме:
Методика нахождения коэффициентов уравнения Ленгмюра показана на рис. 9.2.
Рисунок 9.2 ‒ К нахождению констант уравнения Ленгмюра
Полимолекулярная адсорбция. Уравнение БЭТ
Опыт показывает, что наряду с изотермами адсорбции, которые описываются уравнением Ленгмюра и о которых мы говорили, часто встречаются изотермы, не имеющие участка, параллельного оси давлений и отвечающего насыщению поверхности адсорбента молекулами адсорбата. Такая изотерма — показана на рис 9.3. Это связано с явлением, при котором на активных центрах поверхности адсорбента образуются несколько слоев молекул или ионов адсорбата — полимолекулярная адсорбция .
Наиболее удачная теория (из многочисленных), описывающая подобные процессы была создана в 1935-1940 гг. Брунауэром, Эмметом, Теллером применительно к адсорбции паров. Их теория получила название теории БЭТ. Ее основные положения:
- Адсорбционные слои полимолекулярны, причем их толщина на разных участках поверхности различна.
- Адсорбционные силы тождественны силам, вызывающим конденсацию.
Рисунок 9.3 ‒ Изотерма полимолекулярной адсорбции
Последнее положение может быть обосновано следующим образом: лишь первый слой молекул адсорбата находится в непосредственной близости к поверхности твердого тела. Второй, и особенно последующие слои, прилегают к молекулам, подобным им, и их образование напоминает обычную конденсацию пара на поверхности жидкости.
На основании этих представлений Брунауэр, Эммет и Теллер вывели следующее уравнение изотермы адсорбции паров:
где[TEX]K_П[/TEX]- константа равновесия полимолекулярной адсорбции, Р — давление пара, [TEX]P_s[/TEX] — давление насыщенного пара при данной температуре,[TEX]a_\infty[/TEX]- емкость монослоя.
При низких давлениях, когда[TEX]p/p_s\ll 1[/TEX], учитывая, что[TEX]K_p=K_П\cdot<1/p_s>[/TEX], получаем уравнение Ленгмюра:
Уравнение изотермы полимолекулярной адсорбции БЭТ легко привести к линейной форме:
По наклону этой прямой и отсекаемому ею отрезку на оси ординат можно найти значения констант[TEX]a_\infty[/TEX]и[TEX]K_П[/TEX].
Теория БЭТ, так же как и теория Ленгмюра, указывает путь для определения удельной поверхности адсорбента (любого твердого вещества). Для этого находят емкость монослоя [TEX]a_\infty[/TEX] для паров простых веществ ( [TEX]N_2[/TEX] , Ar, Kr) при низких температурах. Затем, зная площадь [TEX]S_0[/TEX] , занимаемую одной молекулой простого вещества, вычисляют удельную поверхность адсорбента:
где [TEX]N_a[/TEX] — число Авогадро. Это метод определения удельной поверхности по БЭТ.
Энергетические параметры адсорбции на однородной поверхности
Между энергией Гиббса, энтальпией и энтропией адсорбции существует известное соотношение:
Адсорбция — самопроизвольный процесс, а всякому самопроизвольному процессу при P,T=const отвечает условие [TEX]\Delta [TEX]\Delta
Если адсорбция подчиняется уравнениям Генри и Ленгмюра, т.е. константа равновесия адсорбции в этих уравнениях не зависят от степени заполнения поверхности, то стандартная энергия Гиббса адсорбции может быть рассчитана по уравнению, справедливому для химических реакций:
Энтальпию адсорбции определяют из экспериментальной зависимости константы равновесия адсорбции от температуры в соответствии с уравнением изобары Вант-Гоффа
Принимая во внимание слабую зависимость изменения энтальпии от температуры, находим
Тангенс угла наклона прямой lnK — 1/T равен -[TEX]\Delta
Энтропию адсорбции, подчиняющейся закону Генри или уравнению Ленгмюра, легко рассчитать, если известны [TEX]\Delta
Данные соотношения для расчета энергетических параметров адсорбции получены, исходя из предположения, что поверхность адсорбента однородна (эквипотенциальна) и на ней образуется мономолекулярный слой адсорбата.
Если адсорбция происходит на неоднородной поверхности, то наиболее реакционноспособные адсорбционные центры будут заняты уже при малых равновесных концентрациях. Таким образом, энергетические параметры адсорбции зависят от степени заполнения поверхности адсорбатом. Например, дифференциальная теплота адсорбции будет уменьшаться по мере заполнения поверхности.
Взаимодействие частиц в адсорбционном слое и классификация изотерм адсорбции
Одним из опорных пунктов теории Ленгмюра является константа отсутствия взаимодействия частиц адсорбата в адсорбционном слое, Однако ленгмюровская адсорбция является лишь частным случаем в многообразном мире адсорбционных процессов. На рис. 9.4 показаны различные формы изотерм адсорбции из разбавленных растворов.
Рисунок 9.4 ‒ Формы изотерм адсорбции
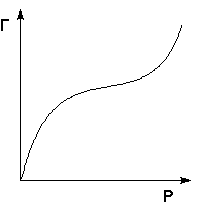
Исходя из формы начального участка были выделены четыре характерных класса изотерм (S, L, H, C). Деление изотерм на отдельные типы внутри каждого класса связано с последующим изменением их формы при наиболее высоких концентрациях. Класс L (класс Ленгмюра) является наиболее общим. Изотермы типа L2 достигают насыщения, дальнейшая адсорбция выше этого уровня дает изотерму типа L3. Если достигается второе плато, то имеем дело с изотермой L4. Для изотерм типа L5 характерно наличие максимума. Максимум отражает изменение состояния вещества в растворе — например, ассоциацию молекул при определенной концентрации. Сходный, хотя и не столь полный, набор типов изотерм получен и для других классов.
Начальный участок изотерм S — класса выгнут относительно оси концентраций, однако далее часто следует точка перегиба, что и придает изотерме характерную S -обратную форму.
Изотермы класса Н (высокое сродство – higf) наблюдается при чрезвычайно сильной адсорбции при очень низких концентрациях; они пересекаются с осью ординат. Изотермы класса С (constant) имеют начальный линейный участок, что указывает на постоянное распределение растворенного вещества между раствором и адсорбентом (постоянная скорость адсорбции).
Теоретический анализ различных типов изотерм адсорбции позволяет получить много полезной информации о механизме адсорбции. При этом следует принимать во внимание величину энергии активации процесса удаления молекул адсорбата с поверхности адсорбента. Если взаимодействие между адсорбированными молекулами пренебрежимо мало, энергия активации не зависит от степени заполнения поверхностиf a это приведет к изотерме типа L или Н.
Если сила взаимодействия между адсорбированными молекулами больше силы взаимодействия между растворенным веществом и адсорбентом, энергия активации возрастает и адсорбция описывается изотермой типа S. В этом случае молекулы растворенного вещества стремятся расположиться на поверхности в виде цепей.
Изотермы типа Н наблюдаются в тех случаях, когда имеет место хемосорбция.
Изотерма типа С характерна для адсорбции на микропористых адсорбентах и соответствует таким условиям, при которых число адсорбционных центров остается постоянным в широкой области концентраций. По мере заполнения одних центров появляются новые, и доступная для адсорбции поверхность увеличивается пропорционально количеству адсорбированного вещества.
Изотерма адсорбции уравнение ленгмюра уравнение фрейндлиха
ФИЗИЧЕСКАЯ И КОЛЛОИДНАЯ ХИМИЯ
Конспект лекций для студентов биофака ЮФУ (РГУ)
4.1 ПОВЕРХНОСТНЫЕ ЯВЛЕНИЯ И АДСОРБЦИЯ
4.1.3 Адсорбция на границе твердое тело – газ
При адсорбции газов на твердых телах описание взаимодействия молекул адсорбата и адсорбента представляет собой весьма сложную задачу, поскольку характер их взаимодействия, определяющий характер адсорбции, может быть различным. Поэтому обычно задачу упрощают, рассматривая два крайних случая, когда адсорбция вызывается физическими или химическими силами – соответственно физическую и химическую адсорбцию.
Физическая адсорбция возникает за счет ван-дер-ваальсовых взаимодействий. Она характеризуется обратимостью и уменьшением адсорбции при повышении температуры, т.е. экзотермичностью, причем тепловой эффект физической адсорбции обычно близок к теплоте сжижения адсорбата (10 – 80 кДж/моль). Таковой является, например, адсорбция инертных газов на угле.
Химическая адсорбция (хемосорбция) осуществляется путем химического взаимодействия молекул адсорбента и адсорбата. Хемосорбция обычно необратима; химическая адсорбция, в отличие от физической, является локализованной, т.е. молекулы адсорбата не могут перемещаться по поверхности адсорбента. Так как хемосорбция является химическим процессом, требующим энергии активации порядка 40 – 120 кДж/моль, повышение температуры способствует её протеканию. Примером химической адсорбции является адсорбция кислорода на вольфраме или серебре при высоких температурах.
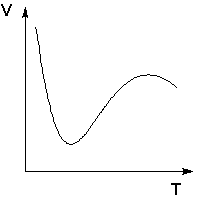
Следует подчеркнуть, что явления физической и химической адсорбции чётко различаются в очень редких случаях. Обычно осуществляются промежуточные варианты, когда основная масса адсорбированного вещества связывается сравнительно слабо и лишь небольшая часть – прочно. Например, кислород на металлах или водород на никеле при низких температурах адсорбируются по законам физической адсорбции, но при повышении температуры начинает протекать химическая адсорбция. При повышении температуры увеличение химической адсорбции с некоторой температуры начинает перекрывать падение физической адсорбции, поэтому температурная зависимость адсорбции в этом случае имеет четко выраженный минимум (рис. 4.4).
Рис. 4.4 Зависимость объема адсорбированного никелем водорода от температуры
При постоянной температуре количество адсорбированного вещества зависит только от равновесных давления либо концентрации адсорбата; уравнение, связывающее эти величины, называется изотермой адсорбции.
4.1.4 Теории адсорбции
Единой теории, которая достаточно корректно описывала бы все виды адсорбции на разных поверхностях раздела фаз, не имеется; рассмотрим поэтому некоторые наиболее распространенные теории адсорбции, описывающие отдельные виды адсорбции на поверхности раздела твердое тело – газ или твердое тело – раствор.
Теория мономолекулярной адсорбции Ленгмюра
Теория мономолекулярной адсорбции, которую разработал американский химик И. Ленгмюр, основывается на следующих положениях.
1) Адсорбция является локализованной и вызывается силами, близкими к химическим.
2) Адсорбция происходит не на всей поверхности адсорбента, а на активных центрах , которыми являются выступы либо впадины на поверхности адсорбента, характеризующиеся наличием т.н. свободных валентностей. Активные центры считаются независимыми (т.е. один активный центр не влияет на адсорбционную способность других), и тождественными.
3) Каждый активный центр способен взаимодействовать только с одной молекулой адсорбата ; в результате на поверхности может образоваться только один слой адсорбированных молекул.
4) Процесс адсорбции является обратимым и равновесным – адсорбированная молекула удерживается активным центром некоторое время, после чего десорбируется; т.о., через некоторое время между процессами адсорбции и десорбции устанавливается динамическое равновесие.
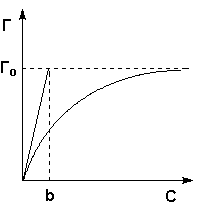
Рис. 4.5 Изотерма мономолекулярной адсорбции
В состоянии равновесия скорость адсорбции равна скорости десорбции. Скорость десорбции прямо пропорциональна доле занятых активных центров (х), а скорость адсорбции прямо пропорциональна произведению концентрации адсорбата на долю свободных активных центров (1 – х):
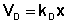
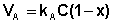
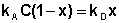
Отсюда находим х:
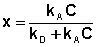
Разделив числитель и знаменатель правой части уравнения (IV.10) на kA, получим:

Максимально возможная величина адсорбции Г о достигается при условии, что все активные центры заняты молекулами адсорбата, т.е. х = 1. Отсюда следует, что х = Г / Г о. Подставив это в уравнение (IV.11), получаем:
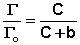
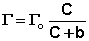
Уравнение (IV.13) есть изотерма мономолекулярной адсорбции , связывающая величину адсорбции Г с концентрацией адсорбата С. Здесь b – некоторая постоянная для данной пары адсорбент-адсорбат величина (отношение констант скоростей десорбции и адсорбции), численно равная концентрации адсорбата, при которой занята половина активных центров. График изотермы адсорбции Ленгмюра приведен на рис. 4.5. Константу b можно определить графически, проведя касательную к изотерме адсорбции в точке С = 0.
При описании процесса адсорбции газов в уравнении (IV.13) концентрация может быть заменена пропорциональной величиной парциального давления газа:
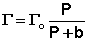
Теория мономолекулярной адсорбции Ленгмюра применима для описания некоторых процессов адсорбции газов и растворенных веществ при небольших давлениях (концентрациях) адсорбата.
Теория полимолекулярной адсорбции Поляни
На практике часто (особенно при адсорбции паров) встречаются т.н. S-образные изотермы адсорбции (рис. 4.6), форма которых свидетельствует о возможном, начиная с некоторой величины давления, взаимодействии адсорбированных молекул с адсорбатом.
Рис. 4.6 Изотерма полимолекулярной адсорбции
Для описания таких изотерм адсорбции М. Поляни предложил теорию полимолекулярной адсорбции , основанную на следующих основных положениях:
1. Адсорбция вызвана чисто физическими силами .
2. Поверхность адсорбента однородна , т.е. на ней нет активных центров; адсорбционные силы образуют непрерывное силовое поле вблизи поверхности адсорбента.
3. Адсорбционные силы действуют на расстоянии, большем размера молекулы адсорбата. Иначе говоря, у поверхности адсорбента существует некоторый адсорбционный объём , который при адсорбции заполняется молекулами адсорбата.
4. Притяжение молекулы адсорбата поверхностью адсорбента не зависит от наличия в адсорбционном объеме других молекул, вследствие чего возможна полимолекулярная адсорбция.
5. Адсорбционные силы не зависят от температуры и, следовательно, с изменением температуры адсорбционный объем не меняется.
Теоретические представления, развитые Ленгмюром и Поляни, в значительной степени идеализируют и упрощают истинную картину адсорбции. На самом деле поверхность адсорбента неоднородна, между адсорбированными частицами имеет место взаимодействие, активные центры не являются полностью независимыми друг от друга и т.д. Все это усложняет вид уравнения изотермы. Г. Фрейндлих показал, что при постоянной температуре число молей адсорбированного газа или растворенного вещества, приходящееся на единицу массы адсорбента (т.н. удельная адсорбция x/m), пропорционально равновесному давлению (для газа) или равновесной концентрации (для веществ, адсорбируемых из раствора) адсорбента, возведенным в некоторую степень, которая всегда меньше единицы:
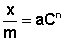
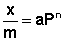
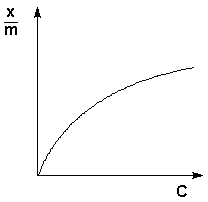
( а)
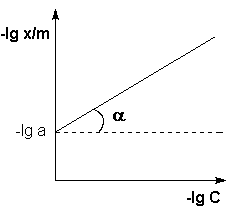
(б)
Рис. 4.7 Изотерма адсорбции Фрейндлиха в обычных (а) и логарифмических (б)
координатах
Показатель степени n и коэффициент пропорциональности а в уравнении Фрейндлиха определяются экспериментально. Логарифмируя уравнения (IV.15 — IV.16), получаем:
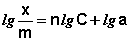
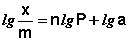
Т.о., зависимость логарифма удельной адсорбции от логарифма концентрации (давления) графически выражается прямой линией, отсекающей на оси ординат отрезок, равный lg a, тангенс угла наклона которой к оси абсцисс равен по величине показателю степени при давлении или концентрации (рис. 4.7):
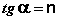
Copyright © С. И. Левченков, 1996 — 2005.
http://elearning.sumdu.edu.ua/free_content/lectured:eb3ba2f9c8c4751fb7ceecdce87ed213c32f662c/20160427131814/65693/index.html
http://physchem.chimfak.sfedu.ru/Source/PCC/Colloids_3.htm