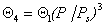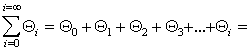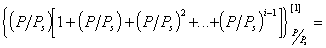Изотерма полимолекулярной адсорбции соответствует уравнению
В большинстве случаев реальная поверхность твердого тела не вполне однородна энергетически; адсорбция, как правило, не является строго локализованной; адсорбированные молекулы практически всегда взаимодействуют между собой; наконец, стехиометрия может нарушаться, вследствие чего адсорбция не будет ограничена образованием одного слоя. Поэтому реальные изотермы адсорбции всегда отклоняются от изотермы Ленгмюра. Еще самим Ленгмюром было показано, что если адсорбционные центры считать энергетически неоднородными, то суммарная адсорбция на всех центрах будет выражена следующим уравнением:
где i — количество групп одинаковых центров.
Брунауэр, Эммет и Теллер отказались от второго допущения Ленгмюра, приводящего к мономолекулярной адсорбции. Для случая, когда температура адсорбтива ниже критической (то есть, это еще пар) они разработали теорию полимолекулярной адсорбции. После анализа многочисленных реальных изотерм адсорбции ими была предложена их классификация на основе выделения пяти основных типов изотерм.
Изотермы типа I отражают мономолекулярную адсорбцию. Изотермы типа II и III обычно связывают с образованием при адсорбции многих слоев, то есть, с полимолекулярной адсорбцией. Приче м, в случае II взаимодействие адсорбент — адсорбат сильнее взаимодействия адсорбат — адсорбат, а в случае III — наобор от. Изотермы типа IV и V отличаются тем, что для них характерна конечная адсорбция при приближении давления пара к давлению насыщения ps. Изотермы типа II и III характерны для адсорбции на не пористом адсорбенте, а типа IV и V — на пористом твердом теле. Все пять типов изотерм адсорбции описываются теорией полимолекулярной адсорбции “БЭТ”, названной так по начальным буквам фамилий ее авторов.
Теория БЭТ сохраняет ленгмюровские представления о динамическом характере адсорбции. Адсорбция считается полислойной. Молекулы первого слоя адсорбируются на поверхности адсорбента в результате межмолекулярного взаимодействия адсорбент — адсорбат. Каждая адсорбированная молекула первого адсорбционного слоя может, в свою очередь, являться центром адсорбции молекул второго слоя и т.д. Так формируются второй и последующие сорбционные слои. Теплота адсорбции в первом слое q1 определяется взаимодействием адсорбат — адсорбент, во всех последующих слоях — взаимодействием адсорбат — адсорбат. Поэтому теплота адсорбции во всех слоях, начиная со второго, равна теплоте конденсации λ. Второй и последующие адсорбционные слои могут начинать образовываться и при незавершенном первом слое, как это показано на рисунке:
Составив уравнение адсорбционного равновесия для каждого слоя и просуммировав их, авторы теории БЭТ получили уравнение для полислойной адсорбции:
В приведенном уравнении АМ — емкость монослоя, С — константа, равная е (q1− λ) / RT . При малых относительных давлениях, когда р как частный случай уравнения БЭТ. В случаях, когда q1 > λ , т.е. энергия взаимодействия адсорбент — адсорбат больше энергии взаимодействия адсорбат — адсорбат, изотерма адсорбции выпукла и относится к типу II или IV. Если же энергия взаимодействия адсорбат — адсорбат больше теплоты адсорбции ( λ > q1 ), то изотерма адсорбции вогнута и относится к типу III или V.
Уравнение изотермы адсорбции БЭТ широко используется для определения величины удельной поверхности адсорбентов. Изотерма адсорбции выражается прямой линией, отсекающей на оси ординат отрезок, равный 1 / АМ С , а тангенс угла ее наклона к оси абсцисс равен (С − 1) / АМ С.
Из этих значений можно найти величину АМ, а зная ее, рассчитать по уравнению удельную поверхность адсорбента. Стандартной методикой для определения удельной поверхности адсорбентов принято считать измерение изотермы адсорбции азота при 77 К. В этом случае wо = 0.162 нм 2 .
- Источник: Пальтиель Л.Р., Зенин Г.С., Волынец Н.Ф. КОЛЛОИДНАЯ ХИМИЯ: Учеб. пособие. – СПб: СЗТУ, 2004. – 68 с.
- Источник: Кукушкина И.И., Митрофанов А.Ю. Коллоидная химия, Кемерово:2009 — 185 с.
Изотерма полимолекулярной адсорбции соответствует уравнению
Любые гетерогенные процессы, например, разложение или образование химического соединения, растворение твердых тел, газов или жидкостей, испарение, возгонка и т.п., а также многие другие процессы проходят в присутствии поверхностей раздела фаз (твердое тело — газ, твердое тело — жидкость, газ – жидкость). Состояние вещества у поверхности раздела соприкасающихся фаз отличается от его состояния внутри этих фаз вследствие различия молекулярных взаимодействий в разных фазах. Это различие вызывает особые поверхностные явления на границе раздела фаз.
Представим себе поверхность твердого тела на границе с газом. Внутри твердого тела частицы (атомы, ионы или молекулы), образующие его решетку, правильно чередуются в соответствии с кристаллической структурой, причем их взаимодействия уравновешены. Состояние же частицы, находящейся на поверхности, иное — взаимодействия таких частиц не уравновешены, и поэтому поверхность твердого тела притягивает молекулы вещества из соседней газовой фазы. В результате концентрация этого вещества на поверхности становится больше, чем в объеме газа, газ адсорбируется поверхностью твердого тела.
Таким образом, адсорбция представляет собой концентрирование вещества на поверхности раздела фаз. Вещество, на поверхности которого происходит адсорбция ‒ адсорбент , а поглощаемое из объемной фазы вещество — адсорбат .
Адсорбент поглощает из объемной фазы тем больше вещества, чем больше развита его поверхность. Поверхность, приходящаяся на 1 г адсорбента, называют удельной поверхностью. Величина удельной поверхности у различных адсорбентов может быть весьма различной. Непористые тела имеют удельную поверхность от нескольких м 2 /г до сотен м 2 /г. Большое увеличение поверхности связано обычно с наличием в твердом теле узких пор. Примерами таких высокодисперсных пористых тел с удельной поверхностью до нескольких тысяч м 2 /г являются активированный уголь и силикагель.
Количественно адсорбция может быть выражена с помощью нескольких величин:
- величиною а, представляющей собой количество адсорбата, находящегося в объеме адсорбционного слоя, отвечающего единице массы адсорбента (моль/г).
- величиною Г, представляющей собой избыток числа молей адсорбата в объеме поверхностного слоя площадью 1 см 2 по сравнению с числом его молей в том же объеме, если бы у межфазной границы не происходило изменение концентрации адсорбата (Г>0 — адсорбция, Г адсорбционного равновесия , аналогичное равновесию между испарением и конденсацией. Адсорбционное равновесие — это динимическое равновесие которое наступает тогда, когда скорость процесса адсорбции равна скорости обратного процесса десорбции. Понятно, что чем выше концентрация адсорбата, тем больше адсорбция. Также ясно, что чем выше температура, тем меньше физическая адсорбция. Для каждой температуры существует свое адсорбционное равновесие.
Адсорбцию принято характеризовать зависимостью количества адсорбированного вещества а от концентрации (или равновесного давления). Графики а=f(c) или а=f(р) при Т=const называют изотермами адсорбции . Вид обычной изотермы показан на рис.9.1.
Рисунок 9.1 ‒ Типичный вид изотермы адсорбции
Как можно видеть, изотерма имеет три характерных участка. Начальный круто поднимающийся вверх почти прямолинейный участок кривой показывает, что при малых концентрациях адсорбция пропорциональна концентрации. Это область, в которой выполняется закон Генри:[TEX]а=К\cdot<с>[/TEX], где К – константа Генри, не зависящая от концентрации с. В области I поверхность адсорбента в значительной степени свободна.
Почти горизонтальный участок III соответствует большим концентрациям и отвечает поверхности адсорбента, полностью насыщенной адсорбатом. В. этих условиях, если на поверхности может образоваться лишь мономолекулярный слой адсорбата, количество его практически перестает зависеть от концентрации. Средний участок II кривой соответствует промежуточным степеням заполнения поверхности.
Важной задачей теории адсорбции является вывод уравнения изотермы адсорбции. В настоящее время эта задача еще далека от разрешения. Для описания изотермы адсорбции предложен ряд эмпирических формул. Из них наиболее широко используется уравнение Фрейндлиха :
где X — количество адсорбированного вещества, моль; m — масса адсорбента; с — равновесная концентрация, b и 1/n – константы.
Константы b и 1/n уравнения Фрейндлиха легко найти графически по изотерме, построенной в логарифмических координатах:
Это уравнение прямой. Тангенс угла наклона этой прямой равен 1/n, а отрезок, отсекаемый прямой на оси ординат, равен lnb. Константа b обычно колеблется в широких пределах. Физический смысл ее становится ясным, если принять с=1, тогда b представляет собой величину адсорбции при равновесной концентрации адсорбата 1 моль/л. Показатель 1/n принимается постоянным, лежащим в пределах 0,2 -1,0 для адсорбции из газовой среды и 0,1 — 0,5 для адсорбции из растворов. Поэтому уравнение Фрейндлиха пригодно лишь для концентраций, меньших 0,5 моль/л.2.
Мономолекулярная адсорбция. Изотерма адсорбции Ленгмюра
Фундаментальным вкладом в учение об адсорбции явилась теория Ленгмюра . Эта теория позволяет учесть наиболее сильные отклонения от закона Генри, связанные с ограниченностью поверхности адсорбента. Это обстоятельство приводит к адсорбционному насыщению поверхности адсорбента по мере увеличения концентрации адсорбируемого вещества. Это положение является основным в теории Ленгмюра и уточняется следующими допущениями:
- адсорбция локализована на отдельных адсорбционных центрах, каждый из которых взаимодействует только с одной молекулой адсорбата. На поверхности адсорбента образуется поэтому мономолекулярный слой адсорбата;
- адсорбционные центры энергетически эквивалентны;
- адсорбированные молекулы не взаимодействуют друг с другом.
Для вывода изотермы адсорбции Ленгмюра учтем, что при установлении в системе адсорбционного равновесия скорость адсорбции ([TEX]V\downarrow [/TEX])должна равняться скорости десорбции( [TEX]V\uparrow [/TEX] ). Для того, чтобы молекула адсорбировалась, она должна удариться о поверхность и попасть на незанятое место. Учитывая, что число ударов пропорционально концентрации С, а вероятность попасть на незанятое место пропорционально их числу, имеем
где[TEX]\Theta[/TEX]- доля занятых мест,[TEX]k_1[/TEX]- константа скорости адсорбции. Скорость десорбции прямо пропорциональна числу адсорбированных молекул:
где[TEX]k_2[/TEX]- константа скорости десорбции.
где[TEX] K=k_1/k_2[/TEX]- константа адсорбционного равновесия.
Обозначим символом[TEX]a_\infty[/TEX]максимальную адсорбцию или емкость адсорбционного монослоя. Тогда
Это уравнение носит название изотермы адсорбции Ленгмюра. Для газов и паров концентрацию можно заменить пропорциональным ей значением давления и изотерма адсорбции примет вид
Константы адсорбционного равновесия К и[TEX]K_p[/TEX]характеризуют энергию взаимодействия адсорбата с адсорбентом. Чем сильнее это взаимодействие, тем больше значение константы адсорбционного равновесия.
Важны экстраполяционные следствия уравнения изотермы Ленгмюра. При[TEX]C\rightarrow<0>[/TEX]имеем[TEX]a=a_\infty<\cdot>K\cdot
Эти выражения соответствуют закону Генри: величина адсорбции линейно растет с увеличением концентрации. Таким образом уравнение Ленгмюра является более общим соотношением, включающим и уравнение Генри.
При больших концентрациях, когда[TEX] K_c\gg1[/TEX]
Эти соотношения отвечают насыщению, когда вся поверхность адсорбента покрывается мономолекулярным слоем адсорбата. Экспериментальные результаты по определению изотермы адсорбции обычно обрабатывают с помощью уравнения Ленгмюра, записанного в линейной форме:
Методика нахождения коэффициентов уравнения Ленгмюра показана на рис. 9.2.
Рисунок 9.2 ‒ К нахождению констант уравнения Ленгмюра
Полимолекулярная адсорбция. Уравнение БЭТ
Опыт показывает, что наряду с изотермами адсорбции, которые описываются уравнением Ленгмюра и о которых мы говорили, часто встречаются изотермы, не имеющие участка, параллельного оси давлений и отвечающего насыщению поверхности адсорбента молекулами адсорбата. Такая изотерма — показана на рис 9.3. Это связано с явлением, при котором на активных центрах поверхности адсорбента образуются несколько слоев молекул или ионов адсорбата — полимолекулярная адсорбция .
Наиболее удачная теория (из многочисленных), описывающая подобные процессы была создана в 1935-1940 гг. Брунауэром, Эмметом, Теллером применительно к адсорбции паров. Их теория получила название теории БЭТ. Ее основные положения:
- Адсорбционные слои полимолекулярны, причем их толщина на разных участках поверхности различна.
- Адсорбционные силы тождественны силам, вызывающим конденсацию.
Рисунок 9.3 ‒ Изотерма полимолекулярной адсорбции
Последнее положение может быть обосновано следующим образом: лишь первый слой молекул адсорбата находится в непосредственной близости к поверхности твердого тела. Второй, и особенно последующие слои, прилегают к молекулам, подобным им, и их образование напоминает обычную конденсацию пара на поверхности жидкости.
На основании этих представлений Брунауэр, Эммет и Теллер вывели следующее уравнение изотермы адсорбции паров:
где[TEX]K_П[/TEX]- константа равновесия полимолекулярной адсорбции, Р — давление пара, [TEX]P_s[/TEX] — давление насыщенного пара при данной температуре,[TEX]a_\infty[/TEX]- емкость монослоя.
При низких давлениях, когда[TEX]p/p_s\ll 1[/TEX], учитывая, что[TEX]K_p=K_П\cdot<1/p_s>[/TEX], получаем уравнение Ленгмюра:
Уравнение изотермы полимолекулярной адсорбции БЭТ легко привести к линейной форме:
По наклону этой прямой и отсекаемому ею отрезку на оси ординат можно найти значения констант[TEX]a_\infty[/TEX]и[TEX]K_П[/TEX].
Теория БЭТ, так же как и теория Ленгмюра, указывает путь для определения удельной поверхности адсорбента (любого твердого вещества). Для этого находят емкость монослоя [TEX]a_\infty[/TEX] для паров простых веществ ( [TEX]N_2[/TEX] , Ar, Kr) при низких температурах. Затем, зная площадь [TEX]S_0[/TEX] , занимаемую одной молекулой простого вещества, вычисляют удельную поверхность адсорбента:
где [TEX]N_a[/TEX] — число Авогадро. Это метод определения удельной поверхности по БЭТ.
Энергетические параметры адсорбции на однородной поверхности
Между энергией Гиббса, энтальпией и энтропией адсорбции существует известное соотношение:
Адсорбция — самопроизвольный процесс, а всякому самопроизвольному процессу при P,T=const отвечает условие [TEX]\Delta [TEX]\Delta
Если адсорбция подчиняется уравнениям Генри и Ленгмюра, т.е. константа равновесия адсорбции в этих уравнениях не зависят от степени заполнения поверхности, то стандартная энергия Гиббса адсорбции может быть рассчитана по уравнению, справедливому для химических реакций:
Энтальпию адсорбции определяют из экспериментальной зависимости константы равновесия адсорбции от температуры в соответствии с уравнением изобары Вант-Гоффа
Принимая во внимание слабую зависимость изменения энтальпии от температуры, находим
Тангенс угла наклона прямой lnK — 1/T равен -[TEX]\Delta
Энтропию адсорбции, подчиняющейся закону Генри или уравнению Ленгмюра, легко рассчитать, если известны [TEX]\Delta
Данные соотношения для расчета энергетических параметров адсорбции получены, исходя из предположения, что поверхность адсорбента однородна (эквипотенциальна) и на ней образуется мономолекулярный слой адсорбата.
Если адсорбция происходит на неоднородной поверхности, то наиболее реакционноспособные адсорбционные центры будут заняты уже при малых равновесных концентрациях. Таким образом, энергетические параметры адсорбции зависят от степени заполнения поверхности адсорбатом. Например, дифференциальная теплота адсорбции будет уменьшаться по мере заполнения поверхности.
Взаимодействие частиц в адсорбционном слое и классификация изотерм адсорбции
Одним из опорных пунктов теории Ленгмюра является константа отсутствия взаимодействия частиц адсорбата в адсорбционном слое, Однако ленгмюровская адсорбция является лишь частным случаем в многообразном мире адсорбционных процессов. На рис. 9.4 показаны различные формы изотерм адсорбции из разбавленных растворов.
Рисунок 9.4 ‒ Формы изотерм адсорбции
Исходя из формы начального участка были выделены четыре характерных класса изотерм (S, L, H, C). Деление изотерм на отдельные типы внутри каждого класса связано с последующим изменением их формы при наиболее высоких концентрациях. Класс L (класс Ленгмюра) является наиболее общим. Изотермы типа L2 достигают насыщения, дальнейшая адсорбция выше этого уровня дает изотерму типа L3. Если достигается второе плато, то имеем дело с изотермой L4. Для изотерм типа L5 характерно наличие максимума. Максимум отражает изменение состояния вещества в растворе — например, ассоциацию молекул при определенной концентрации. Сходный, хотя и не столь полный, набор типов изотерм получен и для других классов.
Начальный участок изотерм S — класса выгнут относительно оси концентраций, однако далее часто следует точка перегиба, что и придает изотерме характерную S -обратную форму.
Изотермы класса Н (высокое сродство – higf) наблюдается при чрезвычайно сильной адсорбции при очень низких концентрациях; они пересекаются с осью ординат. Изотермы класса С (constant) имеют начальный линейный участок, что указывает на постоянное распределение растворенного вещества между раствором и адсорбентом (постоянная скорость адсорбции).
Теоретический анализ различных типов изотерм адсорбции позволяет получить много полезной информации о механизме адсорбции. При этом следует принимать во внимание величину энергии активации процесса удаления молекул адсорбата с поверхности адсорбента. Если взаимодействие между адсорбированными молекулами пренебрежимо мало, энергия активации не зависит от степени заполнения поверхностиf a это приведет к изотерме типа L или Н.
Если сила взаимодействия между адсорбированными молекулами больше силы взаимодействия между растворенным веществом и адсорбентом, энергия активации возрастает и адсорбция описывается изотермой типа S. В этом случае молекулы растворенного вещества стремятся расположиться на поверхности в виде цепей.
Изотермы типа Н наблюдаются в тех случаях, когда имеет место хемосорбция.
Изотерма типа С характерна для адсорбции на микропористых адсорбентах и соответствует таким условиям, при которых число адсорбционных центров остается постоянным в широкой области концентраций. По мере заполнения одних центров появляются новые, и доступная для адсорбции поверхность увеличивается пропорционально количеству адсорбированного вещества.
3.2.2. Модели полислоя
Анализ изотерм адсорбции указывает, что процесс адсорбции во многих случаях не ограничивается образованием монослоя и уже при сравнительно низких значениях относительного давления Р/Рs > 0,1 образуются, как правило, полимолекулярные слои. Брунауэр, Демминг, Демминг и Теллер выделили пять основных типов изотерм адсорбции газов на твердых адсорбентах, приведенных на рис. 1.28.
Тип I. Изотерма описывается теорией монослоя и уравнением Ленгмюра при асимптотическом приближении количества адсорбированного газа к емкости монослоя.
Тип II. Наиболее общий тип изотермы, соответствующий формированию полислоя на поверхности с высоким адсорбционным потенциалом.
Тип III. Сравнительно редко встречающийся тип изотерм образования полислоя из газовой среды на твердом адсорбенте, для тел, потенциал монослоя которых мал и имеет тот же порядок, что и теплота конденсации адсорбтива.
Типы IV и V аналогичны типам II и III и характерны для пористых сорбентов, где адсорбция ограничивается объемом мезопор (2-50 нм), а предельная адсорбция достигается при давлениях Р/Рs
Теория полимолекулярной адсорбции была развита в работах Брунауэра, Эммета и Теллера (БЭТ). В основе этой теории лежит распространение обобщенных представлений локализованного монослоя на полислойную адсорбцию. В теории БЭТ используется предпосылка, что молекулы каждого предыдущего адсорбционного слоя служат активными центрами при образовании последующих слоев. Это предполагает, что емкость каждого слоя одинакова. Считается, что силами взаимодействия между молекулами в каждом адсорбционном слое можно пренебречь (отсутствие латеральных взаимодействий), а молекулы каждого адсорбционного слоя локализованы. Полагается, что адсорбционный потенциал в первом адсорбционном слое значительно выше, чем в других слоях, а начиная со второго адсорбционного слоя он сопоставим с энергией конденсации (изотермы типа II, IV) или для всех слоев одинаков (изотермы III, IV).
Существует несколько методик вывода уравнений изотермы полимолекулярной адсорбции. В работах Брунауэра с сотрудниками использовался кинетический вывод уравнения изотермы полимолекулярной адсорбции. Позднее вывод этого уравнения был осуществлен методом статистической термодинамики.
В оригинальном кинетическом выводе уравнения изотермы адсорбции БЭТ рассматривается равновесие между адсорбционными комплексами различного заполнения. Считается, что на поверхности адсорбента одновременно могут находиться незаполненные активные центры и адсорбционные комплексы, содержащие 1, 2, 3. i, молекул адсорбата, которым соответствует площадь поверхности адсорбентаA0, A1, A2, A3, …Ai.
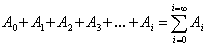
Доля пустых мест 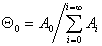
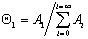
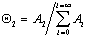
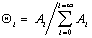
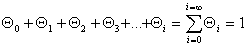
В равновесном состоянии системы рассматривается равновесие между предыдущим и последующим слоями, например считается, что скорость адсорбции на незаполненных участках (активных центрах) равна скорости десорбции с активных мест, занятых одной молекулой. Тогда по аналогии c выводом уравнения Ленгмюра (1.3.32) для первого слоя получаем
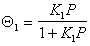
гдеK1 – постоянная равновесия адсорбции в первом адсорбционном слое.
Перепишем уравнение (1.3.36) в виде 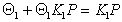
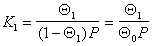
Аналогично для слоев, содержащих одну и две молекулы 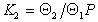
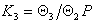
В общем случае для равновесия между слоями, содержащими iи i-1 молекул
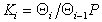
Для равновесной адсорбции 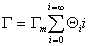
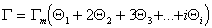
Брунауэр ввел упрощенное допущение, что начиная со второго слоя адсорбционный потенциал остается неизменным и соответствует энергии конденсации. Это означает, что
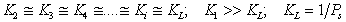
Учитывая (1.3.40), можно выразить доли поверхности, занятые активными центрами, различными по заполнению молекулами, через долю свободной поверхности и постоянную равновесия:
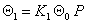
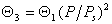
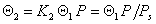
или в общем виде
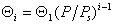
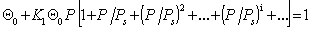
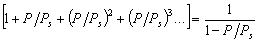
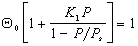
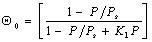
Подставляя в уравнение (1.3.39 ) соответствующее выражение, получаем
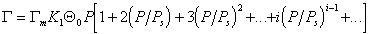
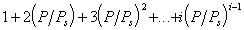
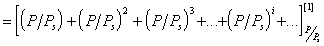
=
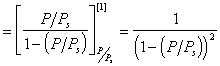
получаем с учетом (1.3.43)
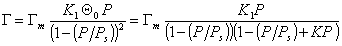
Так как 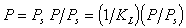
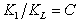
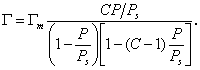
Уравнение (1.3.47) известно как простая форма изотермы адсорбции БЭТ. Это уравнение может быть представлено в линейной форме. Обозначим для упрощения Р/РS=Х и раздадим на X обе части уравнения (1.3.47):
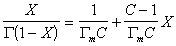
В такой форме график зависимости (1.3.48) должен давать прямую с наклоном 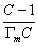
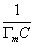
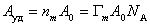
где Гm должна быть выражена в моль/г; А0– называют площадью молекулярного сечения адсорбата или чаще – адсорбционной «посадочной площадкой» (этот параметр представляет собой площадь, которую занимает молекула адсорбата в насыщенном мономолекулярном слое).
Температурная зависимость постоянных равновесия K1 и С позволяет определить чистую теплоту адсорбции, так как
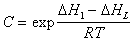
где DH1 , DHL – теплота адсорбции в первом адсорбционном слое и теплота конденсации адсорбата.
Если адсорбент пористый и адсорбция идет в результате заполнения мезопор, то уравнение БЭТ принимает вид
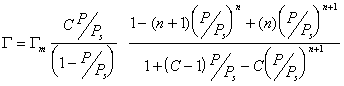
Интересно отметить, что уравнение (1.3.51) при n=1 переходит в уравнение Ленгмюра
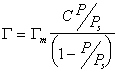
в то время как уравнение БЭТ в простейшей форме (1.3.47) может перейти в уравнение Ленгмюра только при дополнительных условиях, чтоС>>1 и Р/Рs 2, то уравнение БЭТ дает изотермы типа II, при С 0,3 проявляется латеральное взаимодействие в адсорбционных споях.
Статистико-механическая трактовка полимолекулярной адсорбции и соответствующий вывод уравнения изотермы не позволяют снять указанные выше ограничения.
Кроме того, предпринимались неоднократные попытки модифицировать уравнение БЭТ. Так Андерсон предположил, что от второго до примерно девятого слоев теплота адсорбции отличается oт теплоты конденсации на некоторую постоянную величину. Это позволило ввести в простейшее уравнение некоторую постоянную K 2 /г, включив в нее изотерму адсорбции на природном кварце и различных образцах непористого и аморфного кремнезема. Такие стандартные изотермы получены и для других систем.
Многочисленные эксперименты на непористых сорбентах показали, что для определения удельной поверхности твердых адсорбентов наиболее удобно простейшее уравнение БЭТ. Для таких целей используют азот, аргон и криптон. Последний предпочтительнее для адсорбентов с малой величиной удельной активной поверхности.
Вместе с тем, известен ряд случаев, когда и при адсорбции азота на непористых сорбентах с малой удельной активной поверхностью при низких относительных давлениях 0,005 2 /г. Эти величины укладываются в пределы значений, приведенных в табл. 1.6.
Следует отметить, что основной недостаток метода БЭТ при определении удельной активной поверхности волокон состоит в том, что изучается образец волокна в сухом состоянии, которое значительно отличается от состояния волокна в растворах в контакте с различными веществами, способными к адсорбции, например, при крашении, отделке, поверхностной модификации и т.д. Как правило, при увлажнении водой удельная активная поверхность большинства волокон существенно увеличивается, особенно если волокно способно набухать в воде (хлопок, целлюлоза, шерсть, вискоза и др.). Кажущаяся или эффективная площадь поверхности таких волокон может изменяться на несколько порядков в зависимости от природы адсорбционного слоя. В последнем случае возможность использования понятия площади поверхности к адсорбции поверхностно-активных веществ из водных растворов, особенно изменяющих надмолекулярную структуру поверхностного слоя полимера и способствующих набуханию полимерных волокон, вызывает некоторые затруднения.
Более подробно на этой проблеме мы остановимся позднее. В ряде случаев для характеристики влажной поверхности может быть использована адсорбция некоторых красителей из водных растворов. Адсорбция из неполярной среды (e
http://elearning.sumdu.edu.ua/free_content/lectured:eb3ba2f9c8c4751fb7ceecdce87ed213c32f662c/20160427131814/65693/index.html
http://xumuk.ru/colloidchem/44.html