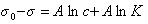Изотерма поверхностного натяжения. Уравнение Шишковского.
Изотерма поверхностного натяжения.Уравнение
Шишковского
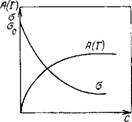
Зависимость поверхностного натяжения растворов ПАВ от их концентрации выражается при каждой данной постоянной температуре изотермами. Общий вид такой изотермы показан на рис. 1.1. Изотерма поверхностного натяжения выходит из точки s0 на оси ординат, которая отвечает поверхностному натяжению чистого растворителя. С повышением концентрации ПАВ поверхностное натяжение плавно снижается, стремясь к некоторому минимальному постоянному значению, характерному для каждого данного ПАВ.
 |
Изотермы поверхностного натяжения могут быть описаны с помощью уравнения Б. Шишковского (1908):

где s — поверхностное натяжение раствора ПАВ; Ds — понижение поверхностного натяжения раствора ПАВ с концентрацией С по сравнению с s0 — поверхностным натяжением растворителя (например, воды) при данной температуре; а и b — константы. Константа а характерна для каждого гомологического ряда; коэффициент b индивидуален для каждого отдельного ПАВ.
64. Мицеллообразование в растворах ПАВ. Критическая концентрация мицелообразования в растворах (ККМ1 И ККМ2). Методы определения ККМ.
Мицеллообразующие ПАВпри малых концентрациях существуют в растворах в виде отдельных молекул или ионов. При увеличении концентрации раствора их молекулы (ионы) ассоциируют друг с другом, образуя вначале димеры, тримеры и другие ассоциаты. После превышения некоторой, характерной для каждого данного ПАВ, концентрации, называемой критической концентрацией мицеллообразования(ККМ), МПАВ существуют в растворе в виде особого рода образований, называемых мицеллами. Для большинства ПАВ ККМ лежит в пределах 10 -5 ¸ 10 -2 моль/л.
Под мицеллой ПАВ понимают агрегат дифильных молекул, лиофильные группы которых обращены к соответствующему растворителю, а лиофобные соединяются друг с другом, образуя ядро мицеллы. Процесс мицеллообразования обратим, так как при разбавлении раствора мицеллы распадаются на молекулы и ионы.
В водных растворах при концентрациях, ненамного превышающих ККМ, образуются сферические мицеллы («мицеллы Гартли»). Внутренняя часть мицелл Гартли состоит из переплетающихся углеводородных радикалов, а полярные группы молекул ПАВ обращены в водную фазу. Диаметр таких мицелл приблизительно равен удвоенной длине молекул ПАВ. Число молекул в мицелле (степень агрегации) растёт до какого-то предела (обычно 30 — 100 молекул), после чего с дальнейшим ростом концентрации не изменяется, но число мицелл увеличивается.
При более высоких концентрациях мицеллы Гартли взаимодействуют друг с другом, что приводит к их деформации. Они могут принимать цилиндрическую, дискообразную, палочкообразную, пластинчатую форму (“мицеллы Мак-Бена”). При концентрациях примерно в 10 — 50 раз больше ККМ (т. н. ККМ2) мицеллы приобретают цепочечную ориентацию и вместе с молекулами растворителя способны образовывать студнеообразное тело. При добавлении к таким концентрированным мицеллярным растворам ПАВ нейтральных солей — NaCl, КCl, NH4NO3 и т. п., — соли отнимают у мицелл воду, входящую в гидратную оболочку (дегидратируют мицеллы), и облегчают объединение мицелл. При этом ПАВ в зависимости от плотности выпадает в осадок или всплывает на поверхность. Такое выделение ПАВ из мицеллярных растворов называется высаливанием.
Методы определения ККМ основаны на регистрации резкого изменения физико-химических свойств растворов ПАВ в зависимости от концентрации (например, поверхностного натяжения а, мутности т, эквивалентной электропроводности К, осмотического давления я, показателя преломления п). На кривой зависимости свойство — состав в области ККМ обычно появляется излом. Одна из ветвей кривых (при более низких концентрациях) описывает свойства системы в молекулярном состоянии, а другая — в коллоидном. Абсциссу точки излома условно считают соответствующей переходу молекул в мицеллы, т. е. критической концентрации.
Кондуктометрический метод применяется для определения ККМ ионогенных ПАВ.
Другой метод определения ККМ основан на измерении поверхностного натяжения водных растворов ПАВ, которое резко уменьшается с ростом концентрации вплоть до ККМ, а затем остается постоянным. Этот метод применим как для ионогенных, так и для неионогенных ПАВ, однако при наличии примесей точку излома на кривой о—с установить трудно.
1.5. Поверхностное натяжение растворов и адсорбция
Свободная поверхностная энергия самопроизвольно может только уменьшаться, что проявляется в уменьшении либо поверхности раздела фаз, либо межфазного (поверхностного) натяжения. Поверхностное натяжение может уменьшаться в результате самопроизвольного перераспределения компонентов системы между объемами фаз a и b и поверхностью их раздела. В поверхности раздела фаз будут преимущественно концентрироваться те компоненты, которые способны уменьшать избыточную свободную поверхностную энергию. Это явление получило название «адсорбция». Количественно мерой адсорбции служит избыток вещества в поверхностном слое определенной толщины по сравнению с его количеством в таком же слое в объеме фазы. Этот избыток обычно относят к единице площади поверхности (или к единице массы адсорбента). Такая адсорбция называется гиббсовской и обозначается буквой Гi. Поверхностный избыток является алгебраической величиной. Если он положителен, то вблизи поверхности данный компонент присутствует в избытке, если отрицателен, то концентрация компонента на поверхности фазы ниже, чем в ее объеме .
Рассмотрим распределение в системе i -го компонента, предполагая, что это вещество способно понижать поверхностное натяжение. В соответствии с уравнением (1.1.6) число молей n вещества i-го компонента в системе определяется как 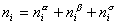
Количество вещества в обеих фазах составляет
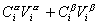
где С a , С b — концентрация вещества в фазах a, b.
Количество вещества на поверхности раздела фаз 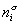
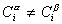
Учитывая уравнение (1.1.81) ,
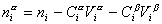
Разделив выражение (1.1.82) на площадь поверхности раздела фаз А, можем определить гиббсовскую адсорбцию:
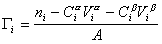
Фундаментальным уравнением физической химии поверхностей является взаимосвязь между адсорбцией и межфазным натяжением, которую можно определить экспериментально при одновременном изменении многих факторов. Остановимся на системах, в которых адсорбция протекает при постоянной температуре. Связь между адсорбцией и межфазным натяжением при постоянной температуре T называется изотермой адсорбции, фундаментальное уравнение которой известно как уравнение Гиббса. Рассмотрим его вывод.
При небольшом обратимом изменении энергии системы dU с учетом формулы (1.1.4) можем написать
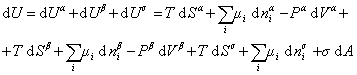
где U – полная внутренняя энергия системы; U a , U b , U s – внутренняя энергия фаз aиb и поверхности их раздела; P a , P b — давление в фазах aиb; m — химический потенциалi-того компонента; S a , S b , S s – энтропия фаз a иb и их поверхности раздела; s — поверхностное натяжение.
Поскольку из курса химической термодинамики известно, что
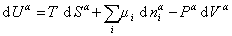
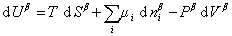
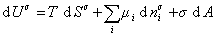
Если энергию, энтропию и количество компонентов увеличивать от нуля до некоторого определенного значения при постоянстве температуры T, площади поверхности раздела фаз A и количестве вещества на этой поверхности 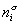
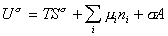
дифференцирование которого приводит к выражению
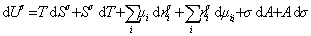
Сравнивая его с уравнением (1.1.88), получаем
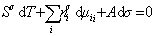
В расчете на единицу поверхности
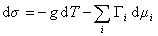
где 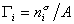
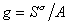
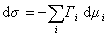
Для двухкомпонентной системы
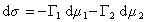
где индекс 1 относится к растворителю, а индекс 2 – к растворенному веществу.
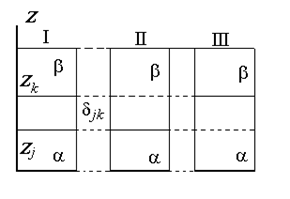
Разделяющая поверхность Гиббса может быть проведена так, чтобы обратилась в нуль адсорбция любого наперед заданного компонента, но только одного, как это показано на рис. 1.15.
Расстояние между двумя плоскостями (разделяющими поверхностями), одна из которых соответствует условию Гj = 0, а другая — Гk = 0, обозначим dkj:
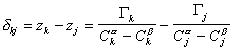
где Гk, Гj– избытки 
Поскольку значения Г1 в уравнении (1.1.93) определены относительно произвольно выбранного положения разделяющей плоскости, то ее можно расположить так, чтобы избыток растворителя в поверхностном слое был равен нулю ( Г1 = 0).
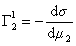
где верхний индекс 1 означает, что для выбранной поверхности раздела Г1=0.
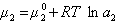
получаем после дифференцирования уравнения (1.1.96)
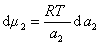
где 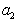
Поэтому, подставляя уравнение (1.1.97) в уравнение (1.1.95), получаем
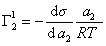
Из уравнения (1.1.98) следует, что если 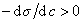
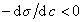
Поскольку 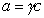
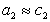
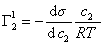
Уравнение (1.1.99) представляет собой наиболее употребляемую форму изотермы адсорбции Гиббса, причем так как рассматривается адсорбция именно растворенного вещества, индексы при адсорбции и концентрации опускают, т.е.
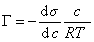
Исследования показывают, что существуют такие вещества, растворение которых приводит к резкому снижению поверхностного натяжения раствора. Эти вещества называют поверхностно-активными. В соответствии с уравнением Гиббса адсорбция их всегда положительна, т.е. концентрация в поверхностном слое выше объемной концентрации. По предложению Ребиндера мера поверхностной активности обозначается первой буквой фамилии Гиббса. Обычно используют значения поверхностной активности в бесконечно разбавленных растворах
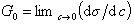
К классу поверхностно-активных веществ (ПАВ) относятся жирные кислоты и их соли (мыла), сульфокислоты, их соли, спирты, алкилсульфоэфиры и др. Если 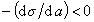
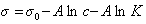
Обозначим постоянной В постоянные при изотермических условиях величины 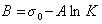
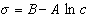
Следовательно, при относительно высокой концентрации растворов ПАВ их поверхностное натяжение должно уменьшаться экспоненциально с увеличением концентрации.
Уравнение (1.1.107) может быть получено непосредственно из уравнения изотермы адсорбции Гиббса:
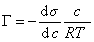
При достаточно высокой концентрации растворенного вещества адсорбция достигает предела , т.е. Г = Гmax , поэтому
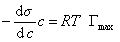
где при постоянной температуре правая часть представляет собой постоянную величину и может быть обозначена RT Гmax = A. Следовательно,
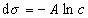
откуда после интегрирования получаем
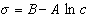
Таким образом, уравнение Шишковского может быть выведено из уравнения Гиббса, так как уравнения (1.1.107) и (1.1.109) идентичны. Точность уравнения Шишковского связана с тем, что в нем уже заложено условие насыщения адсорбционного слоя.
Если уравнение Шишковского в форме
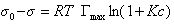
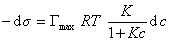
и подставить в уравнение Гиббса величину
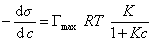
то уравнение изотермы адсорбции примет вид
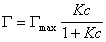
В такой форме уравнение изотермы адсорбции носит название изотермы Ленгмюра. Американский ученый И. Ленгмюр в 1917 г. развил представление о мономолекулярной адсорбции и на основании молекулярно- кинетической теории получил уравнение (1.1.113) .
Уравнение Шишковского позволяет определить предел адсорбции (при Kc>>1), так как в таком случае это уравнение принимает вид
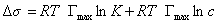
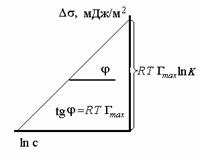
Построив график 
Понимание адсорбционных процессов имеет чрезвычайно важное значение, так как они лежат в основе многих процессов, протекающих на границе раздела фаз, например крашения, отмывания загрязнений, отделки текстильных материалов и т.д., т.е. в основе всех коллоидно -химических процессов на границе жидкость–газ.
Лако-красочные материалы — производство
Технологии и оборудование для изготовления красок, ЛКМ
Изотермы адсорбции и поверхностного натяжения растворов ПАВ
Поверхностно-активные вещества (ПАВ), молекулы которых имеют дифильное строение и включают большой углеводородный радикал, отличаются высокой поверхностной активностью по отношению к воде, что отражает сильную зависимость поверхностного натяжения водного раствора ПАВ от их концентрации. Большие значения поверхностной активности предполагают пренебрежимо малые концентрации ПАВ в объеме раствора по сравнению с концентрацией их в поверхностном слое, т. е. с величиной их адсорбции на границе раствор — воздух. Подобная зависимость может обнаруживаться и в растворах других веществ на границе с жидкостью или твердым телом, например при специфическом взаимодействии с поверхностью. Отмеченная особенность позволяет пренебречь разницей между величиной адсорбции А и величиной гиббсовской адсорбции Г, т. е. Из этого соотношения следует, что
Для растворов ПАВ все уравнения адсорбции, включающие величину адсорбции А, будут также справедливы, если заменить А на Г. Одним из таких уравнений является выражение закона Генри, который характеризует адсорбцию при малых концентрациях.
Применительно к адсорбции неионогенных (недиссоцииру- ющих) ПАВ закон Генри запишется так:
В такой записи закон Геирп можно сопоставить с адсорбционным уравнением Гиббса (11.71):
Рис. III.19. Изотермы адсорбции и поверхностного натяжения для растворов ПАВ в области действия закона Генри
Рис. 111.20. Изотермы адсорбции и поверхностного натяжения для растворов ПАВ в области действия изотермы Ленгмюра
Разделим переменные и проведем интегрирование уравнения (III. 120) в пределах от Оо (поверхностное натяжение чистого растворителя) до о и соответственно от с = 0 до с:
После интегрирования получим
О = о0 — KrRTc (III.121)
Таким образом, в области действия закона Генри поверхностное натяжение линейно уменьшается с увеличением концентрации неионогенного ПАВ (рис. III.19). Тангенс угла наклона прямой A = F(C) определяет поверхностную активность (с обратным знаком), а из уравнений (III.120) — (III.121) следует, что
Т. е. поверхностная активность ПАВ пропорциональна константе распределения Генри.
При увеличении концентрации ПАВ закон Генри перестает соблюдаться и поэтому необходимо обратиться к уравнению изотермы адсорбции с константой обмена К (III. 105). Если выразить молярную долю ПАВ в поверхностном слое х через величину адсорбции А, получим:
После разделения переменных имеем:
После интегрирования получим уравнение Шишковского, характеризующее поверхностное натяжение растворов ПАВ в зависимости от концентрации:
А = а0 — А^Т In (1+/Сс) (I1I.125>
Подобную зависимость о от с для ПАВ Б. А. Шишковский получил опытным путем. Ленгмюр, связав уравнение Гиббса со своим уравнением, определил физический смысл констант эмпирического уравнения Шишковского. Одна из них равна произведению AXRT, другая константа Д имеет смысл константы адсорбционного равновесия в уравнении Ленгмюра (или константы обмена). Допущения, принятые при выводе уравнения Шишковского, показывают, что это уравнение в отличие от уравнений Гнббса и Ленгмюра справедливо только для по — верхностно-активных веществ, обладающих высокой поверхностной активностью.
Зависимость поверхностного натяженния растворов ПАВ от их концентрации в соответствии с уравнением Шишковского показана на рис. III.20. Из рис. III.20 видно, что при малых концентрациях ПАВ в растворе поверхностное натяжение снижается резко, но с ростом концентрации степень его снижения уменьшается и о стремится к постоянному значению. Из вывода уравнения Шишковского следует, что такой ход зависимости о от с обусловлен теми же причинами, что и снижение прироста адсорбции, а именно уменьшением концентрации свободных от ПАВ адсорбционных центров. Уравнение Шишковского, как и уравнение Ленгмюра, не учитывает взаимодействия молекул ПАВ на поверхности.
Ю. Г. Фроловым были проанализированы особенности изотерм адсорбции и поверхностного натяжения для растворов ионогенных ПАВ и получены соответствующие уравнения. Эти особенности обусловлены протеканием диссоциации ионогенных
ПАВ в объеме, например водного раствора, и отсутствием диссоциации (или значительном уменьшении) в поверхностном слое, так как смежная фаза обычно неполярна. Проводя вывод уравнения концентрационной зависимости адсорбции ионогенных ПАВ аналогично выводам закона Генри и уравнения Ленгмюра и используя при этом выражение для актив — — ности электролитов (ПАВ), представленное через средние ионные-концентрации с±, получим следующие изотермы адсорбции ионогенных ПАВ:
Где v=v+ + v_ — стехнометрические коэффициенты соответственно катиона и аниоиа в формуле электролита.
Выводы, аналогичные выводам соотношений (III.121) и (III.125) приводят к следующим изотермам поверхностного натяжения растворов ионогенных ПАВ в соответствующих областях концентраций:
О=Оо — Л«ЯГ1п (1+ЛГсМ (III.129)
Особенности изотермы адсорбции ионогенных ПАВ, вытекающие из уравнений (III.126) —(III.127), иллюстрируются на рис. III.21. Во-первых, в области малых концентраций (с-*-0) изотерма адсорбции представляет собой параболу, а коэффициент распределения ионогенного ПАВ при с-Я) стремится к нулю [D = A/C = Kc±V
1, см. уравнение (III.126)], а не к постоянной величине, как это следует для неэлектролитов из закона Генри. Во-вторых, изотерма адсорбции имеет перегиб при значении концентрации, вблизи которого кривая коэффициента распределения ионогенного ПАВ проходит через максимум.
Закономерности адсорбции ионогенных ПАВ соответствующим образом отражаются и на особенностях изотермы поверхностного натяжения их растворов (см. рис. 111.21). Изотерма о(с) при малых концентрациях, в отличие от изотермы для растворов неионогенных ПАВ, представляет собой параболу (III.128); с увеличением концентрации обнаруживается перегиб в соответствии с уравнением (III. 129).
Из определения поверхностной активности ионогенных ПАВ (11.77), являющегося наиболее общим (для неионогенных ПАВ v=l), следует ее пропорциональность константе распределения (III.128):
G±=— (da/de±)c »о= KrRT ШІ.130»
Зависимость производной, определяющей поверхностную активность, от концентрации в более общем виде можно получить из соотношения (III.129):
Обозначим 1-)-Kc^’ — y, тогда Dy = Kdc±
Del 1 + Kcl 1 + Kc±
Для неионогенных ПАВ v=l.
Дальнейшее увеличение концентрации как ионогенных, так и неионогенных ПАВ с большой поверхностной активностью (выше растворимости) может привести к появлению мицелл в растворе и на межфазной поверхности, что равнозначно возникновению новой фазы (механизм образования мицелл ПАВ рассматривается в разд. VLB, посвященном растворам коллоидных ПАВ). Поэтому закономерность изменения величины адсорбции с увеличением концентрации ПАВ меняется.
http://xumuk.ru/colloidchem/27.html
http://kraska.biz/poverxnostnye-yavleniya-i-dispersnye-sistemy/izotermy-adsorbcii-i-poverxnostnogo-natyazheniya-rastvorov-pav/