Классификация реакций
Существует несколько классификаций реакций, протекающих в неорганической и органической химии.
По характеру процесса
- Соединения
Так называют химические реакции, где из нескольких простых или сложных веществ получается одно сложное вещество. Примеры:
В результате реакции разложения сложное вещество распадается на несколько сложных или простых веществ. Примеры:
В ходе реакций замещения атом или группа атомов в молекуле замещаются на другой атом или группу атомов. Примеры:
К реакциям обмена относятся те, которые протекают без изменения степеней окисления и выражаются в обмене компонентов между веществами. Часто обмен происходит анионами/катионами:
AgF + NaCl = AgCl↓ + NaF
Окислительно-восстановительные реакции (ОВР)
Это те химические реакции, в процессе которых происходит изменение степеней окисления химических элементов, входящих в состав исходных веществ. ОВР подразделяются на:
- Межмолекулярные — атомы окислителя и восстановителя входят в состав разных молекул. Примеры:
Внутримолекулярные — атомы окислителя и восстановителя в составе одного сложного вещества. Примеры:
Диспропорционирование — один и тот же атом является и окислителем, и восстановителем
Замечу, что окислителем и восстановителем могут являться только исходные вещества (а не продукты!) Окислитель всегда понижает свою СО, принимая электроны в процессе восстановления. Восстановитель всегда повышает свою СО, отдавая электроны в процессе окисления.
От обилия информации можно запутаться. Я рекомендую сформулировать четко: «Окислитель — понижает СО, восстановитель — повышает СО». Запомнив эту информацию таким образом, вы не будете путаться.
ОВР уравнивают методом электронного баланса, с которым мы подробно познакомимся в разделе «Решения задач».
Обратимые и необратимые реакции
Обратимые реакции — такие химические реакции, которые протекают одновременно в двух противоположных направлениях: прямом и обратном. При записи реакции в таких случаях вместо знака «=» ставят знак обратимости «⇆».
Классическим примером обратимой реакции является синтез аммиака и реакция этерификации (из органической химии):
Необратимые реакции протекают только в одном направлении, до полного расходования одного из исходных веществ. Главное отличие их от обратимых реакций в том, что образовавшиеся продукты реакции не взаимодействуют между собой с образованием исходных веществ.
Иногда сложно бывает отличить обратимую реакцию от необратимой, однако я дам несколько советов, которые советую взять на вооружение. В результате необратимых реакций:
- Образуются малодиссоциирующие вещества (например — вода, однако есть исключения — реакция этерификации)
- Реакция сопровождается выделение большого количества тепла
- В ходе реакции образуется газ или выпадает осадок
Примеры необратимых реакций:
NaOH + HCl = NaCl + H2O (образуется вода)
2Na + 2H2O = 2NaOH + H2 (сопровождается выделением большого количества тепла)
Реакции и агрегатное состояние фаз
Фазой в химии называют часть объема равновесной системы, однородную во всех своих точках по химическому составу и физическим свойствам и отделенную от других частей того же объема поверхностью раздела. Фаза бывает жидкой, твердой и газообразной.
Все реакции можно разделить на гетеро- и гомогенные. Гетерогенные реакции (греч. heterogenes — разнородный) — реакции, протекающие на границе раздела фаз, в неоднородной среде. Скорость таких реакций зависит от площади соприкосновения реагирующих веществ.
К гетерогенным реакциям относятся следующие реакции (примеры): жидкость + газ, газ + твердое вещество, твердое вещество + жидкость. Примером такой реакции может послужить взаимодействие твердого цинка и раствора соляной кислоты:
Гомогенные реакции (греч. homogenes — однородный) — реакции, протекающие между веществами, находящимися в одной фазе.
К гомогенным реакциям относятся (примеры): жидкость + жидкость, газ + газ. Примером такой реакции может служить взаимодействие между растворами уксусной кислоты и едкого натра.
Реакции и их тепловой эффект
Все реакции можно разделить на те, в ходе которых тепло поглощается, или, наоборот, тепло выделяется. Представьте пробирку, охлаждающуюся или нагревающуюся в вашей руке — это и есть тот самый тепловой эффект. Иногда тепла выделяется так много, что реакции сопровождаются воспламенением или взрывом (натрий с водой).
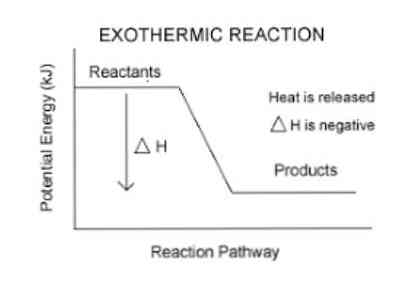
Экзотермические реакции (греч. exo — вне) — химические реакции, сопровождающиеся потерей энергии системой и выделением тепла (той самой энергии) во внешнюю среду. При написании химических реакций в конце экзотермических ставят «+ Q» (Q — тепло), иногда бывает указано точное количество выделяющегося тепла. Например:
2Mg + O2 = 2MgO + Q
NaOH + HCl = NaCl + H2O + 56 кДж
К экзотермическим реакциям часто относятся реакции горения, соединения.
Исключением является взаимодействие азота и кислорода, при котором тепло поглощается:
Как уже было отмечено выше, если тепло выделяется во внешнюю среду, значит, система реагирующих веществ потеряло это тепло. Поэтому не должно казаться противоречием, что внутренняя энергия веществ в результате экзотермической реакции уменьшается.
Энтальпией называют (обозначение Н), количество термодинамической (тепловой) энергии, содержащееся в веществе. Иногда с целью «запутывания» в реакции вместо явного +Q при экзотермической реакции могут написать ΔH 0, так как внутренняя энергия веществ увеличивается. Например:
CaCO3 = CaO + CO2↑ ; ΔH > 0 (значит реакция эндотермическая, так как внутренняя энергия увеличивается)
Замечу, что не все реакции разложения являются эндотермическими. Широко известная реакция разложения дихромата аммония («вулканчик») является примером экзотермического разложения, при котором тепло выделяется.
© Беллевич Юрий Сергеевич 2018-2022
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Процесс экзотермической реакции, типы и примеры
экзотермическая реакция это тип химической реакции, при которой происходит передача энергии, главным образом в форме выделения тепла или света. Название происходит от греческого префикса экзо, что означает «за границей»; и термин «термический», который относится к теплу или температуре.
В этом смысле экзотермические реакции могут передавать другие виды энергии в окружающую среду, где они генерируются, например, при взрывах и способе передачи кинетической и звуковой энергии, когда вещества, находящиеся в газовой фазе при высоких температурах, расширяются. насильственный путь.
Таким же образом, в случае использования батарей, также проводится экзотермическая реакция, только в этом случае транспортируется электрическая энергия..
- 1 процесс
- 2 типа
- 2.1 Реакции горения
- 2.2 Нейтрализующие реакции
- 2.3 Реакции окисления
- 2.4 Термитная реакция
- 2.5 Реакционная полимеризация
- 2.6 Ядерная реакция деления
- 2.7 Другие реакции
- 3 примера
- 4 Ссылки
процесс
Ранее было упомянуто, что когда происходит экзотермическая реакция, происходит выделение энергии, которое можно легче визуализировать в следующем уравнении:
Реагенты (ы) → Продукт (ы) + Энергия
Таким образом, для количественного определения энергии, поглощаемой или выделяемой системой, используется термодинамический параметр, называемый энтальпией (обозначается буквой «H»). Если в системе (в данном случае, химической реакции) происходит выделение энергии в окружающую среду, то изменение энтальпии (выраженное как ΔH) будет иметь отрицательное значение.
В противном случае, если изменение этой меры является положительным, оно отражает поглощение тепла из окружающей среды. Кроме того, величина изменения энтальпии системы является выражением количества энергии, передаваемой в окружающую среду или из нее..
Чем больше величина ΔH, тем больше выделение энергии из системы в окружающую среду.
Это происходит потому, что в этих реакциях чистая энергия, которая выделяется при создании новых связей, больше, чем чистая энергия, используемая при фрагментации связей.
Из вышесказанного можно сделать вывод, что такого рода реакции очень распространены, поскольку продукты реакции имеют количество энергии, запасенное в связях, больше, чем то, что содержится в реагентах..
тип
Существуют различные виды экзотермических реакций в различных областях химии, будь то в лаборатории или в промышленности; некоторые выполняются спонтанно, а другие требуют особых условий или какого-либо типа вещества, такого как катализатор, который будет произведен.
Ниже приведены наиболее важные виды экзотермических реакций:
Реакции горения
Реакции горения представляют собой реакции окислительно-восстановительного типа, которые происходят, когда одно или несколько веществ вступают в реакцию с кислородом, обычно приводя к выделению света и тепловой энергии, то есть света и тепла, когда возникает пламя..
Реакции нейтрализации
Реакции нейтрализации характеризуются взаимодействием между кислотой и щелочным веществом (основанием) с образованием соли и воды, которые проявляют экзотермическую природу..
Реакции окисления
Существует много реакций такого типа, которые демонстрируют экзотермическое поведение, потому что окисление кислорода вызывает выделение большого количества энергии, как это происходит при окислении углеводородов..
Термитная реакция
Эта реакция может давать температуру около 3000 ° C, и из-за высокого сродства алюминиевого порошка с большим количеством оксидов металлов его используют при сварке стали и железа.
Реакция полимеризации
Этот тип реакции возникает тогда, когда реагирует определенное количество химических веществ, называемых мономерами, которые представляют собой единицы, которые при объединении повторяются в цепочках с образованием макромолекулярных структур, называемых полимерами..
Реакция ядерного деления
Этот процесс относится к разделению ядра атома, считающегося тяжелым, то есть с массовым числом (А), превышающим 200, для получения фрагментов или ядер меньшего размера с промежуточной массой..
В этой реакции, где образуются один или несколько нейтронов, выделяется большое количество энергии, потому что ядро с большим весом имеет более низкую стабильность, чем его продукты..
Другие реакции
Существуют также другие экзотермические реакции, имеющие большое значение, такие как обезвоживание некоторых углеводов при взаимодействии с серной кислотой, поглощение воды, в которой гидроксид натрия находится на открытом воздухе, или окисление металлических частиц во многих реакциях коррозии..
примеров
Ниже приведены некоторые примеры экзотермических реакций, которые вызывают изменение энтальпии, которое имеет отрицательное значение из-за того, что они выделяют энергию, как упомянуто выше..
Например, сгорание пропана является спонтанной экзотермической реакцией:
Другой случай экзотермического поведения показан реакцией нейтрализации между карбонатом натрия и соляной кислотой:
Представлено также окисление этанола в уксусную кислоту, используемое в алкотестерах, полная реакция которых показана в следующем уравнении:
Другим классом экзотермической реакции является так называемая термитная реакция, в которой алюминий объединяется с оксидом металла, как показано ниже:
В дополнение к объясненным выше примерам существует множество различных реакций, которые также считаются экзотермическими, такие как разложение определенных органических отходов для компостирования..
Это также подчеркивает окисление люциферинового пигмента под действием фермента люциферазы, чтобы произвести биолюминесценцию, характерную для светлячков, и даже дыхание, среди многих других реакций.
Тест с ответами: “Химические реакции”
1. Реакция 2Н2O + 2Na = 2NaОН + Н2↑ + Q относится к реакциям:
а) присоединения, эндотермическим
б) замещения, экзотермическим +
в) разложения, экзотермическим
2. Эндотермической является эта реакция:
а) CaCO3 = CaO + СO2 +
б) CaO + H2O = Ca(OH)2
в) N2 + 3H2 = 3NH3
3. Реакция получения аммиака N2 + 3H2 ↔ 2NH3 является реакцией:
а) замещения, каталитической, эндотермической
б) обмена, некаталитической, эндотермической
в) соединения, каталитической, экзотермической +
4. Выберите реакцию обмена:
а) K2SO3 + 2HCl = 2KCl + SO2↑ + H2O +
б) 2Al + 3CuSO4 = Al2(SO4)3 + 3Cu
в) 2SO2 + O2 ↔ 2SO3
5. Реакция CaCO3 + CO2 + H2O = Ca(HCO3)2 является реакцией:
а) разложения
б) замещения
в) соединения +
6. Выберите реакцию соединения:
а) 2Al + 3CuSO4 = Al2(SO4)3 + 3Cu
б) 2SO2 + O2 ↔ 2SO3 +
в) 2H2O = 2H2 + O2
7. Выберите реакцию разложения:
а) 2SO2 + O2 ↔ 2SO3
б) K2SO3 + 2HCl = 2KCl + SO2↑ + H2O
в) 2H2O = 2H2 + O2 +
8. Какая из реакций является окислительно-восстановительной и экзотермической:
а) 2Mg + O2 = 2MgO + Q +
б) CaCO3 = CaO + CO2 – Q
в) HCl + NaOH = NaCl + H2O + Q
9. Выберите реакцию замещения:
а) 2H2O = 2H2 + O2
б) K2SO3 + 2HCl = 2KCl + SO2↑ + H2O
в) 2Al + 3CuSO4 = Al2(SO4)3 + 3Cu +
10. К окислительно – восстановительным реакциям относится реакция:
а) 2H2S +3O2 = 2H2O + 2SO2
б) Ca(OH)2 + SO3 = CaSO4 + H2O +
в) Cu(OH)2 = CuO + H2O
11. Аллотропными видоизменениями являются:
а) графит и алмаз +
б) мел и мрамор
в) аммиак и амины
12. Характеристика реакции, уравнение которой: Ba + 2H2O = Ba(OH)2+ H2+Q:
а) замещения, ОВР, эндотермическая
б) замещения, ОВР, экзотермическая +
в) обмена, ОВР, экзотермическая
13. + -2 Сокращенное ионное уравнение: 2H+SiO3=H2SiO3 соответствует взаимодействию:
а) силиката натрия и серной кислоты +
б) оксида кремния и гидроксида калия
в) оксида кремния и воды
14. Ni,t характеристика реакции уравнение которой:СН3-СН2-СН3 ——–>СН3-СН=СН2 + Н2:
а) гидрирования, гомогенная,каталитическая
б) гидратации, гетерогенная, каталитическая
в) дегидрирования, гомогенная,каталитическая +
15. При повышении температура на 10 градусов (температурный коэффициент равен 2,скорость химической реакции: А+2В=С увеличится в:
а) 2 раза +
б) 3 раза
в) 4 раза
16. Условие, при котором химическое равновесие реакции: CO2+C 2CO-Q смещается в сторону продуктов реакции:
а) понижение температуры
б) повышение температуры +
в) повышение давления
17. Среда раствора соли карбоната калия:
а) слабокислая
б) нейтральная
в) щелочная +
18. Гидролизу подвергается:
а) сульфат бария
б) сахароза +
в) глюкоза
19. Восстановитель в реакции 2СО + О2 = 2СО2:
а) 184,6 кДж
б) 138,4 кДж
в) 276,9 кДж +
20. Количество теплоты, которое выделится при взаимодействии 67,2 л. водорода с хлором: термохимическое уравнение H2+CL2=2HCL+92,3 кДж:
а) +4 С
б) +2 С +
в) 0 С
21. Тип химической реакции Zn + H2SO4 = ZnSO4 + H2:
а) замещение +
б) разложение
в) обмен
22. Тип химической реакции CaCO3 = CaO + CO2:
а) замещение
б) разложение +
в) обмен
23. Тип химической реакции N2 + 3H2 = 2NH3:
а) разложение
б) замещение
в) соединение +
24. Тип химической реакции BaCl2 + H2SO4 = BaSO4 + 2HCl:
а) соединение
б) обмен +
в) замещение
25. Вещество “Х” в схеме: Fe2O3 + 3H2=2Х + 3H2O – это:
а) оксид железа
б) гидроксид железа
в) железо +
26. Сумма вcех коэффициентов в уравнении реакции, схема которой Ca + HCl=CaCl2 + H2, равна:
а) 4
б) 5 +
в) 7
27. Выберите химическое явление:
а) горение свечи +
б) испарение бензина
в) плавление льда
28. Выберите уравнения реакции разложения:
а) 2Al(OH)3 = Al2O3 + 3H2O +
б) Fe2O3 + 2Al = Al2O3 + 2Fe
в) 2KNO3 = 2KNO2 + O2 +
29. Схема, являющаяся уравнением химической реакции:
а) Ca + O2 =CaO
б) CaCO3 =CaO + CO2 +
в) Mg + HCl=MgCl2 + H2
30. Объём водорода, который полностью прореагирует по уравнению реакции H2 + Cl2 = 2HCl с 2 моль хлора (н.у.), равен:
а) 44,8 л. +
б) 4,48 л.
в) 67,2 л.
http://ru.thpanorama.com/articles/qumica/reaccin-exotrmica-proceso-tipos-y-ejemplos.html
http://liketest.ru/ximiya/test-s-otvetami-ximicheskie-reakcii.html