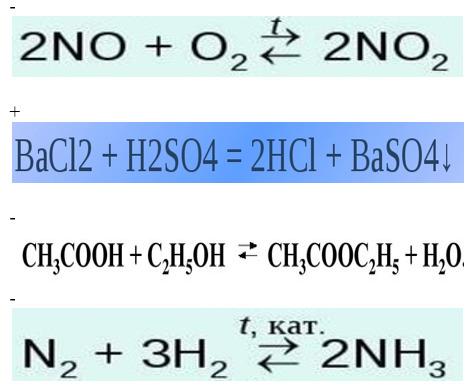контрольная работа по химии 11 класс химические реакции
1) к химическим процессам не относиться
а) крекинг углеводородов,
б) плавление льда,
в) ржавление железа,
г) образование накипи
2)реакция, уравнение которой СН4 —> CH3Cl+HCl, является:
а) замещения, гомогенной,
б) замещения, экзотермической,
в) замещения, гетерогенной,
г) обмена, каталитической
3) К окислительно-восстановительным реакциям не относятся:
а) CH4 + 2O2 —> CO2 + 2H2O,
б) C2H2 + 2Br2 —> C2H2Br,
в) K2O +N2O 2KOH,
г) 2KMnO4 K2MnO2+O2
4) Сумма коэффициентов в сокращённом ионном уравнении между хлоридом железа (3) и гидроксидом калия равна:
а) 6
б) 5
в) 4
г) 3
5) Сокращённое ионное уравнение реакции NH+OH=NH3+H2O соответствует взаимодействию веществ, формулы которых:
а) NH4Cl и H2O
б) NH4Cl(раствор) и KOH(раствор)
в) NH3 и H2O
г) NH4NO3 и Mg(OH2)
6) Гидролизу не подвергается:
а) ацетат натрия
б) хлорид цинка
в) этанол
г) жир
7) С наибольшей скоростью при комнатной температуре будет идти реакция магния
а) с 1%-ным раствором HCl
б) с 10% — ным раствором HCl
в) с 5% -ным раствором HCl
г) с 15% -ным раствором HCl
С наименьшей скоростью при комнатной температуре протекает реакция между
а) Fe и H2SO4(раствор)
б) Cu и O2
в) AgNO3(раствор) и NACl(раствор)
г) C2H5OH и Na
9) при повышении давления равновесие смениться в сторону продуктов реакции в случае системы
а) H2 + Br 2HBr
б) C — CO2 2CO
в) PCI5 PCI3(г) +CI
г) CO + CI2 COCI2(г)
10) термохимическое уравнение реакции полного сгорания ацетилена
2C2H2 + 5O2 = 4CO2 + 2H2O+ 2610 кДж
При использовании 112 л ацетилена выделиться теплоты
а) 1305 кДж
б) 261 кДж
в) 130,5 кДж
г) 65,25 кДж
Контрольные срезы, тесты, переводные экзамены по химии
тест по химии (8 класс) по теме
Переводной экзамен в 8 кл по химии
Скачать:
| Вложение | Размер |
|---|---|
| контрольная работа на тему «Химические реакции» в 11 кл | 38 КБ |
| test_spirty_fen.docx | 19.24 КБ |
| testy_10_kl_ald_i_ket.docx | 18.13 КБ |
| kontr_rab_elektrolit_diss.docx | 38.98 КБ |
| kontr_rab_himich_reaktsii_11_kl_neprof.docx | 20.02 КБ |
| kr_uglevodorody_10_kl.doc | 75 КБ |
Предварительный просмотр:
Контрольная работа по теме «Химические реакции»
1. Неверным является утверждение, что при протекании химической реакции:
А . Сохраняется суммарная масса веществ;
Б. Сохраняются молекулы веществ;
В. Сохраняются атомы веществ;
Г. Сохраняется суммарная энергия.
2. Реакция, уравнение которой 2KOH + H 2 SO 4 = K 2 SO 4 + 2H 2 O , является
А . Эндотермической, обмена; В. Обмена, экзотермической;
Б. Обмена, каталитической; Г. Гетерогенной, обмена.
3. К окислительно-восстановительным относится реакция, уравнение которой:
А. C 2 H 4 + H 2 = C 2 H 6 ; В. CaO + H 2 O = Ca(OH) 2 ;
Б. NaCl + AgNO 3 = AgCl↓ + NaNO 3 ; Г. CH 3 OH + HCl = CH 3 Cl + H2O.
4. Сумма коэффициентов в сокращенном ионном уравнении между растворами хлорида бария и сульфата натрия равна:
А. 6; Б. 5; В. 4; Г. 3.
5. Сокращенное ионное уравнение реакции 2H + + SiO 3 2- = H 2 SiO 3 ↓ соответствует взаимодействию между:
А. SiO 2 и H 2 O; Б . Na 2 SiO 3 (р-р) и HCl; В . H 2 SO 4 и SiO 2 ; Г . CaSiO 3 и H 2 SO 4 .
6. Гидролизу подвергается:
А . Глюкоза; В. Поваренная соль;
Б. Мыло; Г. Серная кислота.
7. С наименьшей скоростью при комнатной температуре будет идти реакция цинка:
А. С 3%-ным раствором HCl; В. С 15%-ным раствором HCl;
Б. С 11%-ным раствором HCl; Г. С 20%-ным раствором HCl.
8. С наибольшей скоростью при комнатной температуре протекает реакция:
А . Zn и H 2 SO 4 ; Б. Na и C 6 H 5 OH; В. Fe и O 2 ; Г. CuSO 4 (р-р) и KOH(р-р).
9. Химическое равновесие в системе CH 4 + H 2 O (r) ↔ 3H 2 + CO – Q смещается в сторону продуктов реакции при:
А. Повышении давления; В. Повышении температуры;
Б. Понижении температуры; Г. Использовании катализатора.
10. Щелочную среду имеет водный раствор соли, формула которой:
А. AlCl 3 ; Б. KNO 3 ; В. K 2 CO 3 ; Г. FeCl 3 .
Ответ подтвердите уравнением реакции.
11. Составьте уравнение реакции взаимодействия магния с соляной кислотой. Дайте полную характеристику данной реакции по всем изученным признакам.
12. Для увеличения скорости химической реакции в 64 раза (температурный коэффициент γ=2) надо повысить температуру:
А. На 30 ºС; Б. На 40 ºС; В. На 50 ºС; Г. На 60 ºС.
13. Формулы группы ионов, которые не могут одновременно существовать в растворе:
А. Al 3+ , Cl — , NO 3 — , Na + . Б. Na + , NO 3 — , K + , SO 4 2- .
В. Na + , S 2- , Fe 2+ , NO 3 — . Г. Ba 2+ , Cl — , H + , OH — .
Контрольная работа по теме «Химические реакции»
1. К химическим процессам не относится :
А. Крекинг углеводородов; В. Ржавление железа;
Б. Плавление льда; Г. Образование накипи.
2. Реакция, уравнение которой CH 4 + Cl 2 → CH 3 Cl + HCl , является:
А. Замещения, гомогенной; В. Замещения, гетерогенной;
Б. Замещения, экзотермической; Г. обмена, каталитической.
3. К окислительно-восстановительным реакциям не относится :
А. CH 4 + 2O 2 → CO 2 + 2H 2 O; В. K 2 O + H 2 O = 2KOH;
Б. C 2 H 2 + 2Br 2 → C 2 H 2 Br 2 ; Г. 2KMnO 4 = K 2 MnO 4 + MnO 2 + O 2 .
4. Сумма коэффициентов в сокращенном ионном уравнении между хлоридом железа (III) и гидроксидом калия равна:
А. 6; Б. 5; В. 4; Г. 3.
5. Сокращенное ионное уравнение реакции NH 4 + + OH — = NH 3 ↑ + H 2 O соответствует взаимодействию веществ, формулы которых:
А. NH 4 Cl и H 2 O; В. NH 3 и H 2 O;
Б. NH 4 Cl(р-р) и KOH(р-р); Г. NH 4 NO 3 и Mg(OH) 2 .
6. Гидролизу не подвергается :
А. Ацетет натрия; В. Этанол;
Б. Хлорид цинка; Г. Жир.
7. С наибольшей скоростью при комнатной температуре будет идти реакция магния:
А. С 1%-ным раствором HCl; В. С 5%-ным раствором HCl;
Б. С 10%-ным раствором HCl; Г. С 15%-ным раствором HCl.
8. С наименьшей скоростью при комнатной температуре протекает реакция между:
А. Fe и H 2 SO 4 (р-р); В. AgNO 3 (р-р) и NaCl(р-р);
Б. Cu и O 2 ; Г. C 2 H 5 OH и Na.
9. При повышении давления равновесие сместится в сторону продуктов реакции в случае системы:
А. H 2 + Br 2 ↔ 2HBr; В. PCl 5(г) ↔ PCl 3(г) + Cl 2 ;
Б. C + CO 2 ↔ 2CO; Г. CO + Cl 2 ↔ COCl 2(г) .
10. Кислотную среду имеет раствор соли, формула которой:
А. KCl; Б. ZnSO 4 ; В. Na 2 CO 3 ; Г. NaNO 3 .
Ответ подтвердите уравнением реакции.
11. При повышении температуры на 30ºС (температурный коэффициент γ=2) скорость реакции увеличивается:
А. В 2 раза; Б. В 4 раза; В. В 6 раз; Г. В 8 раз.
12. Составьте уравнение реакции взаимодействия растворов сульфата магния и хлорида бария. Дайте полную характеристику данной химической реакции по всем изученным классификационным признакам.
13. Формулы группы ионов, которые могут одновременно существовать в растворе:
А . SO 3 2- , K + , SO 4 2- , H + ; В. K + , Fe 2+ , OH — , SO 4 2- ;
Б. Al 3+ , Na + , OH — , Cl — ; Г. K +, Ba 2+ , OH — , NO 3 — .
Предварительный просмотр:
Контрольная работа по теме «Фенолы. Спирты»
1. Пропанол можно получить из пропена в результате реакции
1) гидратации 2) гидрирования
3) галогенирования 4) гидрогалогенирования
2. Этанол проявляет двойственные свойства, реагируя с
1) кислородом и фтором 3) бромоводородом и фтороводородом
2) калием и бромоводородом 4) натрием и литием
3. Фенол проявляет более сильные кислотные свойства по сравнению с
1) уксусной кислотой 2) угольной кислотой 3) метанолом 4) тринитрофенолом
4. Между собой могут взаимодействовать
1) этанол и хлороводород 2) глицерин и сульфат меди (II)
3) фенол и гидроксид меди (II) 4) метанол и углекислый газ
5. При нитровании фенола образуется
1) гексановая кислота 3) пропионовая кислота
2) пикриновая кислота 4) олеиновая кислота
6. Каждый из атомов кислорода в молекуле этиленгликоля образует
1) одну σ-связь 2) одну p-связь 3) две σ-связи 4) одну σ-связь и одну p-связь
7. Фенол образует белый осадок при взаимодействии с
1) бромной водой 2) азотной кислотой 3) гидроксидом калия 4) аммиаком
8. Для метанола возможна химическая реакция с
1) пропионовой кислотой 3) углекислым газом
3) пропаном 4) гидроксидом железа(Щ)
9.Гидроксильная группа имеется в молекулах
1) спиртов и карбоновых кислот 2) альдегидов и простых эфиров
3) аминокислот и сложных эфиров 4) жиров и спиртов
В1. Бутанол-1 реагирует с
1) кислородом 4) хлороводородом
2) хлором 5) натрием
3) гидроксидом натрия 6) оксидом натрия
(Запишите цифры в порядке возрастания)
1)пропандиол-1,2 2)пропен-ол-1 3)этантриол-1,1,2 4)2-фенилбутанол-2
Тип спирта: а)одноатомный б)двухатомный в)трехатомный г)предельный д)непредельный е)ароматический
С1.Какой объем водорода выделится при взаимодействии 2,3 г натрия со 100 мл пропанола-1 (плотность 0,8 г/мл)?
Контрольная работа по теме «Фенолы. Спирты»
1. Как этанол, так и фенол взаимодействуют с
1) бромной водой 2) натрием 3) хлоридом железа(Щ) 4) соляной кислотой
2. В отличие от этанола, фенол реагирует с
1) азотной кислотой 2) калием 3) бромоводородом 4) водородом
3. Атом кислорода в молекуле фенола образует σ-связи в количестве
1) одной 2) двух 3) трех 4) четырех
4. Бутанол-2 и хлорид калия образуется при взаимодействии
1) 1-хлорбутана и водного раствора КОН
2) 2-хлорбутана и спиртового раствора КОН
3) 1-хлорбутана и спиртового раствора КОН
4) 2-хлорбутана и водного раствора КОН
4. Фенол проявляет более сильные кислотные свойства, чем
1) этандиол 2) этановая кислота 3) угольная кислота 4) серная кислота
5. Пропанол-1 взаимодействует с
1) этановой кислотой 3) углекислым газом
2) этаном 4) гидроксидом алюминия
6. Одноатомные предельные спирты проявляют двойственные свойства, реагируя
1) и с натрием, и с калием 3) и с бромоводородом, и с хлороводородом
2) и с натрием, и с бромоводородом 4) и с кислородом, и со фтором
7. При действии водного раствора щёлочи на монобромалканы преимущественно образуются
1) алканы 2) алкены 3) спирты 4) алдегиды
8. В схеме превращений
С 2 Н 2 —> А —> С 2 Н 5 ОН веществом «А» является
1) СН 3 СООН 2) С 2 Н 2 Сl 2 3) СН 3 СОН 4) С 2 Н 6
9. Фенол проявляет более слабые кислотные свойства по сравнению с
1) тринитрофенолом 2) водой 3) метанолом 4) этанолом
В1. Фенол реагирует с
1) кислородом 4) хлороводородом
2) бензолом 5) натрием
3) гидроксидом натрия 6) оксидом натрия
(Запишите цифры в порядке возрастания)
1)бутандиол-1,4 2)бутен-2-ол-1 3)пропантриол-1,2,3 4)2-фенилпропанол-1
Тип спирта: а)одноатомный б)двухатомный в)трехатомный г)предельный д)непредельный е)ароматический
С1.При взаимодействии 3,7 г предельного одноатомного спирта с избытком металлического натрия выделилось 560 мл водорода (н.у.). Какие спирты удовлетворяют условию этой задачи?
Предварительный просмотр:
Тесты по теме «Альдегиды. Кетоны» 10 кл (I вариант )
1. Группа – С=О носит название:
а) гидроксильной; б) карбоксильной; в) альдегидной; г) карбонильной.
2. Альдегид, не имеющий углеводородного радикала:
а) уксусный; б) масляный; в) валериановый; г) муравьиный.
3. Название «альдегид» означает:
а) гидратированный алкин; б) окисленный спирт;
в) дегидрированный спирт; г) гидратированный алкен.
4. Формула ацетона:
а) СН 3 -О-СН 3 ; б) СН 3 -О-С 2 Н 5 ; в) СН 3 – СО – СН 3 ; г) СН 3 – ОН.
5. Газообразным является альдегид:
а) муравьиный; б) уксусный; в) пропионовый; г) валериановый.
6. Составу С 4 Н 8 О соответствует изомерных альдегидов:
а) 1; б) 2; в) 3; г) 4.
7. Реакция присоединения водорода к альдегидам происходит за счет:
а) разрыва π – связи карбонильной группы;
б) разрыва ϭ – связи карбонильной группы;
в) разрыва ϭ — и π – связи карбонильной группы;
г) образования новой π – связи между атомами углерода и кислорода.
8. При длительном стоянии формальдегида образуется:
а) углекислый газ и вода; б) полиэтилен:
в) параформ; г) полиформальдегид.
9. Уксусный альдегид применяется для получения:
а) бездымного пороха; б) негорючей кинопленки;
в) лекарств; г) уксусной кислоты.
10. Альдегиды и кетоны в своем составе имеют:
а) гидроксогруппу; б) карбонильную группу;
в) карбоксильную группу; г) альдегидную группу.
11. При восстановлении альдегидов образуются:
а) фенолы; б) углеводороды; в) спирты; г) кислоты.
12. Реакция с аммиачным раствором оксида серебра (I) характерна для:
а) пропанола -1; б) прапаналя;
в) пропионовой кислоты; г) этандиола.
13. Вещество Д в цепочке превращений:
+Cl2 +HOH [O]; cat. + H2
СН4 → А → В → С → Д является:
а) муравьиная кислота; б) метан; в) метанол; г) этанол.
14. Для получения этаналя в промышленности используются:
а) этанол; б) этилен; в) уксусная кислота; г) ацетилен.
15. Для получения ацетальдегида массой 11 г по реакции Кучерова, необходим ацетилен массой … г, при выходе 90%:
а) 21 г; б) 8 г; в) 14 г; г) 7,22 г.
Тесты по теме «Альдегиды. Кетоны 10 кл (II вариант )
1. Общая формула альдегидов:
а) R-O-R1; б) R-O-H; в) R-COH; г) R-COH;
2. Вещество, формула которого СН 3 СНО, называется:
а) этанол; б) этаналь; в) этановая кислота; г) ацетон.
3. Формула уксусного альдегида:
а) СН 3 СООН; б) СН 3 СНО; в) НСНО; г) С 2 Н 5 СНО;
4. Простейший представитель кетонов:
а) метилэтилкетон; б) диметилкетон; в) диэтилкетон; г) дифенилкектон.
5. Формалин – это …
а) 20 %- ный спиртовой раствор уксусного альдегида;
б) 4 % — ный спиртовой раствор ацетона;
в) 2 % -ный водный раствор валерианового альдегида;
г) 40 % — ный водный раствор муравьиного альдегида.
6. Составу С 5 Н 10 О соответствует изомерных альдегидов:
а) 2; б) 3; в) 4; г) 5.
7. Альдегиды легко окисляются по месту связи:
а) С – Н альдегидной группы; б) С – С углеводородного радикала;
в) С – Н углеводородного радикала; г) С = О альдегидной группы.
8. При нагревании раствора формальдегида с избытком аммиачного раствора оксида серебра получается:
а) муравьиная кислота; б) углекислый газ и вода;
в) уксусная кислота; г) этиловый спирт.
9. Альдегиды и кетоны можно получить путем:
а) гидратации алкенов; б) дегидратации спиртов;
в) окисления спиртов; г) гидрогалогенирования алкинов.
10. При окислении альдегидов образуются:
а) фенолы; б) углеводороды; в) спирты; г) кислоты.
11. Реактивом для определения альдегидов является:
а) водород; б) раствор KMnO4; в) бром; г) аммиачный раствор оксида серебра.
12. При взаимодействии альдегидов с водородом в присутствии катализатора при нагревании образуются:
а) углеводороды; б) спирты; в) карбоновые кислоты; г) арены.
13. Вещество Д в цепочке превращений:
+Br2 +HOH [O] + Ag2O; NH3
С2Н6 → А → В → С → Д
является:
а) ацетальдегид; б) ацетон; в) этанол; г) уксусная кислота.
14. Для получения метаналя в промышленности используется:
а) метан; б) этилен; в) этан; г) ацетилен.
15. Из формальдегида массой 45 г образуется метанол массой … г , при выходе 95 %.
а) 40 г; б) 45 г; в) 120 г; г) 80г.
Предварительный просмотр:
Контрольная работа на тему «Электролитическая диссоциация» (11 кл)
1 . Не является сильным электролитом
а)серная кислота б)азотная кислота в)сернистая кислота г)хлороводородная кислота
2 . Электролитом является каждое из двух веществ:
а) глюкоза и этиловый спирт б) уксусная кислота и бензол в) сахароза и хлорид натрия
г) ацетат натрия и гидроксид натрия
3 . Степень диссоциации не зависит от
а) объема раствора б) природы растворителя в)природы электролита г)концентрации
4. Уксусная кислота диссоциирует в растворе в соответствии с уравнением
а)C 2 H 5 COOH C 2 H 5 COO — +H + б) C 2 H 5 OH C 2 H 5 O — + H +
CH 3 COOH CH 3 — +COOH + г) CH 3 COOH СH 3 COO — + H +
5. В качестве катионов только ионы H + образуются при диссоциации
а) KOH б) Na 2 HPO 4 в) H 2 SO 4 г) NaHSO 4
6 .Ионы Br — образуются при диссоциации:
а) KBrO 3 б) KBr в) CH 3 CH 2 Br г) NaBrO 4
7. Какие из утверждений о диссоциации кислот в водных растворах верны?
А. Катионы водорода H + образуются только при диссоциации кислот.
Б. среди анионов, образующихся при диссоциации кислот, могут присутствовать разнообразные кислотные остатки.
а) верно только А б)верно только Б в)верны оба утверждения г)оба утверждения неверны
8. При сливании растворов карбоната калия и кислоты в химической реакции участвуют ионы:
а) CO 3 2- и Cl — б) CO 3 2- и K + в) K + и H + г) H + и CO 3 2-
9. Сумма коэффициентов в кратком ионном уравнении реакции взаимодействия растворов сульфида натрия и хлорида алюминия равна:
а) 11 б)13 в)15 г)16
10. Какие вещества, формулы которых приведены ниже, подвергаются гидролизу:
а) CaSO 4 , б) AgNO 3 , в) K 2 CO 3 ? Напишите реакцию гидролиза одной соли.
Укажите характер среды раствора выбранной соли.
11 . По сокращенному ионному уравнению запишите полное ионное и молекулярное:
Ва 2+ + S0 4 2- = BaS0 4 ↓
12 . Задача: Какова масса соли, образующейся при взаимодействии 200г 2%-го раствора гидроксида натрия с 200 г 10%-го раствора соляной кислоты?
К химическим процессам не относится реакция уравнение
Тесты по химии 11 класс. Тема: «Химические реакции»
Правильный вариант ответа отмечен знаком +
Вариант 1
1. К химическим реакциям по изменению степени окисления не относятся химические реакции:
2. К реакциям разложения относятся:
— взаимодействие лития с кислородом
+ распад оксида ртути на ртуть и кислород
— взаимодействие цинка с соляной кислотой
3. К реакциям соединения относятся:
+ взаимодействие алюминия с серой
— взаимодействие уксусной кислоты с магнием
— взаимодействие магния с водородом
4. К реакциям замещения относятся:
+ взаимодействие цинка с соляной кислотой
— взаимодействие углерода с водородом
— взаимодействие лития с кислородом
5. Процессы, в результате которых происходит изменение степеней окисления, называются:
+ окислительно – восстановительными реакциями
6. Какой метод используется при расстановке коэффициентов в уравнении?
7. По числу и составу исходных и образующихся веществ не относится реакция:
+ по радикальному механизму
8. К реакциям разложения относится:
+ 2 KClO3= 2 KCl + 3O2 (газ)
— 2 Fe + 3 Cl2 = 2 FeCl3
— HCOOH + NaOH — ≥ HCOONa + H2O
9. К реакциям соединения относится:
+ 2 Fe + 3 Cl2 = 2 FeCl3
— CH4 + Cl2 — ≥(свет) CH3Cl + HCl
— 2 СH4 =(t) C2H2 (газ) + 3H2 (газ)
тест 10. К реакциям характерным для органических веществ относится:
+ идущие по ионному механизму
11. По тепловому эффекту реакции подразделяются на:
+ экзотермические и эндотермические
— обратимые и необратимые
— идущие по радикальному механизму и ионному механизму
12. Экзотермическими называют реакции, которые:
+ идут с выделением теплоты
— идут с поглощением теплоты
— идут до полного израсходования одного из реагирующих веществ
13. Эндотермическими называют реакции, которые:
— идут с выделением тепла
+ идут с поглощением тепла
— идущие при данных условиях во взаимно противоположных направлениях
14. Примером эндотермической реакции является:
— H2(г) + Сl2 (г) = 2 HCl ( г) + 184.6 кДж
+ ½ N2(г) + 1/2O2 (г) = NO( г) – 90.4 кДж
— H2(г) + 1/2O2 (г) = H2O( жидк.) + 285.8 кДж
15. Теплотой образования называют:
+ уровень теплоты, который выходит или используется при выделении одного моля соединения из простых веществ
— уровень теплоты, который выходит при сгорании одного моля вещества
— уровень теплоты, выходящий или используемый при реакции
16. Теплотой сгорания называют:
— уровень теплоты, выходящий или используемый при выделении одного моля соединения из простых веществ
+ уровень теплоты, выходящий при сгорании одного моля вещества
— уровень теплоты, выходящий или используемый при реакции
17. Термохимическими называют реакции, в которых указано:
— уровень теплоты, выходящий или используемый при образовании одного моля соединения из простых веществ
— уровень теплоты, выходящий при сгорании одного моля вещества
+ уровень теплоты, выходящий или поглощаемый при реакции
18. По признаку обратимости реакции подразделяются на:
+ обратимые и необратимые
— экзотермические и эндотермические
— замещения, обмена, разложения, соединения
19. Необратимой называется реакция:
+ идущая до конца, то есть до полного израсходования одного из реагирующих веществ
— которая идет во взаимно противоположных плоскостях
— идущая с выделением теплоты
тест-20. Обратимой называется реакция:
— идущая до конца, то есть до полного израсходования одного из реагирующих веществ
+ которая идет во взаимно противоположных плоскостях
— идущая с выделением теплоты
Вариант 2
1. Чему равен коэффициент окислителя в реакции, протекающей согласно схеме Al + H2SO4 = Al2(SO4)3 + H2?
— единице
2. Выберите вещества, после вступления в реакцию которых образуется химический процесс, который можно описать сокращенным ионным уравнением 2H + + CO3 2- = H2O + CO2:
3. К соединительным реакциям относится:
+ взаимодействие Al с S
— взаимодействие CH3COOH с Mg
— взаимодействие Mg с H2
— все ответы верные
4. Какая реакция не является окислительно-восстановительной?
5. Из представленных ниже вариантов выберите необратимую реакцию:
6. Как называется раствор, вещество в котором при определённой температуре не подлежит растворению?
7. К обратимой относятся реакции, которые:
— протекают до конца
+ идут во взаимно противоположных плоскостях
— заканчиваются выделением тепла
— происходят лишь с применением катализатора
8. Повысить скорость химического взаимодействия, описываемого уравнением 4FeS2 + 11O2 = 2Fe2O3 + 8SO2 + Q, возможно, если:
+ мелко подробить железный колчедан
— применять воздух, насыщенный азотом
— абсорбировать SO2 водой
9. Как называется метод, предназначенный для уравнения химических реакций?
тест 10. Гидролизу не подвергается соль:
11. Окислительно-восстановительная реакция — это:
— нейтрализация CH₃COOH гидроксидом кальция
12. Газ, выделяющийся вследствие реакции между СaC2 и Н2О:
13. Что подразумевается под «теплотой сгорания»?
— степень тепла, вышедшая либо израсходованная в процессе выделения 1 моль вещества из простого соединения
— изменение энтальпии химической системы за счёт протекания взаимодействующей реакции
+ количество тепла, получаемое при сгорании 1 моль вещества
— нет правильного ответа
14. Щелочной показатель рН характерен для раствора:
15. Какой тип химических реакций не классифицируется по количеству и составу исходных и конечных веществ?
+ по радикальному механизму
16. Кислотный рН характерен для водного раствора:
17. Реакцией разложения является:
— взаимодействие Li с O2
+ распад HgO на Hg и O2
— взаимодействие Fe с CuSO4
— взаимодействие Zn с HCl
18. В результате какой реакции состав вещества остаётся прежним?
19. На смещение равновесия системы N2(г) + О2(г) = 2NO(г) – Q не влияет:
— повышение концентрации NO
— уменьшение концентрации N2
тест-20. Скорость прямого взаимодействия в системе N2 + 3H2 = 2NH3 + Q возрастает при:
+ увеличении концентрации азота
— уменьшении концентрации аммиака
— уменьшении концентрации азота
— увеличении концентрации аммиака
21. По характеру обратимости реакции классифицируются на:
— идущие с изменением и без изменения степени окисления атомов
— соединения, разложения, обмена, замещения
22. Взаимодействие NaOH с H₃PO₄ относится к реакциям:
23. Какая соль в водном растворе изменяет цвет фенолфталеин на малиновый?
24. К реакциям замещения относится:
+ взаимодействие Zn с HCl
— взаимодействие NaOH с HCl
— взаимодействие C с H2
— взаимодействие Li с O2
25. Кислый рН характерен для водного раствора:
26. Уравнение 2Na + 2H2O = 2NaOH + H2 + Q описывает реакцию:
27. Какое вещество образуется путём соединения водных растворов Na2CO3 и Al₂(SO₄)₃:
28. Эндотермические реакции – это те, которые:
+ идут с поглощением теплоты
— протекают в обычных условиях, но в противоположных направлениях
— невозможны без участия катализатора
— протекают с выделением теплоты
29. Укажите, чему равно значение коэффициентов химической реакции Mg + HNO3 = Mg(NO3)2 + N2 + H2O:
тест_30. К какому типу относится реакция, отображенная на рисунке ниже?
http://nsportal.ru/shkola/khimiya/library/2014/04/05/kontrolnye-srezy-testy-perevodnye-ekzameny-po-khimii
http://testua.ru/testy-po-khimii/179-testy-po-khimii-11-klass/1686-testy-khimicheskie-reaktsii-11-klass-s-otvetami.html