Расчет значений k0 и e в уравнении аррениуса с использованием метода наименьших квадратов и поиска решения excel. Расчет значений константы равновесия с использованием метода наименьших квадратов
Страницы работы
Содержание работы
2. расчетная часть
2.1. расчет значений k0 и e в уравнении аррениуса с использованием метода наименьших квадратов и поиска решения excel
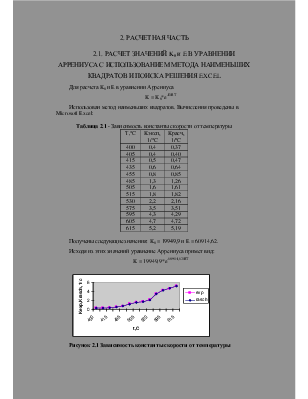
Для расчета K0 и E в уравнении Аррениуса
K = K0*e -E /RT
Использован метод наименьших квадратов. Вычисления проведены в Microsoft Excel:
Таблица 2.1 — Зависимость константы скорости от температуры
Получены следующие значения: K0 = 19949,9 и E = 60914,62.
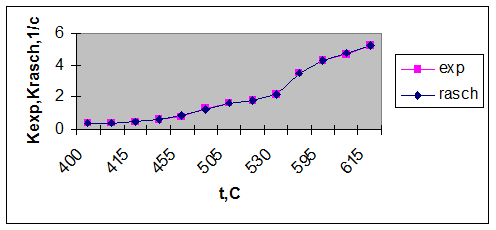 |
Исходя из этих значений уравнение Аррениуса примет вид:
K = 19949,9*e -60914,62/ RT
Рисунок 2.1 Зависимость константы скорости от температуры
2.2 расчет значений константы равновесия с использованием метода наименьших квадратов
Общий вид зависимости константы равновесия от температуры:
Kр = 10 ( A / T + B ) (2.1)
Нахождение коэффициентов А и В проведено в программе Turbo Basic с помощью метода наименьших квадратов (см. Приложение 5). Результаты вычислений в программе представлены в таблице 2.2
Таблица 2.2 – Зависимость константы равновесия от температуры
Подставив найденные значения коэффициентов А = 4794,21 и В = -4,5248
в уравнение (2.1), получим зависимость вида:
Kр = 10 (4794,21/ T –4,5248)
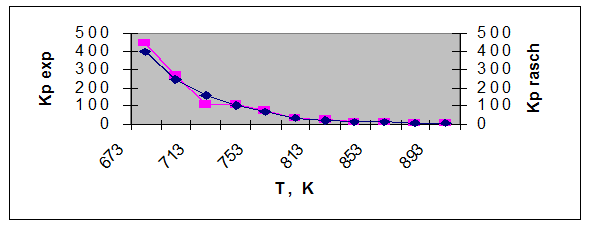 |
Эта зависимость представлена на рис. 2.2, также на нем представлены значения константы равновесия, полученные экспериментальным путем, в зависимости от температуры.
Рисунок 2.2 Зависимость экспериментальной и расчетной константы равновесия от температуры
2.3 Расчет статистической модели абсорбера методом брандона
Tвх — температура на входе в абсорбер, °C;
r — плотность орошения, м 3 /м 2 ;
Tвых — температура на выходе из абсорбера, °C;
y — степень абсорбции, %
Экспериментальные данные для построения статистической модели абсорбера приведены в Приложении 1.
Первым этапом решения данной задачи является ранжирование влияющих факторов. Все этапы построения модели абсорбера проведены для каждого выходного параметра в отдельности.
Ø Построение матрицы коэффициентов парной корреляции
Элементами матрицы являются коэффициенты парной корреляции. Полученная матрица коэффициентов парной корреляции приведена в таблице 2.3 и таблице 2.4.
Таблица 2.3 – Матрица парных коэффициентов корреляции для Tвых
Уравнение Аррениуса. Энергия активации химической реакции





Уравнение Аррениуса. Энергия активации химической реакции
- Уравнение Аррениуса. Энергия химической активации Вы. Формулы (V.19) и (V.20) являются только приблизительными Зависимости u = f (T) и k = f (T). Зависит от функции Константа скорости химической реакции k от температуры Обновлено шведским ученым С. Аррениусом (1889): * = (V. 2 1) Где А — предэкспоненциальный фактор. EA-acty energy.
- Реакция реакции; Т — абсолютная температура К. В химической кинетике часто используется уравнение Арре. Хорошая логарифмическая форма; в * = -E>, / RT + \ nA. (V.22) Из уравнения (V.22) зависимость постоянной равна Температура роста химической реакции встроена в кору Создайте чернила / T, линейные (рисунок V.3). Эта зависимость Энергию активации реакции Ea можно определить по тангенсу угла.
Наклон линии вдоль разреза и предэкспоненциальный множитель А Если ku, 1/7 = 0, обрезать вертикальную ось. Людмила Фирмаль
Исследование советских химиков (В. И. Гольданский и др.) Ультранизкая температура (ниже точки кипения азота -77 К) показала Закон Аррениуса для серии взаимодействий при очень низких температурах Остановите поведение, потому что 1 р / г зависит от 1 / т. Рис, v.u. Зависит от Химическая скорость Температура реакции Рига V.4. ^ Постоянная зависимость Скорость реакции от темпа Отклонение от Ирати: Аркениус (Рисунок V L) нелинейный.
Скорость таких реакций низкая Температура (Т ^ 10К) составляет Уравнение Аррениуса. Уравнение Аррениуса имеет две [величины; £ a и A Некоторые характеристики каждой реакции. Их фи Логический смысл получается по следующим причинам: Неплохо Предпосылки для инициирования химических взаимодействий между Две молекулы должны столкнуться.
Но не все Молекулярные столкновения заканчиваются действием химических взаимодействий Действия, то есть не все коллизии действительны. Также процент Как правило, общее количество эффективных столкновений Незначительный, большинство столкновений между молекулами Не вызывает реакции. Это можно легко проверить, рассчитав Возможное число на основе газовой кинетики.
Молекулярные столкновения и соответствующие скорости Сравните реакцию, затем ожидание (с расчетом 100% Эффективность) фактическая скорость; первое во мне Последние несколько раз. Аррениус предположил, что химический Действия выполняются только между этими конфликтами Молекулы, которые достигли определенной энергии.
Характерный уровень этой реакции, ее энергия Барьеры. Если такая молекула считается активной, эффект Столкновения происходят только между активами Pattern. Все молекулы в системе с низким накоплением энергии Энергетический барьер реакции находится в особом состоянии, Обычно это называется переходным состоянием или активным состоянием.
Комплекс, можно предположить, что система настроена Институт Активации комплекса характеризуется тем, что он в нем Уже нет исходного материала, но нет продукта реакции [1; Исходный материал передается продукту реакции. Принципиальная схема Переход лыж от исходных материалов A и B к продукту реакции C А через активированный комплекс А …
В состояние Иллюстрация льна. D.5 *. R. При взятии среднего уровня энергии исходной молекулы Вещество в системе равно £ |, а средняя энергия перехода Разность состояний E’-E \ представляет энергию Активация этой реакции, системная энергия (рисунок U.5) Переходное состояние максимально. Это значит Купальные сооружения очень нестабильны.
В процессе реакции он Расширяется до произведения взаимодействий C и O. На рассмотрении В этом примере средний уровень энергии молекул продукта реакции Е 2 ниже среднего уровня энергии исходной молекулы Вещество E . Это означает, что процесс будет продолжен с назначением Энергия (экзотермическая реакция). Средняя энергия молекул продукта реакции £ 2.
Может быть выше, чем средний энергетический уровень молекулы источника Детали E 1 (рисунок U.b). Процесс переходит к поглощению энергии. Гии (эндотермическая реакция) из окружающей среды. разница £ 2-¿ 1 равно тепловому эффекту процесса АЭ. Энергия активации является одним из основных параметров. ry характеризует скорость химического взаимодействия. стабилитрон Активация Процесс активации зависит от характера реакции Висячие.
- Чем выше энергия активации, тем меньше Равное условие) скорость реакции. Энергия активации Необходим в основном для ослабления химических связей Преодоление отталкивания с исходным материалом Электроны, генерируемые, когда молекулы и атомы объединяются Предотвращает взаимодействие веществ и их столкновения. Реакция между веществами, которые обычно имеют сильные ковалентные связи Облигации £ Медленно.
Это относится ко многим взаимодействиям Взаимодействие с органическим веществом Н2 + У2 0 2 = П20 и л и Н 2 + ЗЫ2 = 2НХ², скорость равна Стандартное условие практически нулевое. небольшой „„ И очень высокая скорость характеризуется ионами Взаимодействие в электролите (например: + 5 0 4 ’= $ 04 или Ag при * * + SG ‘= AgCl).
Это В связи с тем, что противоположно заряженные ионы притягиваются друг к другу. Людмила Фирмаль
Будьте друзьями и не нужно тратить энергию на преодоление силы Отталкивание взаимодействующих частиц. Простой расчет энергии активации химической реакции Согласно уравнению Аррениуса (U.22) значение известно Константы скорости k / -и k-1 при разных температурах: кг: I—, / I 1 (D.23) • nramot () и [) обрабатывают координаты реакции. Ход реакции. Axhibiro Bunny. С комплексом … LN 0 Координаты реакции Рис, д.5.
Диаметр энергии Граммы лихорадки Акии Координаты реакции Рисунок D.6. Диаметр энергии Грамм для эндотермы реакция Дает энергию активации нескольких химических реакций После: N20, -2N02, Hg + 12 ^ 2H1 C2H4 + I2 — CrNb, 2H1-Hg + b. C2H5Br ^ C2H4 + HBr. C H 4 C + 2H, Е д = 54,4 кДж / моль, £ = 165,5 кДж / моль, EV = 180,5 кДж / моль L ‘= 186,4 кДж / моль, £ = 218,0 кДж / мл £ = 334,7 кДж / моль, Обычно реакция ->! При 50 кДж / моль, Не протекать при комнатной температуре.
Замечательная энергия активации Это расстройство движения, Многие химические взаимодействия не остывают Рассмотрено с точки зрения химической термодинамики (DO •




















































Образовательный сайт для студентов и школьников
Копирование материалов сайта возможно только с указанием активной ссылки «www.lfirmal.com» в качестве источника.
© Фирмаль Людмила Анатольевна — официальный сайт преподавателя математического факультета Дальневосточного государственного физико-технического института
Общая химия. Учебное пособие (стр. 7 )
 | Из за большого объема этот материал размещен на нескольких страницах: 1 2 3 4 5 6 7 8 9 10 11 12 13 |
Основные понятия термодинамики
Термодинамика – это наука, изучающая законы обмена энергией между системой и окружающей средой.
Термодинамическая система – тело или группа тел, находящихся во взаимодействии, мысленно или реально обособленные от окружающей среды (под взаимодействием подразумевается обмен энергией и веществом).
Различают три типа термодинамических систем в зависимости от их возможности обмениваться с окружающей средой веществом и энергией. Система, которая не обменивается с окружающей средой ни веществом, ни энергией – изолированная система. Закрытая система – система, которая обменивается с окружающей средой энергией, но не обменивается веществом. Открытая система – система, которая обменивается с окружающей средой и веществом, и энергией.
Гомогенная система – система, внутри которой нет поверхностей, разделяющих отличающиеся по свойствам части системы (фазы). Гетерогенная система – система, внутри которой присутствуют поверхности, разделяющие отличающиеся по свойствам части системы. Фаза – совокупность гомогенных частей гетерогенной системы, одинаковых по физическим и химическим свойствам, отделенная от других частей системы видимыми поверхностями раздела.
Параметры состояния – величины, характеризующие какое-либо макроскопическое свойство рассматриваемой системы, позволяющие определить состояние системы непосредственным измерением этих величин. Различают экстенсивные параметры состояния, пропорциональные количеству вещества системы (масса, объем, внутренняя энергия), и интенсивные параметры состояния, не зависящие от количества вещества системы (давление, температура, вязкость).
Состояние системы определяется различными функциями, называемыми функциями состояния. Функция состояния – функция независимых параметров системы, изменение которой не зависит от пути перехода системы из начального состояния в конечное, а зависит только от состояния системы в этих точках. Для функции состояния можно измерить или рассчитать лишь ее изменение (∆). Изменение функции состояния рассматривается как разность ее значений в конечном и исходном состояниях системы, изменения функций состояния могут принимать как положительные, так и отрицательные значения.
Термодинамический процесс – всякое изменение (хотя бы одного параметра) термодинамического состояния системы.
Обратимый процесс – процесс, допускающий возможность возвращения системы в исходное состояние без того, чтобы в окружающей среде остались какие-либо изменения.
Равновесный процесс – процесс, при котором система проходит через непрерывный ряд состояний, бесконечно близких к состоянию равновесия. Характерные особенности равновесного процесса:
1) бесконечно малая разность действующих и противодействующих сил;
2) совершение системой в прямом процессе максимальной работы;
3) бесконечно медленное течение процесса, связанное с бесконечно малой разностью действующих сил и бесконечно большим числом промежуточных состояний.
Самопроизвольный процесс – процесс, который может протекать без затраты работы извне, причем в результате может быть получена работа в количестве, пропорциональном произошедшему изменению состояния системы. Самопроизвольный процесс может протекать обратимо или необратимо.
Несамопроизвольный процесс – процесс, для протекания которого требуется затрата работы извне в количестве, пропорциональном производимому изменению состояния системы.
Энергия – мера способности системы совершать работу, общая качественная мера движения и взаимодействия материи. Энергия является неотъемлемым свойством материи. Различают потенциальную энергию, обусловленную положением тела в поле некоторых сил, и кинетическую энергию, обусловленную изменением положения тела в пространстве.
Внутренняя энергия (U) – сумма энергии хаотического (теплового) движения всех микрочастиц системы (молекул, атомов, ионов и т. д.), энергии колебательных и вращательных движений атомов в молекулах и энергии взаимодействия этих частиц, т. е. полный запас энергии в веществе – кинетической и потенциальной. Измерить и рассчитать абсолютное значение внутренней энергии невозможно, можно лишь с достаточной точностью измерить ее изменение (∆U). Это характерно для всех функций состояния системы. Поскольку для нахождения изменения функций состояния и сравнения их между собой необходим единый уровень отсчета, то ввели понятие стандартного состояния вещества.
Стандартные величины – величины, определенные для веществ, находящихся в стандартном состоянии (обозначаются надстрочным индексом 0). Одно из возможных стандартных состояний характеризуется стандартными условиями: давлением (p0), составом (молярная концентрация С0), температурой (t0 или Т0):
p0= 101325 Па = 1 атм; С0= 1 моль/л; t0=250C (298,15 К)
Стандартные величины для веществ приводятся в справочниках.
Теплота (Q) – форма передачи энергии путем неупорядоченного движения образующих тело частиц (молекул, атомов и т. д.). Количественной мерой теплоты служит количество теплоты, т. е. количество энергии, получаемой (+ Q) или отдаваемой системой (– Q) при теплообмене. Теплота измеряется в единицах энергии: Дж, кал (1 кал = 4,184 Дж).
Работа (A) – форма передачи энергии путем упорядоченного движения частиц (макроскопических масс) под действием каких-либо сил. – A работа, совершенная системой против внешних сил; + A работа, совершенная внешними силами над системой (Дж). Вся работа делится на механическую работу расширения (или сжатия) и прочие виды работы (полезная работа). Механическая работа представляется произведением силы на перемещение. Электрическая работа рассматривается как произведение заряда на разность потенциалов. Работа расширения идеального газа равна произведению давления на изменение объема. Теплота и работа являются эквивалентными формами передачи энергии.
Первый закон термодинамики
Первое начало (закон) термодинамики устанавливает соотношение между теплотой Q, работой A и изменением внутренней энергии системы ∆U: если веществу или совокупности веществ (системе) сообщить извне энергию Q, то эта энергия будет расходоваться на изменение внутренней энергии системы ∆U и на совершение работы системой против внешних сил: Q = ∆U + A.
Этот закон представляет собой одну из форм закона сохранения энергии. Если в результате химической реакции система поглотила количество теплоты Q и совершила работу А, то изменение внутренней энергии определяется уравнением: ∆U = Q – A.
Если в ходе реакции при постоянном давлении (p=const, изобарный процесс) совершается только работа расширения, то А = p∆V (∆V=V2-V1). Тогда ∆U = Qp — p∆V или Qp = ∆U +p∆V = (U2 – U1) + p(V2 – V1). Группируя члены правой части равенства, получаем: Qp = (U2 + pV2) – (U1 +pV1).
Величину U + pV называют энтальпией (теплосодержанием) и обозначают символом Н:
Тепловой эффект изобарного процесса (реакции, протекающей при постоянном давлении) равен изменению энтальпии системы:
Если реакция протекает при постоянном объеме (∆V=0, изохорный процесс), то работа расширения A=p∆V=0, тогда
т. е. тепловой эффект реакции, протекающей при постоянном объеме, равен изменению внутренней энергии.
Теплоемкость – количество теплоты, поглощаемое телом при нагревании на 10С или 1 К. Теплоемкость единицы массы вещества называют удельной теплоемкостью [Дж/кг·К]. Теплоемкость 1 моля вещества – молярная (мольная) теплоемкость [Дж/моль· К].
Экзотермические – реакции, протекающие с выделением тепла (+Q), для них ∆Н 0.
Уравнения реакций, в которых указывается значение теплового эффекта, называются термохимическими. В таких уравнениях обязательно указываются агрегатные состояния веществ. Например, реакция горения этана выражается термохимическим уравнением:
С2Н 6(г) + 3,5O2 = 2СО2(г) + 3Н2О(ж), ∆Н = –1559,84 кДж.
Стандартная энтальпия образования химического соединения (∆Н0обр или ∆Н0298) – стандартное изменение энтальпии в результате реакции образования 1 моля этого вещества из простых веществ, взятых в том агрегатном состоянии, в котором они находятся при стандартных условиях и данной температуре [кДж/моль].
Стандартные энтальпии образования простых веществ принимаются равными нулю (рассматриваются аллотропные формы, устойчивые при стандартных условиях и T=0 K).
Стандартная энтальпия химической связи – это изменение энтальпии в реакции образования одного моля двухатомных молекул (или других двухатомных частиц) из атомов веществ, находящихся в газообразном состоянии:
Образование химической связи – процесс экзотермический, и поэтому энтальпия его всегда имеет отрицательное значение. Обратная реакция – диссоциации двухатомной молекулы (частицы) – процесс эндотермический. Энтальпия этого процесса называется энтальпией разрыва связи, она имеет положительное значение. Для многоатомных молекул эта величина является условной и отвечает энтальпии такого процесса, при котором данная химическая связь разрывается, а все остальные связи остаются без изменения. Реально для многоатомных молекул можно определить лишь среднее значение энтальпии разрыва химической связи, потому что энтальпии последовательных разрывов связей в них не равноценны.
Химические связи условно подразделяют на прочные или сильные –энергия разрыва связи > 500 кДж/моль; слабые от
15 кДж/моль. Межмолекулярные (ван-дер-ваальсовы) силы имеют энергию связи
5 кДж/моль и менее.
Закон Гесса: тепловой эффект химической реакции или физико-химического процесса не зависит от пути перехода системы из начального состояния в конечное, а определяется только природой и состоянием исходных и конечных веществ.
С + О2 = СО2, ∆Н= –393,5 кДж/моль;
С + ½ О2 = СО, ∆Н1= –110,5 кДж/моль;
СО + ½ О2 = СО2, ∆Н2= –283,0 кДж/моль;
∆Н = ∆Н1 + ∆Н2= –110,5+(–283,0) = –393,5 кДж/моль.
Следствия из закона Гесса:
1. Тепловой эффект реакции равен разности между суммой стандартных энтальпий образования продуктов реакции и суммой стандартных энтальпий образования исходных веществ с учетом коэффициентов реакции.
∆Н0р-ии= ∑ i ∆Н0298(конечн. прод.) – ∑ j∆Н 0298(исходн. в-в);
для реакции A + bB = cC + dD:
2. Тепловой эффект прямой реакции равен тепловому эффекту обратной реакции, взятому с обратным знаком.
3. Если в результате ряда последовательных реакций система переходит в состояние, полностью совпадающее с исходным, то сумма тепловых эффектов этого ряда реакций равна нулю.
А→В, ∆Н1; В→С, ∆Н2 ; С→А, ∆Н3;
Второй закон термодинамики
Ограниченность первого начала термодинамики заключается в том, что оно не определяет направления обмена тепловой энергией между телами. Первое начало не запрещает переход тепла от менее нагретого к более нагретому телу. Суть второго начала состоит в том, что оно определяет направление самопроизвольного протекания процессов, в том числе и химических реакций.
Самопроизвольным называется процесс, который протекает самостоятельно без воздействия внешних факторов. Для объяснения протекания таких процессов применяется еще одна функция состояния, которая с учетом первого начала термодинамики позволяет предсказать направление протекания процесса в изолированных системах. Такой функцией состояния является энтропия (S).
Интерпретировать энтропию можно как с точки зрения макроскопического состояния системы, так и с точки зрения микроскопического. Энтропию можно рассматривать как меру неупорядоченности частиц, составляющих систему. Размерность энтропии [S] = Дж/моль·К.
Второй закон (начало) термодинамики: в изолированной системе самопроизвольно протекают только те процессы, которые сопровождаются увеличением энтропии.
В самопроизвольном процессе ∆S>0; в равновесном процессе ∆S=0; в несамопроизвольном процессе ∆S 0).
Для оценки самопроизвольности процесса, протекающего при постоянной температуре и давлении, используют термодинамическую функцию, называемую изобарно-изотермическим потенциалом или энергией Гиббса (G):
Изменение энергии Гиббса учитывает как энтальпийный, так и энтропийный факторы реакции и, кроме того, влияние температуры. Использовать данную функцию можно как для изолированных, так и для закрытых систем, но если процесс протекает при постоянных температуре и давлении.
В закрытых системах при постоянных температуре и давлении самопризвольно могут протекать только те процессы, которые сопровождаются уменьшением энергии Гиббса системы (∆G 0, то изменение свободной энергии всегда отрицательно ∆G 0, а ∆S 0 и ∆S>0 направление реакции также зависит от температуры: при низкой температуре самопроизвольно будет протекать обратная реакция, а при высокой – прямая.
Это характерно для реакций диссоциации, например: N2O4=2NO2. Для данной реакции ∆H0298= 57,3 кДж; ∆S0298=176,6 Дж/К; ∆G0298=4,7 кДж. Температура, при которой устанавливается состояние равновесия 324,5 К, ниже этой температуры самопроизвольно протекает реакция димеризации, а выше – реакция диссоциации.
1. Глинка химия. – М.: Химия, 2006. – 720 с.
2. Глинка и упражнения по общей химии. – Л. Химия, 1985. – 264 с.
3. , Дракин и неорганическая химия. – М.: Химия, 1993. – 558 с.
4. Коровин химия. – М.: Высшая школа, 2000. – 557 с.
5. , и др. Курс общей химии. – М.: Высшая школа, 1990. – 445 с.
6. , Никольский химия. – СПб: Химиздат, 2001. – 512 с.
Примеры решения типовых задач
Задача 1. Вычислите теплоту сгорания этилового спирта С2Н5ОН.
Решение: уравнение реакции горения этилового спирта имеет вид:
С2Н5ОН(ж) + 3О2 = 2СО2 + 3Н2О(газ), ∆Н=?
∆Нр-ии = (2 ∆Н0298(СО2) + ∆Н0298(Н2О(газ))) – ∆Н0298(С2Н5ОН(ж));
∆Н р-ии = 2(–393,51) + 3(–241,84) – (–277,63) = –1234,91 кДж/моль.
Задача 2. Рассчитайте тепловой эффект реакции окисления кремния, протекающией по уравнению: Si(т)+2H2O(ж)=SiO2(k)+2H2(г), по стандартным теплотам образования веществ.
Решение: находим стандартные теплоты образования веществ (см. приложение):
∆Н0298(SiO2(k))= – 859,3 кДж/моль; ∆Н0298(H2O(ж))= – 285,8 кДж/моль.
Тепловой эффект реакции ∆Н0298 рассчитываем по уравнению первого следствия из закона Гесса:
∆Н0р-ии= ∑ i ∆Н0298(конечн. прод.) – ∑ j∆Н 0298(исходн. в-в).
Учитывая, что теплоты образования простых веществ равны нулю, находим тепловой эффект реакции:
∆Н0р-ии=∆Н0298(SiO2(k)) – 2∆Н0298(H2O(ж))= –859,3 –2(– 285,8)= –287,7 кДж.
Задача 3. Исходя из теплоты образования газообразного диоксида углерода ∆Н0298= –393,5 кДж/моль и термохимического уравнения:
С (графит) + 2N2O (г) = СО2 (г) + 2N2 (г) ; ∆Н = – 557,5 кДж, вычислите теплоту образования N2O (г).
Решение: тепловой эффект реакции ∆Н0298 реакции равен:
∆Н0р-ии= ∑ i ∆Н0298(конечн. прод.) – ∑ j∆Н 0298(исходн. в-в);
∆Н0р-ии=(∆Н0298(СО2 (г)) + 2∆Н0298(N2 (г)))– (∆Н0298 С (графит))+ 2∆Н0298N2O (г)), отсюда: ∆Н0р-ии=∆Н0298(СО2 (г)) – 2∆Н0298N2O (г), т. к. ∆Н0298 простых веществ равны нулю.
Вычисляем теплоту образования N2O (г):
∆Н0298N2O=(∆Н0298(СО2 (г)) – ∆Н0р-ии)/2=((– 393,5– (–557,5))/2=82 кДж/моль.
Задача 4. Вычислите ∆G0298 для реакции протекающей по уравнению: TiO2(k) + 2C(k) = Ti(k)+ 2CO(г), если известно, что ∆Н0298=718 кДж, ∆S=365 Дж/К. Возможно ли протекание данной реакции в стандартных условиях?
Решение: Изменение изобарно-изотермического потенциала определяется по уравнению: ΔG = ΔН – TΔS.
∆G0р-ии=718 – 298·365·10–3 = 609,2 кДж. Знак ∆G0 показывает направление самопроизвольного протекания реакции; ∆G0р-ии > 0, поэтому в стандартных условиях данная реакция самопроизвольно протекать не будет.
Задача 5. Определите температуру, при которой находится в равновесии система: NH3 (г) + HCl (г) ↔ NH4Cl (к) .
Решение: изменение изобарно-изотермического потенциала определяется по уравнению: ΔG = ΔН – TΔS, т. к. при равновесии изменение свободной энергии равно нулю (∆G = 0), то температура, при которой система находится в равновесии, равна T = ∆H/∆S.
Определяем тепловой эффект в реакции образования хлорида аммония из газообразных аммиака и хлористого водорода по уравнению первого следствия из закона Гесса:
∆Н0р-ии= ∆Н0298(NH4Cl(k)) – (∆Н0298(NH3(г)) +∆Н0298(HCl(г))) (стандартные теплоты образования веществ см. приложение);
∆Н0р-ии= –315,4–(–92,3) –(–46,2)= –176,9 кДж.
Определяем энтропию реакции:
∆S0р-ии= ∆S0298(NH4Cl (k)) – (∆S0298(NH3 (г)) + ∆S0298(HCl (г)));
∆S0р-ии= 94,6–192,5 –186,7= –284,6 Дж или –284,6·10-3 кДж.
Температура, при которой система находится в равновесии:
T = ∆H/∆S= – 176,9 /–284,6·10-3= 621,6 К.
Задача 6. Не производя вычислений, определить знак изменения энтропии в следующих реакциях:
http://lfirmal.com/uravnenie-arreniusa-energiya-aktivacii-himicheskoj-reakcii/
http://pandia.ru/text/78/149/95471-7.php