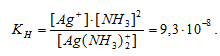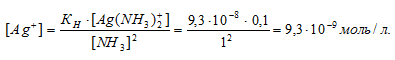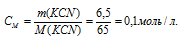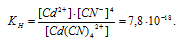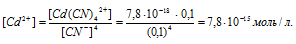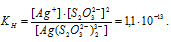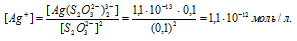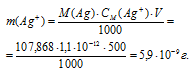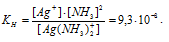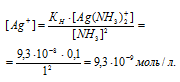Напишите уравнения реакций гидролиза солей: К2SO4, K2S, Cu(NO3)2.
Ваш ответ
решение вопроса
Похожие вопросы
- Все категории
- экономические 43,299
- гуманитарные 33,622
- юридические 17,900
- школьный раздел 607,247
- разное 16,834
Популярное на сайте:
Как быстро выучить стихотворение наизусть? Запоминание стихов является стандартным заданием во многих школах.
Как научится читать по диагонали? Скорость чтения зависит от скорости восприятия каждого отдельного слова в тексте.
Как быстро и эффективно исправить почерк? Люди часто предполагают, что каллиграфия и почерк являются синонимами, но это не так.
Как научится говорить грамотно и правильно? Общение на хорошем, уверенном и естественном русском языке является достижимой целью.
Напишите уравнения гидролиза последующих солей: Cu(NO3)2, FeSO4, ZnCI2, K2S, Na2SiO3, NH4NO3,
Напишите уравнения гидролиза последующих солей: Cu(NO3)2, FeSO4, ZnCI2, K2S, Na2SiO3, NH4NO3, Al(NO3)3. Укажите, какую реакцию имеют смеси этих солей
- Егор Сахаджи
- Химия 2019-07-25 10:39:18 29 1
1) Соль слабенького основания (Zn(OH)2) и сильной кислоты (H2SO4). Гидролиз по катиону. Среда кислая.
\2ZnSO4 + 2H2O = (ZnOH)2SO4 + H2SO4
Zn2+ + H2O = ZnOH+ + H+
(ZnOH)2SO4 + 2H2O = 2Zn(OH)2 + H2SO4
ZnOH+ + H2O = Zn(OH)2 + H+
2) Соль слабенького основания (Cu(OH)2) и сильной кислоты (HCl). Гидролиз по катиону. Среда кислая.
CuCl2 + H2O = Cu(OH)Cl + HCl
Cu2+ + H2O = CuOH+ + H+
Cu(OH)Cl + H2O = Cu(OH)2 + HCl
CuOH+ + H2O = Cu(OH)2 + H+
3) Соль сильного основания (NaOH) и слабенькой кислоты (H2SO3). Гидролиз по аниону. Среда щелочная.
Na2SO3 + H2O = NaHSO3 + NaOH
SO3 2- + H2O = HSO3 — +OH-
NaHSO3 + H2O = H2SO3 + NaOH
HSO3 — +H2O = H2SO3 + OH-
4) Соль сильного основания (КOH) и слабенькой кислоты (H3РO4). Гидролиз по аниону. Среда щелочная.
K3PO4 + H2O = K2HPO4 + KOH
PO4 3- + H2O = HPO4 2- + OH-
K2HPO4 + H2O = KH2PO4 + KOH
HPO4 2- + H2O = H2PO4 — +OH-
KH2PO4 + H2O = H3PO4 + KOH
H2PO4 — +H2O = H3PO4 + OH-
5) Соль слабого основания (Zn(OH)2) и сильной кислоты (HCl). Гидролиз по катиону. Среда кислая.
ZnCl2 + H2O = ZnOHCl + HCl
Zn2+ + H2O = ZnOH+ + H+
ZnOHCl + H2O = Zn(OH)2 + HCl
ZnOH+ + H2O = Zn(OH)2 + H+
6) Соль слабенького основания (Fe(OH)2) и сильной кислоты (H2SO4). Гидролиз по катиону. Среда кислая.
2FeSO4 + 2H2O = (FeOH)2SO4 + H2SO4
Fe2+ + H2O = FeOH+ + H+
(FeOH)2SO4 + 2H2O = 2Fe(OH)2 + H2SO4
FeOH+ + H2O = Fe(OH)2 + H+
7) Соль слабенького основания (Ni(OH)2) и сильной кислоты (HNO3). Гидролиз по катиону. Среда кислая.
Ni(NO3)2 + H2O = (NiOH)NO3 + HNO3
Ni2+ + H2O = NiOH+ + H+
(NiOH)NO3 + H2O = Ni(OH)2 + HNO3
NiOH+ + H2O = Ni(OH)2 + H+
Во всех случаях гидролиз ступенчатый, идет в 2 стадии, т. е. по 2 ступеням, кроме случая (4) — тут по 3 ступеням, т. к. фосфорная кислота — 3-основная.
Гидролиз по первой ступени идет веско сильнее, чем по 2-ой и, тем более, по третьей, поэтому нередко записывают гидролиз только по первой ступени.
Гидролиз — обратимый процесс, потому во всех уравнениях заместо знака равенства нужен символ обратимости
Уравнения химических реакций комплексных соединений в молекулярной и ионно-молекулярной форме
Задача 729.
Установить, в каких случаях произойдет взаимодействие между растворами указанных электролитов. Написать уравнения реакций в молекулярной и ионно-молекулярной форме:
а) К2[HgI4] + KBr;
б) К2[HgI4] + KCN;
в) [Ag(NH3)2]Cl + K2S2O3;
г) K[Ag(CN)2] + KBr;
д) K[Ag(CN)2] + NH3;
е) K[Ag(NO2)2] + NH3;
ж) [Ag(NH3)2]Cl + NiCl2;
з) K3[Cu(CN)4] + Hg(NO3)2.
Решение:
а) К2[HgI4] + KBr
Реакция не протекает так как Kн(K2[HgI4] 2- ) 2- ),
При диссоциации К2[HgI4] и KBr образуются ионы К +, Br — и [HgI4] 2- , который обладает большой устойчивостью:
2K + + [HgI4] 2- + K + + Br — = 3K + + [HgI4] 2- + Br — — реакция не протекает.
б) К2[HgI4] + KCN
Реакция протекает так как Kн(K2[HgI4]) > Kн(K2[Hg(CN)4], получим:
K2[HgI4] + 4KCN = K2[Hg(CN)4] + 4KI (молекулярная форма);
2K + + [HgI4] 2- + 4K + + 4CN — = 2K + + [Hg(CN)4] 2- + 4K + + 4I — (полная ионная форма);
[HgI4] 2- + 4CN — = [Hg(CN)4] 2- + 4I — (сокращенная ионная форма).
г) K[Ag(CN)2] + KBr;
Реакция не протекает так как при диссоциации K[Ag(CN)2] и KBr образуются ионы К+, Br- и [Ag(CN)2]-, который обладает большой устойчивостью.
д) K[Ag(CN)2] + NH3
Реакция не протекает так как Kн([Ag(CN)2] — ) + ). При диссоциации K[Ag(CN)2] образуются ионы К + и [Ag(CN)2] — , который ведет себя в обменных реакциях как неразрывное целое:
K[Ag(CN)2] + NH3 = K + + [Ag(CN)2] — + NH3.
е) K[Ag(NO2)2] + NH3
При диссоциации K[Ag(NO2)2] образуются ионы K + и [Ag(NO2)2] — , который обладает большой устойчивостью:
K[Ag(NO2)2] = K + и [Ag(NO2)2] — . Реакция не протекает, так как ион [Ag(NH3)2] + не образуется, потому что Kн([Ag(NO2)2] — ) + .
ж) [Ag(NH3)2]Cl + NiCl2
Как электролиты обе соли диссоциируют:
[Ag(NH3)2]Cl = [Ag(NH3)2] + + Сl — ;
NiCl2 = N1 2+ + 2Cl — .
Ионы Ag + и Cl — соединяясь друг с другом образуют нерастворимое соединение AgCl, а ион Ni 2+ с NH3 образует комплекс [Ni(NH3)6] 2+ , так как Kн (Ni(NH3)6] 2+ ) + ), получим:
3[Ag(NH3)2]Cl + NiCl2 = [Ni(NH3)6]Сl2 + 3AgCl↓ (молекулярная форма);
3[Ag(NH3)2] + + Cl — + Ni 2+ + 2Cl — = [Ni(NH3)6] 2+ + 2Сl — + 3AgCl↓ (полная ионная форма);
3[Ag(NH3)2] + + Ni 2+ + 3Cl — = [Ni(NH3)6] 2+ + 3AgCl↓ (сокращенная ионная форма).
Задача 730.
Вычислить концентрацию ионов Ag+ в 0,1 М растворе [Ag(NH3)2]NO3, содержащем в избытке 1 моль/л NH3.
Решение:
Константа нестойкости иона [Ag(NH3)2] + равна 9,3 . 10 -8 . Вторичная диссоциация комплексного иона протекает по схеме:
[Ag(NH3)2]+ = Ag + + 2NH3
В присутствии избытка NH3, создаваемого в результате прибавления раствора аммиака, это равновесие смещено влево настолько, что количество NH3, образующегося при вторичной диссоциации, можно пренебречь. Тогда [NH3] = С(NH3 ) = 1 моль/л. По той же причине равновесная концентрация ионов [Ag(NH3)2] + может быть приравнена общей концентрации комплексной соли (0,1 моль/л).
По условию задачи:
Отсюда выражаем концентрацию ионов Ag+:
Ответ: 9,3 . 10-8 моль/л.
Задача 731.
Вычислить концентрацию ионов кадмия в 0,1 М растворе K2[Cd(CN)4], содержащем, кроме того, 6,5 г/л КCN.
Решение:
M(KCN) = 65г/моль. Рассчитаем концентрацию цианида калия:
Константа нестойкости иона [Cd(CN)4] 2+ равна 7,8 . 10 -18 . Вторичная диссоциация комплексного иона протекает по схеме:
В присутствии избытка ионов CN — , создаваемого в результате диссоциации КCN (которую можно считать полной), это равновесие смещено влево настолько, что количество ионов CN — , образующихся при вторичной диссоциации, можно пренебречь. Тогда [Сd 2+ ] = С(соли) = 0,01 моль/л. По той же причине равновесная концентрация ионов [Cd(CN)4] 2- может быть приравнена к общей концентрации комплексной соли (0,1 моль/л).
По условию задачи:
Отсюда выражаем концентрацию ионов Сd 2+ :
Ответ: 7,8 . 10-15 моль/л.
Задача 732.
Найти массу серебра, находящегося в виде ионов в 0,5 л 0,1 М раствора дитиосульфатоаргентата натрия Na3[Ag(S2O3)2], содержащем, кроме того, 0,1 моль/л тиосульфата натрия.
Решение:
М(Ag) = 107,868г/моль. Константа нестойкости иона [Ag(S2O3)2] 3- равна 1,1 . 10 -13 . Вторичная диссоциация комплексного иона протекает по схеме:
В присутствии избытка ионов S 2 O 3 2- , создаваемого в результате диссоциации К2S2O3 (которую можно считать полной), это равновесие смещено влево настолько, что количество ионов S 2 O 3 2- , образующихся при вторичной диссоциации, можно пренебречь. Тогда [Ag + ] = С(К2S2O3) = 0,1 моль/л. По той же причине равновесная концентрация ионов [Ag(S2O3)2] 3- может быть приравнена к общей концентрации комплексной соли (0,1 моль/л).По условию задачи:
Отсюда выражаем концентрацию ионов Ag + :
Теперь рассчитаем массу серебра, находящуюся в виде ионов в количестве 1,1 . 10 -12 моль/л в растворе комплексной соли:
Ответ: 5,9 . 10 -9 г.
Задача 733.
Выпадет ли осадок галогенида серебра при прибавлении к 1 л 0,1 м раствора [Ag(NH3)2]NO3, содержащему 1 моль/л аммиака: а) 1 . 10 -5 моль КВг; б) 1 . 10 -5 моль КI? ПР(AgBr) = 6 . 10 -13 ; ПР(AgI) = 1,1 . 10 -16 .
Решение:
Константа нестойкости иона [Ag(NH3)2] + равна 9,3 . 10 -9 . Вторичная диссоциация комплексного иона протекает по схеме:
В присутствии избытка NH3, создаваемого в результате прибавления раствора аммиака, это равновесие смещено влево настолько, что количество NH3, образующегося при вторичной диссоциации, можно пренебречь. Тогда
По условию задачи:
Отсюда выражаем концентрацию ионов Ag+:
а) Уравнение реакции имеет вид:
Из уравнения реакции следует, что из 1 моль КBr и 1 моль [Ag(NH 3 ) 2 ]NO 3 образуется 1 моль AgBr. Так как [Ag + ] = 9,3 . 10 -9 моль/л; [Br — ] =1 . 10 -5 моль/л, то произведение концентраций ионов Ag + и Br — будет равна: (9,3 . 10 -9 ) . (1 . 10 -5 ) = 9,3 . 10 -14 . Так как 9,3 . 10 -14 > 1,1 . 10 -16 , то осадок бромида серебра не образуется.
http://obrazovalka.com/qa/ximiya/9652777-napishite-uravnenija-gidroliza-posledujushhih-solej-cuno32-feso4-znci2-k2s-na2sio3-nh4no3-.html
http://buzani.ru/zadachi/khimiya-glinka/1248-khimicheskie-reaktsii-kompleksnykh-soedinenij-za9-733