Йодоформная проба
Определить спирт в растворе можно с помощью йода и щелочи. Качественная реакция на спирт с йодом и щелочью называется йодоформной пробой. Светло-жёлтый мелкокристаллический осадок йодоформа СНI3 со специфическим запахом, образуется при действии на спирт йода и щелочи.
C2H5OH + I2 + NaOH → CHI3↓ + HCOONa + NaI + H2O
Йодоформной пробой можно обнаружить в водном растворе очень малое количество спирта. При нагреевании пробирки с йодоформом, раствор становится прозрачным. При охлаждении в воде вновь появляется осадок йодоформа.
Окисление этилового спирта оксидом меди (II)
Пары этанола взаимодействуют с оксидом меди раскаленной медной проволоки, получается уксусный альдегид. Фуксинсернистая кислота взаимодействует с альдегидом и окрашивается в фиолетовый цвет.
Фуксинсернистая кислота используется для обнаружения альдегидов, образующихся при окислении одноатомных спиртов.
Качественная реакция этанола уравнение реакции
Органическая химия
Качественные реакции в органической химии
Качественные реакции на алканы
Для этого газ либо поджигают — горение алканов сопровождается синим пламенем, либо пропускают через раствор перманганата калия. Алканы не окисляются перманганатом калия на холоду, вследствие этого раствор не будет изменять окраску.
Качественные реакции на алкены
а) Обесцвечивание перманганата калия (реакция Вагнера).
При этом этилен окисляется в двухатомный спирт этиленгликоль .
СН2=СН2 + [О] 
б) Обесцвечивание бромной воды:
Качественные реакции на алкины
а) Обесцвечивание перманганата калия (реакция Вагнера).
б) Обесцвечивание бромной воды:
в) Взаимодействие с с аммиачным раствором оксида серебра (гидроксид диаминсеребра (I)) (реактив Толленса)
Получившийся ацетиленид серебра (I) выпадает в осадок.
Алкины, у которых тройная связь в середине (R-C≡C-R) в эту реакцию не вступают.
Такая способность алкинов — замещать протон на атом металла, подобно кислотам — обусловлено тем, что атом углерода находится в состоянии sp-гибридизации и электроотрицательность атома углерода в таком состоянии такая же, как у азота. Вследствие этого, атом углерода сильнее обогащается электронной плотностью и протон становится подвижным.
Качественные реакции на альдегиды
а) Взаимодействие с аммиачным раствором оксида серебра (реакция серебряного зеркала)
Примечание: реакцией серебряного зеркала также можно выявить метановую (муравьиную) кислоту HCOOH. При чем тут кислота, если мы говорим про альдегиды? Все просто: муравьиная кислота — единственная из карбоновых кислот, содержащая одновременно альдегидную и карбоксильную группы:
В ходе реакции метановая кислота окисляется до угольной, которая разлагается на углекислый газ и воду:
б) Взаимодействие с гидроксидом меди (II) (реакция медного зеркала)
Для этого к свежеприготовленному гидроксиду меди (II) добавляют альдегид и нагревают смесь:
CH 3 -CHO + 2Cu(OH) 2 —> CH 3 -COOH + Cu 2 O↓ + 2H 2 O (реакция идет при нагревании)
Выпадает оксид меди (I) Cu2O — осадок красного цвета.
в) Взаимодействие с раствором фуксинсернистой кислоты.
При добавлении альдегида к раствору фуксинсернистой кислоты раствор окрашивается в светло-фиолетовый цвет.
Качественные реакции на спирты
Спирты по количеству гидроксильных групп бывают одно-, двух-, многоатомными. Для одно- и многоатомных спиртов реакции различны.
а) Окисление спирта оксидом меди.
Для этого пары спирта пропускают над раскаленным оксидом меди. Затем полученный альдегид улавливают фуксинсернистой кислотой, раствор становится фиолетовым:
б) Взаимодействие с натрием.
Качественные реакции на многоатомные спирты
а) Взаимодействие с гидроксидом меди (II).
В отличии от альдегидов многоатомные спирты реагируют с гидроксидом меди (II) без нагревания.
К примеру, при приливании глицерина образуется глицерат меди (II) ( хелатный комплекс темно-синего цвета):
Этиловый спирт. Химико-токсикологический анализ
» data-shape=»round» data-use-links data-color-scheme=»normal» data-direction=»horizontal» data-services=»messenger,vkontakte,facebook,odnoklassniki,telegram,twitter,viber,whatsapp,moimir,lj,blogger»>
Этиловый спирт. Химико-токсикологический анализ
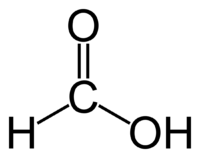
Этиловый спирт (этанол, метилкарбинол, винный спирт) С2Н5ОН – бесцветная легкоподвижная жидкость с характерным запахом и жгучим вкусом; т. кип. 78,39 °С.
Смешивается с водой, спиртами, диэтиловым эфиром, глицерином, хлороформом, ацетальдегидом, бензином и др.; образует азеотропную смесь водой (95,6 % по массе этанола, т. кип. 78,15 °С).
Этиловый спирт применяют в лакокрасочной и фармацевтической промышленности, в производстве кинофотоматериалов, товаров бытовой химии и др.
Является сырьём в производстве диэтилового эфира, хлороформа, ацетальдегида, уксусной кислоты, этилацетата и др. В медицине этиловый спирт применяют для дезинфекции, как поверхностное сосудорасширяющее средство, коагулянт белка, в том числе при лечении ожогов. Значительная часть этилового спирта идет на изготовление спиртных напитков.
Этиловый спирт чрезвычайно гигроскопичен, при концентрации выше 70 % (по объёму) прижигает кожу и слизистые оболочки; при приёме внутрь угнетает центры торможения мозга, вызывает опьянение, при многократном употреблении – алкоголизм.
Этиловый спирт. Качественное обнаружение
1. Реакция этерификации (образование этилацетата)
Ощущается запах этилацетата, который появляется более отчетливо, если содержимое пробирки вылить в 20-25 кратный объем воды.
Чувствительность реакции 15-20 мг.
Чувствительность реакции 3 мг.
3. Реакция образования йодоформа
I2 + 2NaOH = NaOI + NaI + H2O
CH3CHO + 3NaOI = CI3CHO + 3NaOH
CI3CHO + NaOH = CHI3 + HCOONa
При охлаждении раствора образуются кристаллы йодоформа в виде шестиугольников и звездочек.
Реакция не специфична, ее дает ацетон.
Чувствительность реакции 0,04 мг.
Предварительная проба на этанол в биологической жидкости (моча) проводится аналогично описанной выше пробе для метанола.
Реакция имеет отрицательное судебно-химическое значение.
Спирты, включенные в обязательный круг судебно-химического исследования при проведении общего анализа: метанол, этанол, пропанол, бутанол, амиловый. Токсикологическое значение спиртов связано с их широким применением в народном хозяйстве и в быту.
По физическим свойствам спирты – летучие жидкости и поэтому для их изолирования применяют метод перегонки с водяным паром. При этом учитывают взаимную растворимость изолируемого спирта и водяного пара. При исследовании токсических спиртов методом ГЖХ для изолирования в этом случае используют метод микродиффузии.
В последние годы наблюдается значительный рост числа интоксикаций, обусловленных употреблением спиртных напитков и суррогатов алкоголя. Это связано с резким повышением уровня алкоголизации населения, ростом количества некачественных спиртных напитков и употреблением с целью опьянения технических спиртсодержащих жидкостей.
Смертельные отравления алкоголем и его суррогатами прочно занимают первое место и почти в 3 раза превышают по количеству летальных исходов следующие за ними интоксикации наркотиками.
Спирты оказывают свое токсическое действие в первую очередь на ЦНС. Все спирты являются ядами ЦНС, так как обладают наркотическим действием и ослабляют процессы возбуждения.
Метиловый спирт избирательно поражает зрительный нерв и сетчатку глаз, что в 50% случаев приводит к слепоте. Обладает кумулятивными свойствами. Смертельная доза от 30 до 100 г, наступление слепоты возможно от принятия 7-8 г чистого спирта.
При отравлении метанолом латентный период составляет 3-4 дня, но иногда смерть наступает очень быстро, в течении 30 минут, причем состояния опьянения при этом может и не быть.
Амиловый спирт обладает наркотическим действием поражая ЦНС, а также сильным местным раздражающим действием, вызывая некроз слизистых оболочек. Смертельная доза при приеме внутрь 10-15 г. При судебно-химическом исследовании органов трупа наводящим указанием является специфический запах изоамилового спирта, исходящий от биологического материала.
Этиловый спирт при приеме внутрь (острая интоксикация) вызывает вначале возбуждение, а затем угнетение и паралич ЦНС. Относится к веществам наркотического действия и вызывает пристрастие – алкоголизм. Наркотический эффект этанола зависит от скорости всасывания (резорбции), фазы интоксикации (стадии резорбции и элиминации), от концентрации в крови, толерантности.
При длительном воздействии (хроническая интоксикация) на организм этанол может привести к тяжелым функциональным расстройствам нервной систем (алкогольные психозы – «белая горячка»: бред, галлюцинации с устрашающими видениями), вызвать поражение органов пищеварения, сердечно-сосудистой системы, жировое перерождение печени (цирроз) и т.д. Известно, что алкоголь влияет на потомство, приводя к рождению детей с умственными и физическими недостатками.
В последнее время обнаружено мощное токсическое воздействие этанола на биоритмы человека. При нарушении нормального хода этих биологических часов происходит рассогласование суточных ритмов – так называемая ресинхронизация, при этом у человека падает умственная и физическая работоспособность, нарушается сон, аппетит, изменяется обмен веществ.
Исследования установили очень важный факт: вызываемые алкоголем нарушение психофизиологического состояния человека сохраняются и после полного выведения спирта из организме. Только на третьи сутки после приема алкоголя восстанавливаются разрушенные им суточные биоритмы.
Смертельная доза этанола при однократном приеме составляет 4-12 г на килограмм массы тела, то есть для взрослого человека она составляет около 300 мл чистого 96% спирта (без учета толерантности).
Алкогольная кома развивается при концентрации спирта в крови 3 г/л (3%>), абсолютно смертельная концентрация в крови – 5-6 г/л (5-6 %).
Спирты. Токсикокинетика
Всасывание (резорбция). В организм спирты попадают через желудочно-кишечный тракт и легкие. Всасывание начинается быстро, уже во рту и пищеводе, но основная масса спирта всасывается в желудке или кишечнике. Спирты всасываются по средством простой диффузии, когда молекулы спирта транспортируются в кровь в неизмененном виде.
Скорость всасывания зависит от концентрации и количества принятого спирта, от степени и характера наполнения желудка и кишечника. При приеме натощак максимальная концентрация этанола в крови наблюдается через 40-80 мин ( в среднем около 1 часа), при полном желудке – через 1,5-2,5 часа.
Транспорт (распределение). Через кровь спирты распространяется по органам и тканям, обильно снабжаемым кровью, и концентрируется в тканях пропорционально содержанию в них воды. Наибольшие количество спирта содержатся в биологических жидкостях (кровь, моча, спинномозговая жидкость) и головном мозге.
Несколько меньше его в тканях, мышцах, и минимальное количество – в жировой ткани. Небольшие количества этилового спирта могут присутствовать в биоматериале вследствие естественных процессов при гниении крови и других органов трупа.
Метаболизм (биотрансформация). После всасывания спирты подвергаются в организме процессам биотрансформации в основном через окисление до соответствующих альдегидов и кислот, конечными продуктами превращения которых являются СО2 и Н2О.
Так, метанол окисляется до формальдегида, а затем до муравьиной кислоты:
Этанол на 90% и более окисляется до ацетальдегида и уксусной кислоты:
Катализирует процесс фермент алькогольдегидрогеназа (АДГ), акцептором Н2 служит коэнзим никотинамид-аденин-динуклеотид (НАД).
Этот процесс протекает в основном в печени, меньше в легких, почках, мышечной ткани. У хронических алкоголиков процессы биохимического окисления спирта протекают, кроме того, в мышцах с помощью фермента каталазы, поэтому такие люди выносят большие дозы алкоголя.
Скорость метаболизма зависит, главным образом, от времени, очень незначительно – от концентрации спирта. У взрослого человека скорость метаболизма спирта около 10 мл/час, суточный метаболизм – 400-500 мл.
Метанол окисляется в организме значительно медленнее, его можно обнаружить в крови на 3-4 день после смерти.
Выделение (элиминация) спирта протекает по механизму простой диффузии и происходит через легкие, кожу, почки, кишечник, слюнные железы в виде метаболитов. Только 10% этанола выделяется в неизмененном виде, из них 7% – через легкие, 2-2,5% – почками.
Спирты. Объекты исследования и пробоподготовка
Наиболее важными объектами для судебно-химической экспертизы служат:
- кровь
- моча
- ткани мозга
- легких
- печени
- почек
- глубокие мышцы бедра.
Желудок не может быть взят в качестве объекта исследования, так как возможно образование спирта естественным путем при брожении углеводов или при гнилостных процессах его содержимого.
Содержание эндогенного алкоголя в крови находится в пределах 0,008-0,4%. При диагностике состояния алкогольного опьянения в наркологической практике объектами служат выдыхаемый воздух, слюна, кровь, моча.
Правила отбора проб для исследования на спирты
При отборе жидких биологических сред у живых лиц также необходимо соблюдать определенные требования, а именно:
1. Моча отбирается в сухой стерильный флакон «под пробку». Флакон тотчас же закрывают пробкой. Отбор пробы мочи должен производиться в условиях, исключающих подмену или замену ее другими жидкостями.
2. Слюна отбирается в стерильный сухой флакон из-под пенициллина в количестве 5 мл и тут же закрывается пробкой.
3. Перед отбором пробы крови в сухой стерильный флакон из-под пенициллина закапывают 1-2 капли гепарина или 0,8 мл 3,8%-го раствора натрия цитрата и встряхиванием флакона смачивают его стенки.
4. Кровь в количестве 5 мл отбирается пункцией кубитальной вены при строгом соблюдении асептических условий самотеком во флакон, обработанный гепарином или цитратом. Флакон тотчас же закрывают стандартной резиновой пробкой, фиксируют пробку и содержимое флакона перемешивают.
Кожа в месте пункции предварительно обрабатывается раствором сулемы 1:1000 или риванолом 1:500. Дезинфекция кожи спиртом, эфиром, настойкой йода не допускается.
5. У всех флаконов с отобранными пробами фиксируют пробки алюминиевыми колпачками с помощью приспособления для обжима колпачков, обеспечивающего герметизацию флакона, и ставят их в холодильник. В случае герметизации другим способом флаконы должны быть опечатаны.
На каждый флакон наклеивается этикетка с указанием номера пробы (по регистрационной книге), даты, времени забора пробы, фамилии освидетельствуемого, фамилии медицинского работника, подготовившего пробу.
6. Биосреды должны исследоваться позднее суток с момента их отбора. Допускается их хранение в холодильнике при температуре -4° С в течение 5 суток.
Спирты. Обнаружение и определение
Спирты. Количественное определение
Спирты. Количественное определение спиртов базируется на их общих реакциях: окислении до альдегидов и образовании сложных эфиров.
Из всех спиртов, имеющих токсикологическое значение, только этиловый подлежит обязательному количественному определению при судебно-химических исследованиях.
Это обусловлено следующими причинами:
- чрезвычайно широкое распространение и особое токсикологическое значение этанола, о чем уже говорилось,
- возможность естественного образования этанола в организме, а именно: при брожении и гниении сахаристых веществ в желудке, при бактериальном распаде белковых веществ, при метаболическом превращении высших спиртов.
В судебно-химической практике для количественного определения этанола используют методы, основанные на окислении его до ацетальдегида и образовании сложного эфира с азотистой кислотой – этилнитрита. Известно много методов, в том числе химических, но в настоящее время наибольшее значение приобрели наиболее чувствительные и точные современные методы – биохимический и инструментальный (метод ГЖХ). На их рассмотрении мы и остановимся.
Спирты. Метод биохимический (энзимный, ферментативный, метод АДГ) был разработан в 1951г. Бюхером и Родецки и применяется, в основном, в зарубежных лабораториях. Метод основан на реакции окисления этанола до ацетальдегида под действием фермента алкогольдегидрогеназы (АДГ).
Акцептором водорода в реакции служит дифосфопиридин-нуклеотид (ДПН), восстановленная форма которого обладает характерным светопоглощением при длине волны 366 нм. Измеряя оптическую плотность продукта реакции, можно рассчитать содержание этанола в исследуемом объекте, т.к. количество восстановленной формы ДПН, т.е. его оптическая плотность, пропорциональны количеству этанола. Расчет ведут по калибровочному графику, построенному по растворам этанола с известной концентрацией.
Судебно-химическая оценка метода.
Метод чувствителен (0,1-0,2%) на уровне естественного содержаний этанола в организме, специфичен, позволяет проводить серийные анализы, однако требует специального оборудования и особо чистых ферментов (АДГ и ДПН), в связи с чем в нашей стране не нашел применения.
Спирты. Метод газожидкостной хроматографии (ГЖХ) основан на переведении этанола в более летучее соединение – этиловый эфир азотистой кислоты (этилнитрит). Прежде, чем перейти к описанию этого метода, рассмотрим основные его теоретические положения и аппаратурное оформление и остановимся на преимуществах его перед химическими методами анализа.
ОДНОАТОМНЫЕ СПИРТЫ
Этиловый спирт в химико-токсикологическом отношении
Этиловый спирт и его суррогаты: свойства, механизм действия на организм человека. Токсичность. Распространенность отравлений.
Проблемы и распространенность алкоголизма. Экспертиза алкогольного опьянения. Клиника отравлений этиловым спиртом. Клиническая диагностика опьянения.
Этиловый спирт. Токсикокинетика. Экспертная оценка содержания этанола при химико-токсикологическом исследовании внутренних органов и биожидкостей. Объекты исследования. Правила отбора пробы у живых лиц и трупного материала.
Методы анализа, применяемые в диагностике алкогольного опьянения и судебно-химической экспертизе: предварительные пробы, химические и биохимические методы.
Из группы летучих ядов наибольшее токсикологическое значение имеют одноатомные спирты с общей формулой:
С nН 2n+1ОН, где С nН 2n+1 = R
R: СН3 – метиловый спирт
С2Н5 – этиловый спирт
С3Н7 – пропиловый спирт
С4Н8 – бутиловый спирт
С5Н11 – амиловый спирт (изоамиловый)
По физическим свойствам спирты представляют собой бесцветные прозрачные жидкости с характерным запахом (особенно изоамиловый), их плотность d
http://www.sites.google.com/site/school302chemistry/opyty/kacestvennye-reakcii-10-klass
http://farmf.ru/lekcii/etilovyj-spirt-ximiko-toksikologicheskij-analiz/