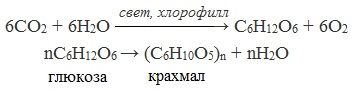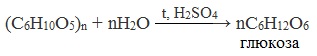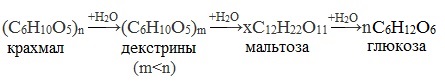Качественная реакция на крахмал уравнение
Крахмал – ценный питательный продукт. Он входит в состав хлеба, картофеля, круп и наряду с сахарозой является важнейшим источником углеводов в человеческом организме.
Химическая формула крахмала (С6(Н2О)5) n .
Строение крахмала
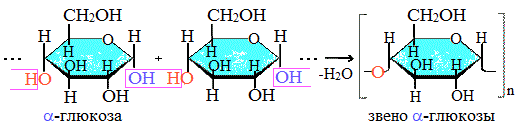
Крахмал состоит из 2 полисахаридов, построенных из остатков циклической a-глюкозы.
Как видно, соединение молекул глюкозы происходит с участием наиболее реакционноспособных гидроксильных групп, а исчезновение последних исключает возможность образования альдегидных групп, и они в молекуле крахмала отсутствуют. Поэтому крахмал не дает реакцию «серебряного зеркала».
Крахмал состоит не только из линейных молекул, но и из молекул разветвленной структуры. Этим объясняется зернистое строение крахмала.
В состав крахмала входят:
- амилоза (внутренняя часть крахмального зерна) — 10-20%;
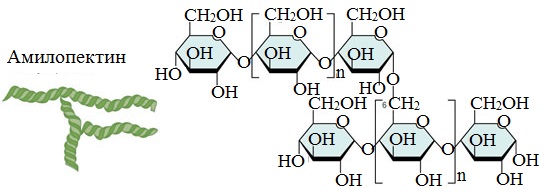
- амилопектин (оболочка крахмального зерна) — 80-90%.
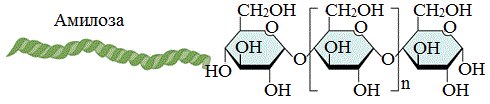
Амилоза
Амилоза растворима в воде и представляет собой линейный полимер, в котором остатки α–глюкозы связаны друг с другом через первый и четвертый атомы углерода (α-1,4-гликозидными связями).
Цепь амилозы включает 200 — 1000 остатков a-глюкозы (средняя мол. масса 160 000) .
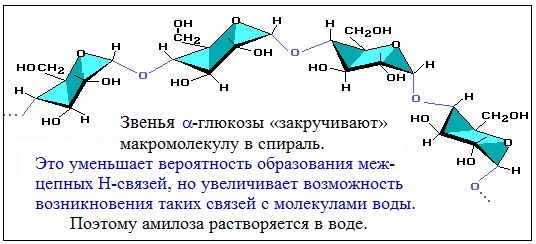
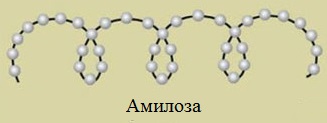
Макромолекула амилозы представляет собой спираль, каждый виток которой состоит из 6 звеньев a-глюкозы.
Амилопектин
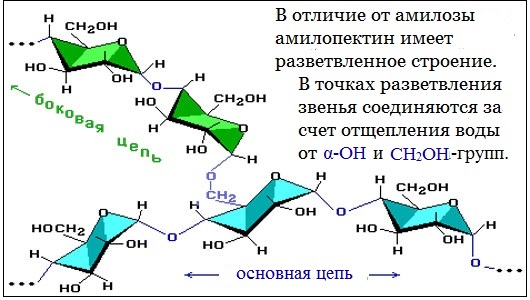
В отличие от амилозы, амилопектин не растворим в воде, и имеет разветвленное строение.
Подавляющее большинство глюкозных остатков в амилопектине связаны, как и в амилозе α-1,4-гликозидными связями. Однако в точках разветвлений цепи имеются α-1,6-гликозидные связи.
Молекулярная масса амилопектина достигает 1-6 млн.
Молекулы амилопектина также довольно компактны, так как имеют сферическую форму.
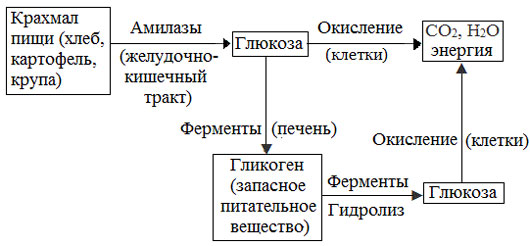
Биологическая роль крахмала. Гликоген
Крахмал – главное запасное питательное вещество растений, основной источник резервной энергии в растительных клетках.
Остатки глюкозы в молекулах крахмала соединены достаточно прочно и в то же время под действием ферментов легко могут отщепляться, как только возникает потребность в источнике энергии.
Амилоза и амилопектин гидролизуются под действием кислот или ферментов до глюкозы, которая служит непосредственным источником энергии для клеточных реакций, входит в состав крови и тканей, участвует в обменных процессах.
Гликоген (животный крахмал) – полисахарид, молекулы которого построены из большого числа остатков α–глюкозы. Он имеет сходное строение с амилопектином, но отличается от него большей разветвленностью цепей, а также большей молекулярной массой.
Содержится гликоген главным образом в печени и в мышцах.
Гликоген – белый аморфный порошок, хорошо растворяется даже в холодной воде, легко гидролизуется под действием кислот и ферментов, образуя в качестве промежуточных веществ декстрины, мальтозу и при полном гидролизе – глюкозу.
Превращение крахмала в организме человека и животных
Нахождение в природе
Крахмал широко распространен в природе. Он образуется в растениях в процессе фотосинтезе и накапливается в клубнях, корнях, семенах, а также в листьях и стеблях.
Крахмал содержится в растениях в виде крахмальных зерен. Наиболее богато крахмалом зерно злаков: риса (до 80%), пшеницы (до 70%), кукурузы (до 72%), а также клубни картофеля (до 25%). В клубнях картофеля крахмальные зерна плавают в клеточном соке, в злаках они плотно склеены белковым веществом клейковиной.
Физические свойства
Крахмал – белое аморфное вещество, без вкуса и запаха, нерастворимое в холодной воде, в горячей воде набухает и частично растворяется, образуя вязкий коллоидный раствор (крахмальный клейстер).
Крахмал существует в двух формах: амилоза – линейный полимер, растворимый в горячей воде, амилопектин – разветвлённый полимер, не растворимый в воде, лишь набухает.
Химические свойства крахмала
Химические свойства крахмала объясняются его строением.
Крахмал не дает реакцию «серебряного зеркала», однако ее дают продукты его гидролиза.
1. Гидролиз крахмала
При нагревании в кислой среде крахмал гидролизуется с разрывом связей между остатками α-глюкозы. При этом образуется ряд промежуточных продуктов, в частности мальтоза. Конечным продуктом гидролиза является глюкоза:
Процесс гидролиза протекает ступенчато, схематически его можно изобразить так:
Видеоопыт «Кислотный гидролиз крахмала»
Реакцию превращения крахмала в глюкозу при каталитическом действии серной кислоты открыл в 1811 г. русский ученый К.Кирхгоф (реакция Кирхгофа).
2. Качественная реакция на крахмал
Так как молекула амилозы представляет собой спираль, то при взаимодействии амилозы с йодом в водном растворе молекулы йода входят во внутренний канал спирали, образуя так называемое соединение включения.
Раствор иода окрашивает крахмал в синий цвет. При нагревании окрашивание исчезает (комплекс разрушается), при охлаждении появляется вновь.
Крахмал + J2 – синее окрашивание
Видеоопыт «Реакция крахмала с йодом»
Данная реакция используется в аналитических целях для обнаружения, как крахмала, так и йода (йодкрахмальная проба)
3. Большинство глюкозных остатков в молекулах крахмала имеют по 3 свободных гидроксила (у 2,3,6-го атомов углерода), в точках разветвления – у 2-го и 3-го атомов углерода.
Следовательно, для крахмала возможны реакции, характерные для многоатомных спиртов, в частности образование простых и сложных эфиров. Однако эфиры крахмала большого практического значения не имеют.
Качественную реакцию на многоатомные спирты крахмал не дает, так как плохо растворяется в воде.
Получение крахмала
Из растений извлекают крахмал, разрушая клетки и отмывая его водой. В промышленном масштабе его получают главным образом из клубней картофеля (в виде картофельной муки), а также кукурузы, в меньшей степени – из риса, пшеницы и других растений.
Получение крахмала из картофеля
Картофель моют, измельчают и промывают водой и перекачивают в большие сосуды, где происходит отстаивание. Вода извлекает из измельченного сырья крахмальные зерна, образуя так называемое «крахмальное молоко».
Полученный крахмал ещё раз промывают водой, отстаивают и сушат в струе теплого воздуха.
Получение крахмала из кукурузы
Зерна кукурузы замачивают в теплой воде разбавленной сернистой кислоты с целью размягчения зерна и удаления из него основной части растворимых веществ.
Набухшее зерно дробят для удаления ростков.
Ростки, после всплывания на поверхность воды, отделяют и используют в дальнейшем для получения кукурузного масла.
Кукурузную массу повторно измельчают, обрабатывают водой для вымывания крахмала, затем отделяют отстаиванием или с помощью центрифуги.
Применение крахмала
Крахмал широко применяется в различных отраслях промышленности (пищевой, фармацевтической, текстильной, бумажной и т.п.).
Он является основным углеводом пищи человека – хлеба, круп, картофеля.
В значительных количествах перерабатывается на декстрины, патоку и глюкозу, используемые в кондитерском производстве.
Из крахмала, содержащегося в картофеле и зерне злаков, получают этиловый, н-бутиловый спирты, ацетон, лимонную кислоту, глицерин.
Крахмал используется как клеящее средство, применяется для отделки тканей, крахмаления белья.
В медицине на основе крахмала готовятся мази, присыпки и т.д.
Качественная реакция на крахмал уравнение
I. Фильм: “Полисахариды”
II. Физические свойства
Крахмал белый порошок, нерастворимый в холодной воде и образующий коллоидный раствор (крахмальный клейстер) в горячей воде. Существует в двух формах: амилоза – линейный полимер, растворимый в горячей воде, амилопектин – разветвлённый полимер, не растворимый в воде, лишь набухает.
III. Нахождение в природе
Крахмал – основной источник резервной энергии в растительных клетках – образуется в растениях в процессе фотосинтеза и накапливается в клубнях, корнях, семенах:
Содержится в клубнях картофеля, зёрнах пшеницы, риса, кукурузы.
Гликоген (животный крахмал), образуется в печени и мышцах животных.
IV. Строение
Состоит из остатков α — глюкозы.
В состав крахмала входят:
- амилоза (внутренняя часть крахмального зерна) – 10-20%
- амилопектин (оболочка крахмального зерна) – 80-90%
Цепь амилозы включает 200 – 1000 остатков α-глюкозы и имеет неразветвленное строение.
Амилопектин состоит из разветвленных макромолекул, молекулярная масса которых достигает 1 — 6 млн.
Амилоза и амилопектин гидролизуются под действием кислот или ферментов до глюкозы, которая служит непосредственным источником энергии для клеточных реакций, входит в состав крови и тканей, участвует в обменных процессах. Поэтому крахмал – необходимый резервный углевод питания.
Подобно амилопектину построен гликоген (животный крахмал), макромолекулы которого отличаются большей разветвлённостью:
V. Применение
Крахмал широко применяется в различных отраслях промышленности (пищевой, бродильной, фармацевтической, текстильной, бумажной и т.п.).
- Ценный питательный продукт.
- Для накрахмаливания белья.
- В качестве декстринового клея.
VI. Химические свойства полисахаридов
1. Гидролиз
Гидролиз протекает ступенчато:
Охлаждённый крахмальный клейстер + I2 (раствор) = синее окрашивание, которое исчезает при нагревании.
Макромолекула амилозы представляет собой спираль, каждый виток которой состоит из 6 звеньев α-глюкозы.
При взаимодействии амилозы с йодом в водном растворе молекулы йода входят во внутренний канал спирали, образуя так называемое соединение включения. Это соединение имеет характерный синий цвет. Данная реакция используется в аналитических целях для обнаружения, как крахмала, так и йода (йодкрахмальная проба)
Опыт 3. Качественная реакция на крахмал. Обнаружение крахмала в продуктах питания.
Лабораторная работа № 13
Тема: Взаимодействие глюкозы и сахарозы с гидроксидом меди. Качественная реакция на крахмал.
Цель работы: Изучить качественные реакции на углеводы.
Оборудование: Пробирки, штатив для пробирок, держатель для пробирок, горелка.
Реактивы: растворы гидроксида натрия (NaOH) и сульфата меди (CuSO4), глюкозы (C6H12O6), сахарозы (C12H22O11), аммиачный раствор оксида серебра (Ag2O)спиртовый раствор йода (J2), раствор крахмала, кусочек белого хлеба, ломтик сырого картофеля
Глюкоза, сахароза и крахмал относятся к классу углеводов. Глюкоза – моносахарид, её молекулярная формула — C6H12O6
В структуре молекулы глюкозы присутствуют альдегидная группа 
Альфа – форма глюкозы:  |
пять гидроксильных групп — ОН , может существовать в альдегидной форме, а также в циклической:
Бета – форма глюкозы:  |
Альдегидная форма глюкозы:  |
Поэтому глюкоза в реакциях проявляет свойства и альдегидов, и многоатомных спиртов:
а) Реакция с аммиачным раствором оксида серебра: (см. опыт 2):
б) Реакция с гидроксидом меди (см. опыт 1, часть Б):
Сахароза – природный дисахарид, состоит из остатков глюкозы и фруктозы:
Ход выполнения работы
Запишите описание опыта, наблюдения, запишите уравнения реакций, объясните результаты опытов. Оформите отчет о работе в таблице:
8см 6см 14см(на ширину страницы)
| Описание опыта (Что делали?) | Наблюдение (Что видим?) | Уравнения реакций, объяснение. |
Опыт 1. Действие гидроксида меди (II) на глюкозу и сахарозу:
а) Получаем гидроксид меди: в пробирку налить 1 мл раствора гидроксида натрия и 1 мл раствора сульфата меди
— наблюдаем образование голубого осадка гидроксида меди (II),
б) К полученному осадку прилить 1 мл раствора глюкозы.
— осадок сразу растворяется и раствор окрашивается в ярко-синий цвет:
происходит качественная реакция на многоатомные спирты, значит глюкоза- это многоатомный спирт
в) В пробирку к полученному ярко-синему раствору прилить немного воды, нагреть пробирку так, чтобы прогревалась только верхняя часть раствора.
— наблюдаем образование желто-красного осадка
Желто-красную окраску имеют соединения одновалентной меди, значит после нагревания образовались оксид меди(I) и гидроксид меди (I). Это качественная реакция на альдегидную группу, значит глюкоза проявляет свойства альдегидов
г) Опыт повторить с раствором сахарозы (пункты а,б,в).
Опыт 2. Реакция «серебряного зеркала» с глюкозой
В пробирку налить 1 мл раствора глюкозы, добавить аммиачный раствор оксида серебра. Пробирку нагреть.
— наблюдаем осаждение серебра на дне и стенках пробирки.
Объяснить появление «зеркального» слоя на стенках пробирки (какие свойства проявляет глюкоза в этом опыте?)
Опыт 3. Качественная реакция на крахмал. Обнаружение крахмала в продуктах питания.
а) В химический стакан насыпать немного крахмала налить 20 мл кипящей воды, образовавшуюся смесь перемешать до образования прозрачного коллоидного раствора — крахмального клейстера. В пробирку налить немного охлажденного клейстера и добавить несколько капель спиртового раствора иода.
— наблюдаем синее окрашивание раствора. При нагревании полученного раствора синее окрашивание исчезает.
Появление синей окраски – это качественная реакция на крахмал.
б) Нанести по 1-2 капли раствора иода на ломтики картофеля, банана, кусочек белого хлеба. Что наблюдаете?
Нормы времени: 2 часа.
Литература: 1) страница 178-179. Габриелян О.С. Химия. 10 класс. Базовый уровень: Учебник для общеобразовательных учреждений. – 8-е изд. стереопит. – М.: Дрофа, 2013. – 223, [1]с.: ил.
http://kardaeva.ru/90-dlya-uchenika/10-klass/202-krakhmal-ego-stroenie-khimicheskie-svojstva-primenenie
http://poisk-ru.ru/s28033t15.html