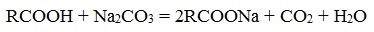Качественные реакции на мыло
1. Выделение свободных высших жирных кислот. Около 1 г мыла растворяют в 8-10 см 3 воды при нагревании. К полученному раствору прибавляют 3-4 см 3 5%-ного раствора серной кислоты. При этом выделяется осадок нерастворимых высших жирных кислот.
2. Действие солей мгоговалентных металлов. К 3 см 3 0,5%-ного раствора мыла прибавляют несколько капель 10%-ного раствора хлористого кальция. Наблюдают образование осадка нерастворимых кальциевых солей высших жирных кислот.
G Техника безопасности.При омылении жира используют достаточно концентрированные растворы едкого натра, которые при попадании на кожу или слизистые оболочки могут вызвать сильное раздражение и даже химические ожоги. В этом случае места поражения следует промыть обильно струей воды, затем 1%-ным раствором уксусной кислоты (находится в уголке по технике безопасности) и опять обильно водой.
Углеводы
Моносахариды. Строение моносахаридов. Стереохимия моносахаридов.
D- и L-ряды. Кольчато-цепная таутомерия моносахаридов. Аномеры. Эпимеры. Характер окисных колец. Мутаротация моносахаридов. Получение моносахаридов: гидролиз ди- и полисахаридов, альдольная конденсация, оксинитрильный синтез, распад по Руффу, взаимные переходы в щелочных, водных растворах. Реакции с фенилгидразином, переход от альдоз к кетозам. Условия проведения реакций.
Дисахариды. Восстанавливающие и невосстанавливающие дисахариды. Инверсия сахарозы, условия проведения.
Полисахариды. Строение крахмала и клетчатки. Гидролиз крахмала: условия проведения, продукты гидролиза, взаимодействие с иодом. Пентозаны. Получение фурфурола. Нахождение в природе и использование полисахаридов.
Синтез b-пентаацетилглюкозида
Уравнения основных реакций:
Реактивы
Основные.
| Глюкоза (безводная) | 5 г |
| Уксусный ангидрид | 23 см 3 |
Вспомогательные.
| Ацетат натрия (безводный) | 2,5 г |
| Дистиллированная вода | 200 см 3 |
| Этиловый спирт | 50 см 3 |
| Лед |
Посуда и приборы
| Колба круглодонная (100 см 3 ) | 2 шт. |
| Обратный холодильник шариковый | 1 шт. |
| Трубка хлоркальциевая | 1 шт. |
| Чашка фарфоровая со ступкой | 1 шт. |
| Стакан ( 500 см 3 ) | 1 шт. |
| Стеклянная палочка | 1 шт. |
| Установка для вакуум-фильтрования | 1 шт. |
| Электроплитка | 1 шт. |
| Водяная баня | 1 шт. |
Выполнение синтеза
Тщательно растирают и смешивают в фарфоровой чашке со ступкой 5 г растертой в порошок безводной глюкозы с 265 г безводного ацетата натрия. Смесь помещают в круглодонную колбу емкостью 100 см 3 и добавляют при размешивании 23 см 3 уксусного ангидрида. Колбу соединяют с обратным холодильником, закрытым хлоркальциевой трубкой (Приложение В, рис. 3), и нагревают на кипящей водяной бане в течение 2,5 часа при периодическом перемешивании реакционной смеси (путем покачивания вместе со штативом).
По окончании реакции жидкость выливают тонкой струей (при размешивании) в стакан, в который предварительно помещают около 200 см 3 воды со льдом. Выпавшую массу белого цвета тщательно размешивают стеклянной палочкой и оставляют на 1,5 часа под слоем воды. В это время происходит гидролиз не вступившего в реакцию уксусного ангидрида. Затем b-пентаацетилглюкозид (белую кристаллическую массу) отфильтровывают на установке для вакуум-фильтрования (Приложение В, рис. 4), хорошо отжимают на фильтре и перекристаллизовывают из этилового спирта.
Для перекристаллизации требуется примерно 50 см 3 этилового спирта. Растворение производят в колбе, снабженной обратным холодильником (Приложение В, рис. 3), на кипящей водяной бане. Если при кипячении раствора вещество полностью не растворяется, то через верх внутренние трубки холодильника приливают еще некоторое количество растворителя. Дальнейший принцип работы с приготовленным горячим раствором обычен и описан в /9, 27-29/.
Качественная реакция на мыло уравнение реакции
Известно несколько способов получения мыл.
- Нейтрализация кислот углекислым натрием (кальцинированной содой)
- Нейтрализация кислот гидроксидом натрия (каустической содой)
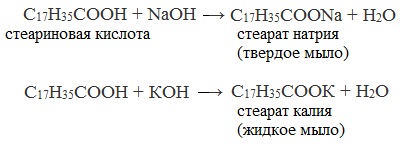
Жидкие калиевые мыла и твердые натриевые мыла получают растворением высших алифатических кислот в водных растворах едких щелочей:
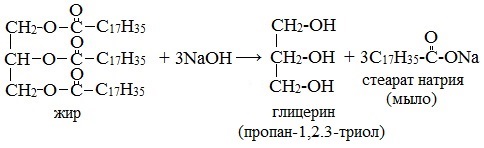
- Омыление триглицеридов гидроксидом натрия
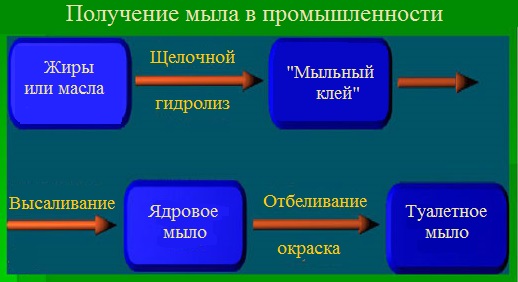
Получение мыла основано на реакции омыления — кипячением животного сала либо растительного масла с гидроксидом натрия или калия (гидролиз сложных эфиров жирных кислот (т.е. жиров) в присутствии щелочей), в результате которого образуется трехатомный спирт глицерин и соли высших карбоновых кислот (мыло):
Прямой способ. В специальных емкостях (варочных котлах) нагретые жиры омыляют едкой щёлочью (обычно гидроксидом натрия). Для гидролиза жира в щелочной среде берется немного топленого свиного сала, около 10 мл этилового спирта и 10 мл раствора щелочи.
В результате реакции в варочных котлах образуется однородная вязкая жидкость, густеющая при охлаждении — мыльный клей, состоящий из мыла и глицерина. Содержание жирных кислот в мыле, полученном непосредственно из мыльного клея обычно 40—60 %. Такой продукт имеет название «клеевого мыла».
Косвенный способ заключается в дальнейшей обработке мыльного клея.
Варку мыла заканчивают обработкой мыльного раствора (мыльного клея) избытком щелочи или раствором хлорида натрия. В результате этого на поверхность раствора всплывает концентрированный слой мыла, называемый ядром.
Он содержит не менее 60 % жирных кислот; нижний слой — подмыльный щёлок, раствор электролита с большим содержанием глицерина. (также содержит загрязняющие компоненты, содержавшиеся в исходном сырье).
Полученное мыло называют ядровым, а процесс его выделения из раствора – отсолкой или высаливанием.
Производство хозяйственного мыла заканчивают на стадии высаливания, при этом происходит очистка мыла от белковых, красящих и механических примесей. Производство туалетного мыла проходит все стадии механической обработки. Наиболее важной из них является шлифовка, т.е. переведение ядрового мыла в раствор кипячением с горячей водой и повторным высаливанием. При этом мыло получается особо чистым и светлым.
Для улучшения некоторых характеристик хозяйственного мыла, а также для удешевления в него вводят наполнители: некоторые натриевые соли, которые при растворении в воде приводят к подщелачиванию; клеи и крахмал – способствуют пенообразованию мыльного раствора и стойкости пены, однако моющей способностью не обладают.
Особое место среди наполнителей занимает сапонин, получаемый выщелачиванием некоторых растений и прежде всего мыльного корня. Он хорошо растворяется в воде и его растворы сильно пенятся. Сапонин применяют для дорогих сортов мыла.
При использовании в качестве щёлочи каустической соды получают твердое натриевое мыло. Мягкое или даже жидкое калиевое мыло образуется, когда применяется каустический поташ.
Главное условие красящих веществ, употребляемых для подкраски туалетного мыла, — это хорошее смешивание их с мылом и отсутствие вредного влияния на кожу.
Красный цвет для прозрачного мыла получают при помощи фуксина и эозина, для непрозрачного мыла используют киноварь и сурик. Желтый цвет мылу придает экстракт куркумы и пикриновая кислота. Для получения мыла зеленого цвета применяют зеленый анилин или хромовую зеленую краску. Коричневый цвет мыла образуется из светлой или темной коричневой анилиновой краски или жженого сахара.
В промышленности вместо щелочи применяют соду, а так как жиры являются одной из главных составляющих пищи человека, то за основу берут не животные жиры, а углеводороды, входящие в состав парафинов (нефти).
Мыла полученные из синтетических кислот аналогичны по своей химической природе обычным мылам.
4.1.5. Качественные реакции органических соединений.
| Соединение, функциональная группа | Реагент | Что наблюдается, уравнение реакции |
| Фенол | Бромная вода | |
| Светло-желтая окраска разбавленного раствора соли трехвалентного железа сменяется на фиолетовую | ||
| Анилин | Бромная вода | |
| Многоатомные спирты | Свежеосажденный Cu(OH)2 (II) | |
| Лакмус | Окрашивание лакмуса в красный цвет | |
| Карбонаты, например, K2CO3 | ||
| Спирт + конц. H2SO4 | Любая сильная неорганическая кислота или кислота средней силы H2SO4 (разб.) HCl HI HBr HNO3 (разб.) H3PO4 | |
| Раствор соли Ca или Mg | ||
| Фенолфталеин |