Частные реакции катионов второй аналитической группы
Реакции катиона свинца Pb 2+
1. Хлороводородная кислота HCl и растворимые хлориды осаждают из умеренно концентрированных растворов солей свинца (II) белый хлопьевидный осадок хлорида свинца (II), легко растворимый в горячей воде:
Pb(NO3)2 + 2HCl 
Pb 2+ + 2Cl — 
Выполнение реакции. В пробирку помещают 2 капли раствора нитрата свинца (II) Pb(NO3)2 и добавляют 2 капли хлороводородной кислоты. К раствору с осадком добавляют 0,5 мл дистиллированной воды и нагревают смесь на водяной бане. Наблюдают растворение осадка и постепенное его выпадение при охлаждении раствора.
2. Едкие щелочи из растворов солей свинца (II) осаждают гидроксид свинца (II) – осадок белого цвета:
Pb(NO3)2 + 2KOH 
Pb 2+ + 2OH — 
Гидроксид свинца (II) обладает амфотерными свойствами, поэтому он растворяется в разбавленной азотной или уксусной кислотах и в избытке щелочи:
Pb(OH)2 + 2KOH 
Выполнение реакции. К 2 каплям соли свинца (II) прибавляют сначала 1 каплю раствора щелочи, а затем ее избыток и наблюдают выпадение осадка и последующее его растворение в избытке щелочи.
3. Серная кислота H2SO4 и растворимые сульфаты выделяют из свинцовых солей труднорастворимый сульфат свинца – осадок белого цвета:
Pb(NO3)2 + H2SO4 
Pb 2+ + SO4 2- 
Осадок растворим при нагревании в растворах щелочей (10-15%):
PbSO4 + 4NaOH 
Выполнение реакции. К 2 каплям раствора соли свинца (II) прибавляют 2 капли разбавленной серной кислоты и наблюдают выпадение осадка.
4. Иодид калия KI, взаимодействуя со свинцовыми солями, дает желтый осадок иодида свинца (II):
Pb(NO3)2 + KI 
Pb 2+ + 2I — 
Реакция часто применяется для открытия ионов Pb 2+ .
Выполнение реакции. К 2 каплям раствора нитрата свинца (II) Pb(NO3)2 добавляют 2 капли раствора иодида калия. В полученный раствор с осадком добавляют 0,5 мл воды и 3-4 капли разбавленной уксусной кислоты; нагревают смесь на кипящей водяной бане в течение 2 мин, затем охлаждают содержимое пробирки под струей воды. Растворившийся при нагревании осадок иодида свинца вновь выпадает в виде красивых золотистых чешуек.
5. Хромат калия K2CrO4 или хромат натрия Na2CrO4 выделяет из раствора соли свинца желтый осадок соли свинца (II):
Pb(NO3)2 + K2CrO4 
Pb 2+ + CrO4 2- 
Осадок не растворяется в уксусной кислоте, но растворяется в азотной кислоте и щелочах. Реакция чувствительна и является характерной для ионов Pb 2+ .
Выполнение реакции. К 2 каплям раствора соли свинца (II) добавляют 2 капли раствора хромата калия и наблюдают выпадение осадка.
Реакции катиона серебра Ag +
1. Хлороводородная кислота HCl и растворимые хлориды осаждают из нейтральных и кислых растворов солей серебра в виде белого творожистого осадка хлорида серебра:
AgNO3 + HCl 
Ag + + Cl — 
Осадок легко растворяется в избытке аммиака с образованием комплексной соли:
AgCl + 2 NH3 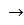
При подкислении аммиачного раствора концентрированной азотной кислотой эта соль разрушается и вновь выпадает осадок хлорида серебра:
[Ag(NH3)2]Cl + 2HNO3 
Эту реакцию обычно используют для открытия иона Ag + . Она является фармакопейной.
Выполнение реакции. В пробирку помещают 2 капли раствора нитрата серебра, добавляют к нему 2 капли разбавленной хлороводородной кислоты. К раствору с осадком добавляют 5 капель концентрированного раствора аммиака и встряхивают смесь до растворения осадка. К полученному раствору добавляют 6 капель концентрированной азотной кислоты. Наблюдают выпадение осадка.
2. Иодид калия KI образует с ионом Ag + светло-желтый осадок AgI:
AgNO3 + KI 
Ag + + l — 
Иодид серебра не растворяется в растворе аммиака в отличие от хлорида серебра.
Выполнение реакции. К 2 каплям раствора нитрата серебра добавляют 2 капли иодида калия и наблюдают выпадение осадка.
3. Хромат калия K2CrO4 из растворов солей серебра осаждает кирпично-красный хромат серебра:
2AgNO3 + K2CrO4 
2Ag + + CrO4 2- 
Осадок растворяется в растворе аммиака и азотной кислоте.
Выполнение реакции. К 2 каплям раствора нитрата серебра добавляют 2 капли раствора хромата калия и наблюдают выпадение осадка.
4. Едкие щелочи из растворов солей серебра осаждают грязно-коричневый осадок оксида серебра:
2AgNO3 + 2KOH 
2Ag + + 2OH — 
Выполнение реакции. К 2 каплям раствора нитрата серебра добавляют 2 капли раствора щелочи и наблюдают выпадение осадка.
5. Тиосульфат натрия Na2S2O3 из растворов солей серебра выделяет белый осадок, который быстро желтеет, затем буреет и переходит в черный:
2AgNO3 + Na2S2O3 
Ag2 S2O3 + H2O 
Осадок Ag2 S2O3 растворяется в избытке тиосульфата с образованием комплексных солей, поэтому осадок образуется при избытке ионов серебра. Реакция является фармакопейной.
Выполнение реакции. К 2 каплям раствора нитрата серебра добавляют 1 каплю раствора тиосульфата натрия. Наблюдается изменение цвета осадка.
Реакции катиона ртути (I) Hg2 2+
1. Хлороводородная кислота HCl и растворимые хлориды из растворов солей ртути (I) осаждают хлорид ртути (I), или каломель, — осадок белого цвета:
Hg2(NO3)2 + HCl 
Hg2 2+ +2Cl — 
Водный раствор аммиака окрашивает осадок в черный цвет, обусловленный образованием черной мелкораздробленной ртути:
Hg2Cl2 + 2 NH3 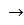
С помощью этой реакции открывают ион Hg2 2+ .
Выполнение реакции. К 2 каплям раствора нитрата ртути (I) Hg2(NO3)2 добавляют 2 капли раствора разбавленной хлороводородной кислоты. К раствору с осадком добавляют 3 капли раствора аммиака. Наблюдают почернение осадка.
2. Иодид калия KI из растворов солей ртути (I) осаждает иодид ртути (I) – осадок болотно-зеленого цвета:
Hg2(NO3)2 + 2KI 
Осадок довольно легко распадается на иодид ртути (II) и металлическую ртуть; при этом цвет осадка изменяется:
Hg2I2 
Выполнение реакции. К 2 каплям раствора нитрата ртути (I) Hg2(NO3)2 добавляют 2 капли раствора иодида калия. Наблюдают выпадение осадка и изменение его цвета при встряхивании.
3. Хромат калия K2CrO4 
Hg2(NO3)2 + K2CrO4 
2Hg + + CrO4 2- 
Осадок не растворяется в щелочах и разбавленной уксусной кислоте.
Выполнение реакции. 2 капли раствора Hg2(NO3)2 , помещенные в пробирку, нагревают на водяной бане и добавляют 2 капли хромата калия.
РЕАКЦИИ КАТИОНОВ II АНАЛИТИЧЕСКОЙ ГРУППЫ.
Ко второй аналитической группе относятся катионы Ag + , Pb 2+ , [Hg2] 2+ .
Эти элементы находятся в разных группах периодической системы Д.И. Менделеева. Они имеют либо законченные 18–электронные внешние слои, либо оболочки, содержащие 18+2 электронов в двух наружных слоях, что обуславливает одинаковое отношение их галогенид ионам.
Групповым реагентом на катионы II аналитической группы является 2моль/л раствор хлороводородной кислоты. Катионы Ag + , Pb 2+ , [Hg2] 2+ при взаимодействии с ней образуют труднорастворимые в воде и в разбавленных кислотах осадки белого цвета:
Pb 2+ + 2Cl — → PbCl2
Следует избегать избытка реагента и использования концентрированной хлороводородной кислоты, так как могут образовываться растворимые комплексные соединения:
Растворимость хлоридов различна. При 20 0 C : хлорид свинца – 11,0 г/л, хлорид серебра – 1,8·10 -3 г/л, хлорид ртути (I) — 2,0·10 -4 г/л. При увеличении температуры воды до 100 0 С растворимость PbCl2 увеличивается в 3 раза, в то время как растворимость AgCl и Hg2Cl2 практически остается прежней. Это свойство используется для отделения катионов Pb 2+ от катионов [Hg2] 2+ и Ag + .
Хлорид ртути (I) при взаимодействии с раствором гидроксида аммония образует амидохлорид ртути (I), который неустойчив и разлагается на малорастворимый амидохлорид ртути (II) и металлическую ртуть, которая придает осадку черный цвет:
Это позволяет отделить катион [Hg2] 2+ от катиона Ag + .
Хлорид серебра растворим под действием раствора гидроксида аммония с образованием комплексного соединения хлорида диамминсеребра (I):
Из выше изложенного следует, что наиболее растворимым является осадок хлорида свинца, вследствие чего он не полностью осаждается с этой группой катионов и частично остается в растворе.
Нитраты серебра, свинца и ртути (I) хорошо растворимы в воде. Растворимость сульфатов невелика и уменьшается в ряду Ag + — [Hg2] 2+ — Pb 2+ . Карбонаты и сульфиды плохо растворимы в воде. Гидроксид серебра неустойчив, ртути – не существует (только оксид), а гидроксид свинца амфотерен. Соли ртути (I) не устойчивы и склонны к реакциям диспропорционирования с выделением свободной ртути и образованием соответствующих соединений ртути (II).
Действие группового реагента HCl на катионы II аналитической группы (Ag + , Pb 2+ , [Hg2] 2+ ).
Хлороводородная кислота образует со всеми катионами II группы малорастворимые осадки белого цвета. Реакция HCl с катионами Ag + — ФАРМАКОПЕЙНАЯ. (Химизм реакции смотри выше, в общей характеристике группы).
Методика: Берут 3 пробирки. В первую помещают 3-4 капли раствора нитрата ртути (I), во вторую – 3-4 капли раствора нитрата серебра, в третью 3-4 капли раствора нитрата свинца. Во все три пробирки добавляют 3-4 капли 2моль/л раствора хлороводородной кислоты. Наблюдают образование белых осадков во всех трех пробирках. В первую и вторую пробирку добавляют (избыток) 6-8 капель раствора аммиака, в третью – 5 капель воды и нагревают.
Наблюдают за происходящими явлениями.
Аналитические реакции катиона (Ag + ).
Внимание! Соли серебра ядовиты! Работать осторожно!
1. Реакция с иодидом калия.
Иодид калия с катионом Ag + образует желтый осадок иодида серебра AgI, не растворимый в концентрированном растворе аммиака:
Методика: Помещают в пробирку 2-3 капли раствора нитрата серебра, добавляют 2-3 капли иодида калия или натрия. Наблюдают образование осадка желтого цвета.
2. Реакция с бромидом калия.
Бромид калия с катионами Ag + образует бледно- желтый осадок бромида серебра AgBr, который частично растворим в концентрированном растворе аммиака:
Методика: Помещают в пробирку 2-3 капли нитрата серебра, добавляют 2-3 капли бромида калия. Наблюдают образование осадка бледно-желтого цвета.
3. Реакция с хроматом калия.
Хромат калия с катионами Ag + в нейтральной или слабоуксусной среде образует осадок Ag2CrO4 кирпично –красного цвета:
Осадок растворяется в концентрированном растворе аммиака, в аммиачной , сильнокислой средах осадок не образуется.
Ионы Pb 2+ , Ba 2+ и др. дающие осадки с CrO4 2- , мешают проведению данной реакции.
Методика: В пробирку помещают 2-3 капли раствора нитрата серебра и добавляют 1-2 капли раствора хромата калия. Наблюдают за образованием осадка. Проверяют растворимость осадка в уксусной кислоте и концентрированном растворе аммиака.
Аналитические реакции катиона [Hg2] 2+ .
Внимание! Все соли ртути ядовиты, требуют осторожного обращения!
Легко образуют амальгамы, не допускать попадания на золотые украшения!
1. Восстановление [Hg2] 2+ до Hg хлоридом олова (П).
При действии на раствор соли ртути (I) раствором хлорида олова (II) вначале образуется белый осадок Hg2Cl2 , который при стоянии постепенно темнеет вследствие восстановления ионов [Hg2] 2+ до металлической ртути
Hg2Cl2 + Sn 2+ +2Cl — → 2Hg + Sn 4+ + 4Cl —
Ионы ртути (II) мешают определению, так как дают аналогичный эффект.
Методика: В пробирку помещают 2- 3 капли раствора нитрата ртути (I), добавляют 2-3 капли раствора хлорида олова (II). Выделяется белый осадок, который постепенно темнеет.
2. Восстановление [Hg2] 2+ ионов металлической медью.
Методика: На очищенную наждаком медную пластинку наносят каплю раствора нитрата ртути (I). Через некоторое время появляется серое пятно амальгамы, которое после удаления раствора и протирания поверхности фильтровальной бумагой остановится блестящим:
[Hg2] 2+ + Cu → Cu 2+ + 2 Hg
Соли ртути (II) дают аналогичный эффект.
3. Реакция с иодидом калия.
Иодид калия образует с катионами ртути (I) осадок Hg2I2:
Осадок растворим в избытке реактива с образованием тетраиодогидраргират (II) калия и черного осадка металлической ртути:
Методика: В пробирку помещают 2-3 капли раствора нитрата ртути (I) и добавляют 2-3 капли раствора иодида калия. Выделяется грязно-зеленый осадок Hg2I2. К полученному осадку добавляют избыток реактива. Наблюдают за происходящими явлениями.
4. Реакция с хроматом калия.
Хромат калия K2CrO4 образуют с катионами [Hg2] 2+ красный осадок хромата ртути (I), растворимый в азотной кислоте:
Методика: в пробирку помещают 2-3 капли раствора нитрата ртути (I) Hg2(NO3)2. Добавляют 2-3 капли хромата калия. Выпадает осадок красного цвета.
5. Реакция с раствором гидроксида аммония.
Нитрат ртути (I) реагирует с раствором гидроксида аммония с образованием темного осадка смеси металлической ртути и [OHg2NH2]NO3
Методика: К 2-3 каплям раствора нитрата ртути (I) помещают в пробирку, добавляют 6 капель раствора гидроксида аммония. Выпадает осадок черного цвета.
Аналитические реакции катиона Pb 2+ .
1. Реакция с серной кислотой или растворимыми сульфатами.
Серная кислота или растворимые сульфаты осаждают катионы свинца в виде белого осадка сульфата свинца. Осадок растворяется при нагревании в растворах гидроксидов щелочных металлов с образованием гидроксокомплексов:
Сульфат свинца так же растворим в 30 % растворе ацетата аммония:
Методика: В пробирку помещают 5 капель раствора нитрата свинца, добавляют равный объем раствора сульфата натрия или сульфата калия, выпадает белый осадок. Разделяют осадок на 2 части. К одной добавляют гидроксид натрия или калия, к другой – 30 % раствор ацетата аммония. Осадок в обоих случаях растворяется.
2. Реакция с хроматом калия.
Хромат калия с катионами свинца образует желтый кристаллический осадок PbCrO4, растворимый в гидроксидах щелочных металлов, но не растворимый в уксусной кислоте:
Методика: В пробирку помещают 2-3 капли раствора соли свинца, добавляют 3 капли раствора хромата калия. Выпадает желтый кристаллический осадок. Проверяют его растворимость в уксусной кислоте и гидроксиде натрия или калия.
3. Реакция с иодидом калия или натрия, реакция «золотого дождя», (ФАРМАКОПЕЙНАЯ).
Иодид натрия или калия с катионами свинца образует кристаллический осадок PbI2 желтого цвета, растворимый в избытке реактива с образованием комплексного соединения тетраиодоплюмбат (II) калия:
Pb 2+ + 2 I — → PbI2
Иодид свинца растворим в горячей воде и в уксусной кислоте. Растворимость осадка в горячей воде используют как дополнительную реакцию обнаружения катионов свинца, так как при охлаждении раствора осадок иодида свинца выпадает в виде золотистых чешуек. Реакция специфична.
Методика: В пробирку помещают 3-5 капель раствора соли нитрата свинца, добавляют 3 капли раствора иодида калия или натрия. Выпадает осадок желтого цвета. Прибавляет несколько капель воды и нагревают. Осадок растворяется. Быстро охлаждают пробирку под струей водопроводной холодной воды. Вновь выделяется осадок в виде блестящих золотистых кристаллов.
Качественные реакции на катиона II аналитической группы.
Читайте также:
|