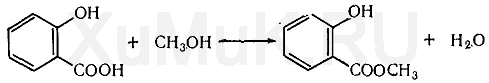Салициловая кислота. Натрия салицилат
Салициловая кислота (о-гидроксибензойная кислота) встречается в растительном мире как в свободном, так и в связанном виде во многих эфирных маслах. Салициловая кислота обладает антисептическими свойствами и находит применение как в медицине, так и в пищевой промышленности в качестве консерванта. Более широкое применение в медицине нашли производные салициловой кислоты.
Строение и свойства
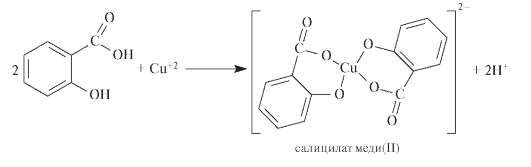
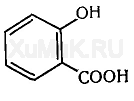
Салициловая кислота о-HOC6H4COOH представляет собой кристаллическое вещество, малорастворимое в воде. По кислотности pKa = 2,98 превосходит бензойную кислоту, нейтрализуется щелочами с образованием моно- и дизамещенных солей. Кислотные свойства обусловливают способность салициловой кислоты, в частности, вступать в реакции с кислотами Льюиса — солями тяжелых металлов (FeCl3, CuSO4, AgNO3).
Получение
В промышленности салициловую кислоту получают карбоксилированием фенола. При действии диоксида углерода на твердые феноксиды щелочных металлов образуется фенолокислота:
Механизмы действия и биотрансформация
Действие салициловой кислоты аналогично бензойной кислоте (см. выше).
Основными путями биотрансформации салициловой кислоты и ее производных является конъюгация с аминокислотами, например, конъюгат с глицином — салицилуровая кислота:
У человека до 75% дозы салициловой кислоты выводится в виде конъюгата с глицином.
Натрия салицилат относится к группе НПВС. Оказывает аналгезирующее, жаропонижающее и противовоспалительное действие, неизбирательно угнетает ЦОГ1 и ЦОГ2, снижает синтез Pg. Обезболивающий эффект обусловлен как центральным, так и периферическим действием. Воздействует на центр терморегуляции, снижает температуру тела при лихорадочных состояниях.
Контроль качества
Определение подлинности.Подлинность салициловой кислоты и натрия салицилата устанавливают ИК-спектрометрией, а также качественными реакциями на салицилат-ион и ион натрия.
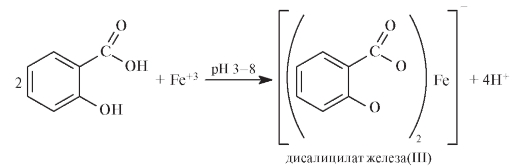
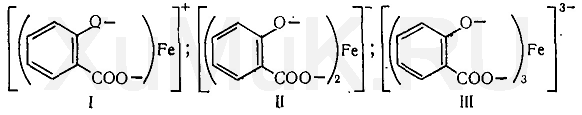
Качественной реакцией на салицилат-ион является рН-зависимая реакция с железа (Ш) хлоридом. При рН 2,0-3,0 образуется окрашенный в фиолетовый цвет моносалицилатный комплекс. При рН 3,0-8,0 образуется дисалицилат красного цвета, при рН 8,0-10,0 — трисалицилат желтого цвета.
Субстанцию салициловой кислоты массой 30 мг растворяют в 5 мл 0,05 моль/л растворе NaOH и доводят объем раствора до 20 мл водой. С реактивом FeCl3 образуется фиолетово-красное окрашивание раствора:
Прибавление к смеси HCl приводит к обесцвечиванию раствора и образованию осадка салициловой кислоты:
Разрушение комплексного иона объясняется протонированием кислотных групп в средах с рН 2 комплекс с координационным числом, равным 4:
Натрия салицилат идентифицируют аналогично соли бензойной кислоты (см. выше).
Испытания на чистоту.Допустимыми примесями в фармацевтических субстанциях салициловой кислоты и натрия салицилата являются: хлориды (не более 100 мкг/г), сульфаты (в сравнении с эталонным раствором), тяжелые металлы (не более 20 мкг/г), сульфатная зола (не более 0,1%), потеря в массе при высушивании не должна превышать 0,5%.
В субстанциях ЛВ могут обнаруживаться родственные примеси:
Примеси родственных веществ определяют методом жидкостной хроматографии с УФ-детекцией при 270 нм. Пики на хроматограммах, обнаруживаемые для испытуемого раствора, не должны быть больше пиков стандартных образцов (0,1% для 4-гидроксибензойной кислоты, 0,05% для 4-гидроксиизофталевой кислоты и 0,02% для фенола).
Количественное определение.Количественное определение салициловой кислоты проводят методом алкалиметрии. Для этого 0,120 г ЛВ растворяют в 30 мл спирта, прибавляют 20 мл воды и
титруют 0,1 моль/л раствором NaOH с индикатором феноловым красным. Окраска индикатора изменится в момент нейтрализации карбоксильной группы.
1 мл 0,1 моль/л раствора NaOH соответствует 13,81 мг C7H3O3.
При неправильном подборе кислотно-основного индикатора, например фенолфталеина, окраска индикатора засвидетельствует нейтрализацию не только карбоксильной, но и фенольной группы, объем щелочи израсходуется в два раза больше и результат будет завышенным.
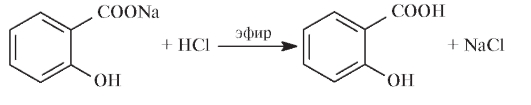
Натрия салицилат количественно определяют ацидиметрическим методом в присутствии эфира, в который экстрагируется выделяющаяся салициловая кислота.
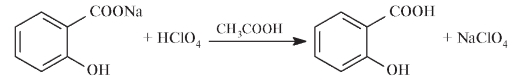
Фармакопейным методом определения натрия салицилата является также кислотно-основное титрование в среде ледяной уксусной кислоты 0,1 моль/л раствором HClO4:
1 мл 0,1 моль/л раствора HClO4 соответствует 16,010 мг
Ацетилсалициловая кислота
Ацетилсалициловая кислота — первое синтетическое лекарственное вещество и долгожитель в мире лекарственных препаратов, применяется в медицине с 1899 г.
Родоначальницу ацетилсалициловой кислоты — салициловая кислота — использовали как целебное средство со времен Гиппократа. Отвар коры ивы, содержащий салициловую кислоту (лат. salix — ива), применяли как жаропонижающее, обезболивающее и противовоспалительное средство.
Ацетилсалициловая кислота гидролизуется с образованием салициловой кислоты, поэтому их терапевтические свойства схожи. Новое ЛС было открыто и запатентовано немецкой фирмой «Bayer». В 1899 г. фирма «Bayer» запатентовала торговую марку «Аспирин». Название было дано, как полагают, в честь святого Аспиринуса — покровителя страдающих головной болью.
Строение и свойства
Ацетилсалициловая кислота — ацетилированное производное салициловой кислоты. Для нее характерны реакции кислотноосновного характера, солеобразование, обусловленные свободной карбоксильной группой, а также гидролиз по ацетилированной группе.
Получение
Ацетилсалициловую кислоту получают ацетилированием фенолокислоты уксусным ангидридом:
§ 28. САЛИЦИЛОВАЯ КИСЛОТА
Салициловая ( о -оксибензойная) кислота представляет собой белые игольчатые кристаллы или легкий кристаллический порошок без запаха. Эта кислота перегоняется с водяным паром, при осторожном нагревании она возгоняется. Растворяется в диэтиловом эфире (1 : 3), этиловом спирте (1 : 4), хлороформе (1 : 55), слабо растворяется в воде (1 : 550), легче — в кипящей воде (1 : 15).
Салициловая кислота экстрагируется органическими растворителями из кислых водных растворов.
Применение. Действие на организм. Салициловая кислота применяется в медицине для лечения кожных и других заболеваний. При более высокой концентрации (10—20%) салициловая кислота проявляет кератолитическое действие (разрыхляет и отторгает эпидермис). На этом свойстве салициловой кислоты основано применение ее в составе различных противомозольных средств. В малых концентрациях (1—2 %) салициловая кислота проявляет кератопластическое действие (способствует разрастанию эпидермиса). Салициловая кислота подавляет секрецию потовых желез. Поэтому она применяется в виде растворов и присыпок при повышенной потливости. Дезинфицирующее действие салициловой кислоты (в пастах, мазях) используется для лечения инфекционных заболеваний кожи.
Салициловая кислота применяется как консервант при изготовлении вин, овощных консервов, варенья, соков и т. д. Следует отметить, что на заводах и фабриках для консервирования салициловая кислота не применяется. Салициловая кислота в незначительных количествах содержится в вишне, малине, землянике и других ягодах как составная часть.
При поступлении салициловой кислоты внутрь наблюдается раздражение слизистой оболочки желудка, появляются боль в надчревной области, тошнота, а иногда и рвота. Поэтому салициловая кислота не применяется внутрь. Для этой цели применяются соли салициловой кислоты (салицилаты) и ее производные.
Метаболизм. Салициловая кислота частично выделяется из организма с мочой в несвязанном виде и в виде конъюгатов с глицином и с глюкуроновой кислотой. Метаболитами салициловой кислоты являются о-гидроксибензоилглюкуронид и о-карбоксифенилглюкуронид. Часть салициловой кислоты, поступившей в организм, метаболизируется путем гидроксилирования. При этом в качестве метаболитов образуются 2,3-дигидроксибензойная кислота, 2,5-дигидроксибензойная кислота и 2,3,5-тригидроксибензойная кислота. Эти метаболиты выделяются из организма с мочой.
Выделение салициловой кислоты из биологического материала. Для выделения салициловой кислоты из биологического материала применяют методы, основанные на изолировании ядовитых веществ водой, подкисленной серной или щавелевой кислотой.
Для выделения салициловой кислоты из консервов, варенья и других пищевых продуктов их настаивают с 1 %-м раствором карбоната натрия. При этом салициловая кислота превращается в растворимый салицилат натрия. Водную вытяжку отфильтровывают, подкисляют раствором серной кислоты. Образовавшуюся при этом салициловую кислоту экстрагируют органическими растворителями.
Реакция с хлоридом железа (III). От прибавления раствора хлорида железа (III) к салициловой кислоте жидкость приобретает сине-фиолетовую окраску. Состав и окраска комплексов, образующихся при взаимодействии салициловой кислоты с ионами железа, зависит от рН среды. При рН=1,8. 2,5 образуется моносалицилатный комплекс (I), имеющий сине-фиолетовую окраску. При рН = 4. 8 образуется дисалицилатный комплекс (II), имеющий красно-бурую окраску. Трисалицилатный комплекс железа (III), имеющий желтую окраску, образуется при рН = 8. 11:
Выполнение реакции. Эту реакцию можно выполнять двумя способами:
1. Несколько капель хлороформной вытяжки, содержащей салициловую кислоту, вносят в фарфоровую чашку и выпаривают досуха. К сухому остатку прибавляют каплю 1 %-го свежеприготовленного раствора хлорида железа (III). При этом появляется сине-фиолетовая окраска, не исчезающая от прибавления 2—3 капель этилового спирта.
2. На полоску фильтровальной бумаги наносят каплю 1 %-го свежеприготовленного раствора хлорида железа (III) и подсушивают. Затем на то же место наносят 1—2 капли хлороформной вытяжки, содержащей салициловую кислоту. При наличии этой кислоты в вытяжке появляется сине-фиолетовое пятно.
Выполнение реакции. Несколько капель хлороформной вытяжки вносят в пробирку. При слабом нагревании пробирки на водяной бане жидкость выпаривают досуха. К сухому остатку прибавляют 2 капли метилового спирта и 2 капли концентрированной серной кислоты. Содержимое пробирки нагревают на водяной бане. Появление характерного запаха метилсалицилата указывает на наличие салициловой кислоты в исследуемой пробе.
максимум поглощения при 300 нм, а в 0,1 н. растворе серной кислоты — при 302 нм; в ИК-области спектра салициловая кислота (диск с бромидом калия) имеет пики при 1657, 1446, 1288 и 758 см -1 .
Предварительные пробы на наличие салициловой кислоты в моче и крови. Для обнаружения салициловой кислоты в моче и крови предложены предварительные пробы, основанные на реакции с реактивом Триндлера и на реакции с нитратом железа (III).
1. К 1 мл мочи прибавляют 2—3 капли реактива Триндлера. Появление пурпурной окраски указывает на наличие салициловой кислоты в моче.
Приготовление реактива Триндлера (см. Приложение 1, реактив 41).
2. К 0,5 мл мочи или плазмы крови прибавляют 4,5 мл 0,55 %-го раствора нитрата железа (III) в 0,04 н. растворе азотной кислоты. Появление пурпурной окраски указывает на наличие салициловой кислоты в исследуемых объектах.
Определение количественного о содержания салидрозидов и исследование бактерицидных свойств отваров из коры различных сортов ивы (стр. 4 )
 | Из за большого объема этот материал размещен на нескольких страницах: 1 2 3 4 5 6 |
Уже в 1899 году первая партия этого лекарства появилась в продаже. Изначально был известен лишь жаропонижающий эффект аспирина, позднее выяснились также его болеутоляющие и противовоспалительные свойства. В первые годы аспирин продавался как порошок, а с 1904 года — в форме таблеток.
В 1983 году в медицинском журнале New England Journal of Medicine появилась публикация исследования[11], в котором было доказано новое важное свойство препарата — при его использовании во время нестабильной стенокардии уменьшается риск возникновения инфаркта миокарда.
Приложение 2. Салициловая и ацетилсалициловая кислоты: состав, строение, свойства; фармакологическое действие препаратов на их основе.
Салициловая кислота (от лат. Salix «ива», из коры которой она была впервые выделена) — 2-гидроксибензойная или фенольная кислота.
Формула: С6Н4(ОН)СООН,
Физические свойства салициловой кислоты.
Салициловая кислота представляет собой бесцветные кристаллы. Кислота является плохо растворимой в холодной воде и имеет температуру плавления tпл.=159°С.
Внутримолекулярная водородная связь в салициловой кислоте позволяет стабилизировать карбоксилат-ион, что приводит к повышению ее кислотности.
Химические свойства салициловой кислоты.
Химические свойства обусловлены: свойствами бензольного кольца; свойствами – COOH группы; свойствами фенольного гидроксила.
Химические свойства, обусловленные свойствами бензольного кольца:
Реакция с бромной водой:
Гидрирование салициловой кислоты с использованием катализатора Pt с последующим гидролизом, а также восстановление натрием в изоамиловом спирте протекает с образованием пимелиновой к-ты:
Химические свойства, обусловленные свойствами карбоксильной группы:
Реакции со щелочами:
Действие РОСl3 на смесь салициловой кислоты и фенола приводит к сложным эфирам, взаимод. С анилином в присут. РСl3-к салициланилиду:


Свойства, обусловленные свойствами фенольного гидроксила:
Качественные реакции на салициловую кислоту:
Реакция с реактивом Марки (концентрированная серная кислота + формальдегид) образуется красное окрашивание при слабом нагревании (образование ауринового красителя).
С раствором хлорида окисного железа; появляется сине-фиолетовое окрашивание, исчезающее от прибавления нескольких капель разведенной соляной кислоты и неисчезающее от прибавления нескольких капель разведенной уксусной кислоты.
Декарбоксилирование при нагревании в присутствии концентрированной серной кислоты:
Выделяющийся углекислый газ вызывает помутнение известковой воды: Ca(OH)2 + CO2 = CaCO3v + H2O
При нагревании салициловой кислоты с метиловым спиртом в присутствии серной кислоты образуется метиловый эфир салициловой кислоты (метилсалицилат):
Содержимое пробирки нагревают на водяной бане. Появление характерного запаха метилсалицилата указывает на наличие салициловой кислоты в исследуемой пробе.
Физиологическое действие салициловой кислоты.
Салициловая кислота и салицилаты, а также её сложные эфиры (метилсалицилат) и другие синтетические производные салициловой кислоты (например, ацетилсалициловая кислота — аспирин), обладают выраженным противовоспалительным действием.
Салициловая кислота вызывает повышение температуры в отдельных органах термогенных растений (в частности лилии вуду). Это происходит по причине разрыва транспорта электронов в митохондриальной дыхательной цепи. Активно изучается роль салициловой кислоты в развитии неспецифической реакции на стрессогенные факторы и накопление в клетках активных форм кислорода.
Применение салициловой кислоты. Условия хранения.
Салициловая кислота – активный компонент ивовой коры. Ещё в XIX в. её использовали для лечения ревматизма и мочекислого диатеза, а сегодня это вещество синтезируют в больших количествах, так как оно служит основой для производства многих лекарств.
Салициловая кислота обладает слабыми антисептическими, раздражающими и кератолитическими (в больших концентрациях) свойствами и применяется в медицине наружно в мазях, пастах, присыпках и растворах при лечении кожных заболеваний; входит в состав пасты Лассара, присыпки «гальманин», препаратов «мозольная жидкость» и «мозольный пластырь».
Благодаря антисептическому действию салициловую кислоту употребляют при консервировании пищевых продуктов; её используют также в производстве азокрасителей, душистых веществ (сложных эфиров салициловой кислоты), для колориметрических определения Fe и Cu, для отделения тория от других элементов.
Салициловую кислоту хранят в хорошо укупоренной упаковке, в защищённом от света месте.
Ацетилсалициловая кислота (лат. Acidum acetylsalicylicum, салициловый эфир уксусной кислоты).
Формула: C?H?O?
Температура плавления:133 – 138 0С
Белые мелкие игольчатые кристаллы или легкий кристаллический порошок, мало растворим в воде при комнатной температуре, растворим в горячей воде, легко растворим в спирте, растворах едких и углекислых щелочей.
Ацетилсалициловая кислота производится путём нагревания салициловой кислоты с уксусным ангдридом:
Ацетилсалициловая кислота при гидролизе распадается на салициловую и уксусную кислоты. Гидролиз проводят при кипячении раствора ацетилсалициловой кислоты в воде в течение 30 секунд. После охлаждения салициловая кислота, плохо растворимая в воде, выпадает в осадок в виде пушистых игольчатых кристаллов.
При нагревании с гидроксидом натрия в водном растворе ацетилсалициловая кислота гидролизуется до салицилата натрия и ацетата натрия.
Реакция обмена по карбоксильной группе.
Для этой реакции использовали питьевую соду. Реакция идет с выделением углекислого газа.
Реакция салициловой кислоты с хлоридом железа (III)
В пробирку наливают 2мл воды и добавляют несколько кристаллов салициловой кислоты. К полученному раствору приливают 2-3 капли 1%-ного раствора хлорида железа (III).
Гидролитическое разложение в присутствии кислоты или щелочи. Образующиеся продукты гидролиза идентифицируют известными реакциями.
Салицилат натрия идентифицируют после подкисления по образованию белого кристаллического осадка салициловой кислоты. Ацетат натрия – по образованию уксусноэтилового эфира, имеющего фруктовый запах. 2. Гидроксамовая реакция основана на взаимодействии сложных эфиров с гидроксиламином в щелочной среде с образованием гидроксамовых кислот и спиртов. Гидроксамовые кислоты с ионами железа и меди в кислой среде образуют окрашенные комплексные соли – гидроксаматы железа (вишневого цвета) и гидраксоматы меди (зеленого цвета).
Количественное определение 1. Алкалиметрия, вариант гидролиза, способ обратного титрования. Метод основан на щелочном гидролизе в присутствии избытка титрованного раствора натрия гидроксида, который далее оттитровывают кислотой. Гидролиз проводят на кипящей водяной бане с обратным холодильником. Параллельно проводят контрольный опыт. Индикатор – фенолфталеин. 1
Приложение 3. Фармакологическое действие лекарственных препаратов на основе салициловой и ацетилсалициловой кислот.
Фармакологические свойства. Салициловая кислота ликвидирует перифокальный воспалительные процесс, очищает от гнойного отделяемого раны и способствует их заживлению. Салициловая кислота оказывает кератопластическое (в низкой концентрации), кератолитическое (в высокой концентрации) и отвлекающее действие. Подавляет секрецию потовых и сальных желез.
Показания. В составе комбинированных средств, а также в качестве монотерапии при инфекционных, воспалительных и прочих поражениях кожи (включая и ожоги, экзему, псориаз, дискератоз, обыкновенные угри, ихтиоз, бородавки, мозоли, гиперкератоз, омозолелость, отрубевидный лишай, жирную себорею); потливость ног; выпадение волос.
Способ применения салициловой кислоты и дозы
Наружно: 2–3 раза в сутки обрабатывают спиртовым раствором пораженную поверхность. Местно: накладывают пропитанную мазью стерильную повязку или наносят на очаг поражения тонким слоем и закрывают стерильной салфеткой. До наложения повязки рану необходимо очистить от некротических тканей, вскрыть пузыри, промыть антисептическим раствором. 1 раз в 2–3 дня проводят смену повязки до полного очищения раны от гнойно-некротических масс. Продолжительность курса терапии составляет 6–20 суток. Количество мази, используемое на одну повязку, зависти от площади раны и составляет примерно на 1 см2 раневой поверхности 0,2 г.
http://xumuk.ru/toxicchem/87.html
http://pandia.ru/text/82/093/46436-4.php