Сульфат натрия: способы получения и химические свойства
Сульфат натрия — соль щелочного металла натрия и серной кислоты. Белый. Плавится и кипит без разложения. Хорошо растворяется в воде (гидролиз не идет).
Относительная молекулярная масса Mr = 142,04; относительная плотность для тв. и ж. состояния d = 2,66; tпл = 884º C; tкип = 1430º C.
Способ получения
1. В результате взаимодействия разбавленной серной кислоты и гидроксида натрия образуется сульфат натрия и вода:
2. При температуре 450–800º C гидросульфат натрия реагирует с хлоридом натрия. В результате реакции образуется сульфат натрия и хлороводородная кислота:
NaHSO4 + NaCl = Na2SO4 + HCl
3. В состоянии кипения в результате реакции между твердым хлоридом натрия и концентрированной серной кислотой происходит образование сульфата натрия и газа хлороводорода:
4. Твердый сульфид натрия и кислород взаимодействуют при температуре выше 400º C с образованием сульфата натрия:
5. При взаимодействии концентрированного раствора пероксида водорода и сульфида натрия образуется сульфат натрия и вода:
Качественная реакция
Качественная реакция на сульфат натрия — взаимодействие его с хлоридом бария, в результате реакции происходит образование белого осадка , который не растворим в азотной кислоте:
1. При взаимодействии с хлоридом бария , сульфат натрия образует сульфат бария и хлорид натрия:
Химические свойства
1. Сульфат натрия может реагировать с простыми веществами :
1.1. Сульфат натрия реагирует со фтором при температуре 100–150º C. При этом образуются фторид натрия, сульфурилфторид и кислород:
1.2. С водородом сульфат натрия реагирует при температуре 550–600º C, в присутствии катализатора Fe2O3 с образованием сульфида натрия и воды:
2. Сульфат натрия вступает в реакцию со многими сложными веществами :
2.1. Сульфат натрия реагирует с гидроксидом бария с образованием гидроксида натрия и сульфата бария:
2.2. При взаимодействии с концентрированной серной кислотой твердый сульфат натрия образует гидросульфат натрия:
2.3. Сульфат натрия реагирует с оксидом серы (VI) . Взаимодействие сульфата натрия с оксидом серы (VI) приводит к образованию пиросульфата натрия:
2.4. Сульфат натрия взаимодействует с хлоридом бария . При этом образуются хлорид натрия и сульфат бария:
Please wait.
We are checking your browser. gomolog.ru
Why do I have to complete a CAPTCHA?
Completing the CAPTCHA proves you are a human and gives you temporary access to the web property.
What can I do to prevent this in the future?
If you are on a personal connection, like at home, you can run an anti-virus scan on your device to make sure it is not infected with malware.
If you are at an office or shared network, you can ask the network administrator to run a scan across the network looking for misconfigured or infected devices.
Another way to prevent getting this page in the future is to use Privacy Pass. You may need to download version 2.0 now from the Chrome Web Store.
Cloudflare Ray ID: 6e0b57db3df04971 • Your IP : 85.95.188.35 • Performance & security by Cloudflare
Сульфаты. Качественная реакция на сульфат- ион
Реактивом на сульфат-ион является хлорид бария.
Хлорид бария BaCl2 осаждает из разбавленных растворов сульфатов белый кристаллический ни в чем нерастворимый осадок сульфата бария:
Техника выполнения: к 2 каплям раствора сульфата натрия Na2SO4 добавляют раствор хлорида бария BaCl2 и наблюдают выпадение осадка.
Выводы :
1.Реактивом на сульфат-ион является хлорид бария.
2.Хлорид бария BaCl2 осаждает из разбавленных растворов сульфатов белый кристаллический ни в чем нерастворимый осадок сульфата бария.
IV. СУЛЬФАТЫ. ПРИМЕНЕНИЕ В МЕДИЦИНЕ.
1. Бария сульфат для рентгеноскопии — применяют внутрь в виде суспензии, в воде как контрастное средство при рентгенологическом исследовании пищевода, желудка и кишечника.
2. Меди сульфат,CuSO4 • 5Н2О. Применяют иногда как антисептическое и
вяжущее средство в виде 0,25% раствора при конъюнктивитах, иногда для промывания при уретритах и вагинитах.
При ожогах кожи фосфором обильно смачивают обожжённый участок 5% раствором меди сульфата.
Меди сульфат входит в состав комплексных поливитаминных препаратов: таблеток «Квадевит», «Глуталивит», «Олиговит», «Компливит».
Малые дозы меди сульфата назначают иногда для усиления эритропоэза при анемиях.
Имеются данные об эффективности меди сульфата при лечении больных
3. Натрия сульфат Nа2SO4 •10 Н2О (глауберова соль). Назначают внутрь в качестве слабительного средства (при пищевых отравлениях).
4. Магния сульфат MgSO4• 7Н2О (горькая соль). Используют в качестве слабительного (внутрь), желчегонного средства (внутрь или дуоденально, т.е. введение через зонд теплого раствора (зондирование).
Как спазмолитическое (и в некоторой степени антигипертензивное) средство при лечении ранних стадий гипертонической болезни, вводят в/м.
При обезболивании родов вводят в/м, иногда в комбинации с анальгизирующими средствами.
При судорогах вводят в/м.
Применяют также в качестве антидота при отравлениях солями бария (промывают желудок 1% раствором, MgSO4 или дают внутрь 20-25г в стакане воды), при отравлении Hg, As ,тетраэтилсвинцом, вводят в/в.
5. Железа закисного сульфат FeSO4 • 7Н2О (сульфат железа II)
Для профилактики и лечения железодефицитных анемий.
FeSO4 в чистом виде применяется редко, но он является частью ряда железосодержащих комплексных препаратов (поливитаминные препараты «Глуталевит», «Компливит», «Олиговит»)
6. Цинка сульфат ZnSO4 • 7Н2О применяют как антисептическое и вяжущее средство при конъюнктивитах, хроническом катаральном ларингите, для спринцеваний при уретритах и вагинитах. Редко внутрь как рвотное средство.
7. Квасцы KAl(SO4)2• 12 H2O (алюмокалиевые квасцы). Применяют наружно в качестве вяжущего средства в водных растворах (0,5-1%) для полосканий, спринцеваний, промываний, примочек при воспалительных заболеваниях кожи слизистых оболочек. Назначают также в виде карандашей для прижиганий
при трахоме и как кровоостанавливающее средство при порезах (при бритье).
Выводы :
1. Бария сульфат для рентгеноскопии
2. Меди сульфат,CuSO4 • 5Н2О. Применяют иногда как антисептическое и
3. Натрия сульфат Nа2SO4 •10 Н2О (глауберова соль). Назначают внутрь в качестве слабительного средства (при пищевых отравлениях).
4. Магния сульфат MgSO4• 7Н2О (горькая соль). Используют в качестве слабительного (внутрь), желчегонного средства (внутрь или дуоденально, т.е. введение через зонд теплого раствора (зондирование).
5. Железа закисного сульфат FeSO4 • 7Н2О (сульфат железа II)
Для профилактики и лечения железодефицитных анемий.
6. Цинка сульфат ZnSO4 • 7Н2О применяют как антисептическое и вяжущее средство при конъюнктивитах, хроническом катаральном ларингите, для спринцеваний при уретритах и вагинитах. Редко внутрь как рвотное средство.
V. TИOCEPHAЯ КИСЛОТА. ТИОСУЛЬФАТЫ.
КАЧЕСТВЕННЫЕ РЕАКЦИИ.
Если в кислородной кислоте часть атомов кислорода, или весь кислород заменить серой, то полученная кислота называется тиокислотой, а ее соли — тиосолью.
Тиосерную (серноватистую) кислоту можно рассматривать как серную кислоту, в молекулу которой один атом кислорода замещен серой:

+6 +6
S S
-2 -2
HO S H — S O
Какая из них более правильна пока не ясно. Атомы серы в Н2S2О3 имеют разную степень окисления + 6 и — 2. Это следует учитывать при составлении уравнений реакций, протекающих с участием ее солей.
По силе серноватистая кислота близка к серной, но сама она неустойчива (распадается на сернистую кислоту и серу). Многие ее соли
(из которых известны лишь средние) вполне устойчивы. Как правило, они бесцветны и хорошо растворимы в воде.
Наибольшее значение имеет Na2S2O3 • 5 H2O (т.е. гипосульфит натрия) тиосульфат натрия — Na2S2O3 • 5 H2O
Na — O OЗа счет атома S -2 проявляет сильные
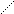
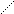

S




Na — S O
Слабый окислитель йод окисляет тиосульфат натрия до тетратионата
натрия. Na2S4O6 .Эта реакция находит широкое применение в аналитической химии, т.к. является основой одного из важнейших методов объемного анализа, называемого йодометрией.




Na — O O Na-O O

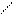
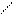

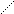
S S


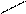



Na — S O S O






http://gomolog.ru/reshebniki/9-klass/rudzitis-i-feldman-2019/lab/kachestvennaya-reakciya-na-sulfat-iony.html
http://lektsii.org/9-63522.html