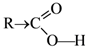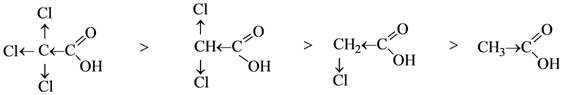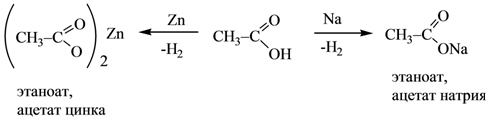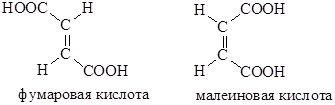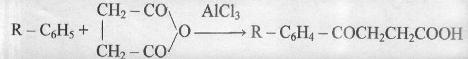Специфические реакции дикарбоновых кислот
1.Реакция декарбоксилирования при нагревании щавелевой и малоновой кислот
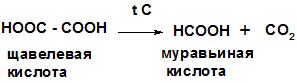 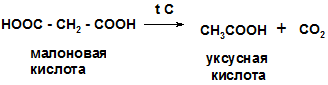 |

Влияние заместителей на величину кислотности.
. Донорные группыувеличивают прочность связи кислород-водород, что приводит к уменьшению силы кислот (к увеличению значения рКа).
рКа 3,75 4,76 4,86
2. Акцепторные группы уменьшают электронную плотность связи кислород-водород, это приводит к увеличению их силы (уменьшению значения рКа).
19. Непредельные карбоновые кислоты: акриловая, фумаровая, малеиновая. Характерные свойства. Сравнительная кислотность дикарбоновых кислот на примере щавелевой и малоновой кислоты. Реакция замещения атома водорода в малоновом эфире. (+сама)
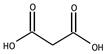
Ненасыщенные карбоновые кислоты содержат в углеводородной цепи одну или несколько двойных или тройных связей. Полимеризацией сложных эфиров и нитрилов этих кислот получают пластмассы, пленкообразующие и связующие вещества. Ненасыщенные карбоновые кислоты вступают в реакции, характерные для карбоксильной группы и для двойных связей. Как карбоновые кислоты они образуют сложные эфиры и другие производные. В живом мире они в основном встречаются в виде сложных эфиров глицерина (триацилглицерины), т.е. в виде жидких масел.
АКРИЛОВАЯКИСЛОТА (пропеновая к-та, этиленкарбоновая к-та) СН2=СНСООН, мол. м. 72,06; бесцв. жидкость с резким запахом;
Акриловая кислота обладает химическими свойствами, присущими карбоновым кислотам: образует соли, хлорангидриды, ангидриды, сложные эфиры. амиды и пр. Она также вступает в реакции присоединения, характерные для этиленовых углеводородов. При действии амальгамы Na в водном растворе и гидрировании в жидкой фазе в присутствии Ni, Pt, Pd акриловая кислота превращается в пропионовую кислоту, в среде ДМСО гидродимеризуется. Присоединение протонных кислот, воды и NH3 происходит против правила Марковникова с образованием 
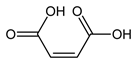
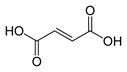
Малеиновая кислота — органическое соединение с формулой HOOC-CH=CH-COOH. Название по номенклатуре — цис-бутендиовая кислота. Её транс-изомером является фумаровая кислота. Наиболее часто она используется для получения фумаровой кислоты.
(хим свойства смотри в учебнике и тетради)
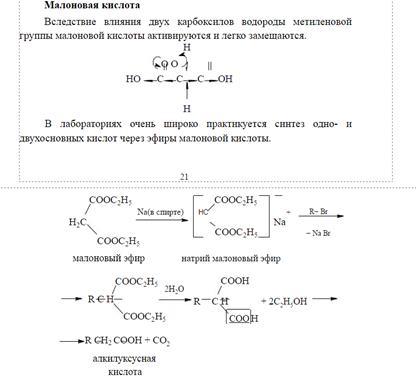
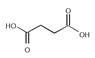
. Реакции эфиров малоновой кислоты и синтезы с малоновым эфиром. В средних эфирах малоновой кислотыатомы водорода группы СН2 способны замещаться на металлы. Так, при действии натрия на этиловый эфир малоновой кислоты (обыкновенно называемый просто малоновым эфиром) можно получить продукты замещения одного или двух атомов водорода на атомы натрия, натриймалоновый эфир CHNa(COOC2H5)2 и динатриймалоновый эфир CNa2(COOC2H5)2 В однозамещенных производных малонового эфира типа R—СН(СООС2Н5)2 может замещаться на натрий лишь один атом водорода с образованием соединений R—CNa(COOC2H5)2. Двузамещенные производные типа R2C(COOC2H5)2 совершенно не способны к замещению водорода на натрий.
Способность малонового эфира давать металлические производные позволяет синтезировать при его помощи многочисленные кислоты различной основности.
Металлическим производным малоновых эфиров придают строение енолятов (аналогично производным ацетилацетона):
Непредельные карбоновые кислоты акриловая, фумаровая, малеинова . Характерные свойства. Сравнительная кислотность дикарбоновых кислот на примере щавелевой и малоновой кислоты. Реакции замещения атома водорода в малоновом эфире сама
Формула акриловой кислоты выглядит следующим образом: СН2 = СН — СООН. Жидкость легко реагирует с мономерами, при этом образуются сополимеры.
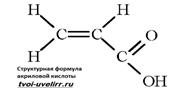
Акриловая кислота образует соли, хлорангидрид, ангидриды, сложные эфиры, амиды и пр. Она вступает в реакции присоединения, характерные для этиленовых углеводородов. При действии амальгамы натрия в водном растворе и гидрировании в жидкой фазе в присутствии Ni, Pt, Pd в пропионовую кислоту. Присоединение протонных кислот, воды и NH3 происходит против правила Марковникова с образованием замещённых производных. Как диенофил акриловая кислота участвует в диеновом синтезе. Конденсируется с солями арилдиазония (реакция Меервейна):
При УФ-облучении или в кислых водных растворах (рН = 1), а также в присутствии инициаторов полимеризации образует полиакриловую кислоту ([−СН2−СН(СООН)−]n).
Малоновая
Фумаровая кислота
Фумарат является интермедиатом в цикле Кребса. Он образуется при окислении сукцината ферментом сукцинатдегидрогеназой и далее превращается в малат ферментом фумаразой. Кожа человека образует фумарат при действии солнечного света.
Фумарат также является побочным продуктом цикла мочевины.
Впервые фумаровая кислота была получена из янтарной кислоты [1] . Традиционный метод синтеза включает в себя стадии окисления фурфурола хлоратом натрия в присутствии ванадиевого катализатора [2] . В настоящее время промышленный синтез фумаровой кислоты осуществляется путём каталитической изомеризации малеиновой кислоты в водных растворах [3] .
Эфиры фумаровой кислоты применяют для лечения псориаза, дневная доза 60-105 мг, и повышается до 1300 мг в день. Натриевая соль фумаровой кислоты входит в состав препаратов конфумин и мафусол.
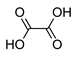
Дикарбоновые кислоты (?)
дикарбоновыми кислотами называют производные углеводородов, содержащие в своем составе две карбоксильные группы.
Имея в своем составе две карбоксильные группы, дикарбоновые кислоты диссоциируют ступенчато, образуя анион (рКа1) и дианион (рХа2).
Высокая кислотность по первой ступени объясняется влиянием второй карбоксильной группы, которая способствует делока-лизации образующегося отрицательного заряда карбоксилат-иона и тем самым повышает его устойчивость. По мере удаления карбоксильных групп друг от друга ослабевает их взаимное влияние, и кислотность по первой ступени падает. Отрыв протона от второй карбоксильной группы происходит труднее вследствие низкой стабильности дианиона, поэтому кислотность дикарбоновых кислот по второй ступени значительно ниже, чем по первой.
При максимальном удалении карбоксильных групп взаимное влияние ослабевает, и через 5—6 связей каждая из них ведет себя независимо.
По химическим свойствам дикарбоновые кислоты так же, как и монокарбоновые, способны образовывать одни и те же функциональные производные. Только в зависимости от того, одна или две карбоксильные группы участвуют в реакции, получают кислые или средние соли, полные и неполные эфиры, галогенангид-риды, амиды и др.
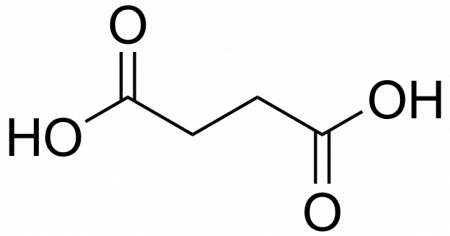
Янтарная кислота
| Янтарная кислота | |
|---|---|
 | |
| Хим. формула | C4H6O4 |
| Рац. формула | HOOC-CH2-CH2-COOH |
| Молярная масса | 118.09 г/моль |
| Температура | |
| • плавления | 183 |
| ГОСТ | ГОСТ 6341-75 |
| Рег. номер CAS | 110-15-6 |
| PubChem | 1110 |
| Рег. номер EINECS | 203-740-4 |
| SMILES | |
| Кодекс Алиментариус | E363 |
| ChEBI | 15741 |
| ChemSpider | 1078 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Янтарная кислота (бутандиовая кислота, этан-1,2-дикарбоновая кислота) — двухосновная предельная карбоновая кислота. Бесцветные кристаллы, растворимые в воде и спирте. Содержится в небольших количествах во многих растениях, янтаре. Стимулирует рост и повышает урожай растений, ускоряет развитие кукурузы. В промышленности янтарную кислоту получают главным образом гидрированием малеинового ангидрида.
Впервые получена в XVII веке перегонкой янтаря. Соли и эфиры янтарной кислоты называются сукцинатами (лат. succinum — янтарь).
Содержание
- 1 Свойства
- 1.1 Органолептические
- 1.2 Физические
- 1.3 Химические
- 2 Биохимическая роль
- 3 Применение
- 3.1 В медицине
Свойства
Органолептические
Янтарная кислота представляет из себя белые кристаллы, обладающие слабокислым и слегка солоновато-горьким привкусом.
Физические
Температура плавления 183 градуса. Выше 235 °C отщепляет H2O и переходит в янтарный ангидрид. Янтарная кислота легко возгоняется при 130—140 °С. Растворимость в воде (граммов в 100 г воды): 6,8 (при 20 °С), 121 (при 100 °С). Также растворяется в этиловом спирте: 9,9 (5 °С); в диэтиловом эфире — 1,2 (при 15 °С). Нерастворима кислота в бензоле, бензине, хлороформе. Константы диссоциации таковы: Ka1 = 7,4*10 −5 , Ka2 = 4,5*10 −6 .
Химические
Метиленовые группы янтарной кислоты обладают высокой реакционной способностью, что связано с влиянием карбоксильных групп. При бромировании янтарная кислота даёт дибромянтарную кислоту HOOC—(CHBr)2—COOH. Диэфиры янтарной кислоты конденсируются с кетонами (конденсация Штоббе) и с альдегидами.
С аммиаком и аминами янтарная кислота образует сукцинимид и его N-замещённые аналоги (R-H, алкильная или арильная группа). Моно- и диамиды янтарной кислоты, получаемые с ароматическими и гетероциклическими аминами, применяют для синтеза некоторых красителей, инсектицидов и лекарственных веществ.
Янтарная кислота и её ангидрид легко вступают в реакцию Фриделя-Крафтса с ароматическими соединениями (так называемое сукцинилирование), образуя производные 4-арил-4-кетомасляной кислоты.
Биохимическая роль
Янтарная кислота участвует в процессе клеточного дыхания кислорододышащих организмов (см. Цикл трикарбоновых кислот).
Летальные дозы (LD50): орально — 2,26 г/кг (крысы), внутривенно — 1,4 г/кг (мыши). ПДК в воде водоёмов 0,01 мг/л
Применение
Янтарная кислота используется в аналитической химии, а также в химическом синтезе для получения пластмасс, смол и лекарственных препаратов.
В пищевой промышленности используется в качестве подкислителя, известна также как пищевая добавка E363.
В медицине
В лекарственных препаратах янтарная кислота применяется в качестве активного вещества как метаболическое средство, улучшающее метаболизм и энергообеспечение тканей, уменьшающее гипоксию тканей.
При воздействии сукцината и гиалуроновой кислоты на клетки кожи достигается омолаживающий эффект редермализации.
Качественная реакция на янтарную кислоту уравнение реакции
Янтарная кислота НООССН 2 СН 2 СООН (этан- 1, 2 дикарбоновая кислота) — третий член гомологического ряда двухосновных предельных кислот. Внешний вид — бесцветные кристаллы; температура плавления 183 градуса. Выше 235- ти по Цельсию отщепляет Н 2 О и переходит в янтарный ангидрид. Янтарная кислота легко возгоняется при 130-140 ° С.
Растворимость в воде следующая (граммов в 100 г. воды): 6, 8 ( при 20 ° С), 121 ( при 100). Также растворяется в спирте: 9, 9 (5 ° С); в эфире — 1, 2 ( при 15 ° С). Нерастворима кислота в бензоле, бензине, хлороформе. Константы диссоциации таковы: К 1 = 7, 4 . 10 -5 , К 2 = 4, 5 . 10 -6 .
Метиленовые группы янтарной кислоты обладают высокой реакционной способностью, что связано с влиянием карбоксильных групп. При бромировании янтарная кислота даёт дибромянтарную кислоту HOOC — (CHBr) 2 — COOH . Диэфиры янтарной кислоты конденсируются с кетонами (Штоббе конденсация) и с альдегидами.
С аммиаком и аминами янтарная кислота образует сукцинимид и его N- замещённые аналоги (см. рис.) ( R-H , алкильная или арильная группа). Моно– и диамиды янтарной кислоты, получаемые с ароматическими и гетероциклическими аминами, применяют для синтеза некоторых красителей, инсектицидов и лекарственных веществ.
Янтарная кислота и её ангидрид легко вступают в реакцию Фриделя-Крафтса с ароматическими соединениями (так называемое сукциноилирование), образуя производные 4- арил- 4- кетомасляной кислоты (см. рис.).
Янтарная кислота содержится в незначительном количестве в буром угле и различных смолах и в янтаре , найдена во многих растениях. В промышленности её получают обычно гидрированием малеинового ангидрида или фумаровой кислоты, а также другими методами.
Янтарную кислоту используют для получения некоторых пластмасс, эластомеров, полиэфирных и алкидных смол, а также для синтеза полиядерных ароматических углеводородов, мышьяк– и ртутьсодержащих лекарственных препаратов и в аналитической химии.
Янтарную кислоту также используют как удобрение. Она ускоряет созревание плодов, повышает урожайность, увеличивает содержание витаминов и сахара в плодах. Повышает холодостойкость, засухоустойчивость и сопротивляемость к заболеваниям. Применение таково: растворить 2 г. янтарной кислоты при комнатной температуре в 1-2 литрах воды и замочить семена в течение суток, столько же держать в растворе черенки для улучшения корнеобразования. Растения, которые уже высажены в грунт, опрыскивают на 7-10- й день раствором: 2 г. на 20 л. воды. Плодоносящие насаждения опрыскивают до и после цветения и перед созреванием плодов. Картофель увлажняют перед посадкой, ботву опрыскивают перед цветением.
Янтарная кислота в качестве инсектицида. |
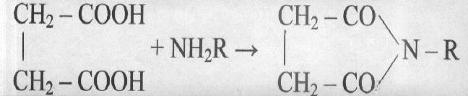
С аммиаком и аминами янтарная кислота образует сукцинимид и его N- замещённые аналоги. Янтарная кислота и её ангидрид легко вступают в реакцию Фриделя-Крафтса с ароматическими соединениями (так называемое сукциноилирование), образуя производные 4- арил- 4- кетомасляной кислоты. источники: http://chem.ru/jantarnaja-kislota.html http://www.cniga.com.ua/index.files/succinicacid.htm |