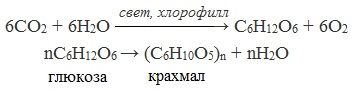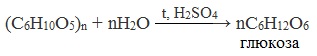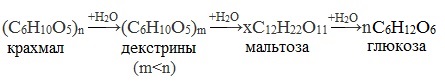КАЧЕСТВЕННЫЕ РЕАКЦИИ НА ХЛОРИД-, БРОМИД-, ЙОДИД-ИОНЫ.
ЙОД МОЛЕКУЛЯРНЫЙ.
а) на хлорид-ион – действие раствора нитрата серебра → образуется белый творожистый осадок хлорида серебра:
Осадок нерастворим в азотной кислоте, но легко растворим в аммиаке с образованием комплексного соединения:
хлорид диаммин серебра
При прибавлении к раствору хлорида диаммина серебра концентрированной серной кислоты осадок снова выделяется:
Реакция является фармакопейной.
AgCl – также растворим в тиосульфате натрия.
Т.В.: к 2 каплям раствора NaCl прибавляют 2 капли раствора AgNO3.
К раствору с выпавшим осадком прибавляют концентрированный раствор аммиака до полного растворения осадка. Полученный раствор подкисляют концентрированной азотной кислотой и наблюдают выпадение осадка.
1) действие нитрата серебра → желтовато-белый осадок бромида серебра:
Осадок не растворяется в HNO3, плохо растворим в аммиаке в отличие от хлорида серебра и хорошо растворяется в растворе тиосульфата натрия.
Реакция является фармакопейной.
Т.В.: К 4 каплям раствора NaBr прибавляют 4 капли раствора AgNO3. Раствор с осадком делят на две части. К одной части прибавляют раствор тиосульфата натрия, а к другой – концентрированный раствор аммиака и сравнивают растворение осадка AgBr в этих реактивах.
2) с хлорной водой
Хлорная вода, прибавленная к раствору бромида, выделяет из него свободный бром, который растворяется в сероуглероде или хлороформе, окрашивая слой растворителя в оранжевый цвет:
Cl2 + 2 NaBr = 2 NaCl + Br2
При большом избытке хлорной воды окраска исчезает вследствие образования BrCl, имеющего более светлую окраску.
Т.В. К 5 каплям раствора NaBr прибавляют 1 мл хлороформа, 1-2 капли разбавленной H2SO4 и затем по каплям, при энергичном встряхивании 2-3 капли хлорной воды. Наблюдается окрашивание слоя хлороформа.
1) нитрат серебра выделяет из иодидов светло-желтый творожистый осадок серебра:
Осадок не растворяется в азотной кислоте и растворе аммиака и плохо растворяется в растворе тиосульфата натрия.
Реакция является фармакопейной.
Т.В.: К раствору KI прибавляют немного раствора AgNO3. Проверяют растворение выпавшего осадка в растворе натрия тиосульфата.
2) Хлорная вода выделяет из растворов иодидов свободный йод, который окрашивает сероуглерод или хлороформ в красновато-фиолетовый цвет, а раствор крахмала – в синий.
Т.В.: К 5 каплям раствора NI (KI) прибавить 1 мл хлороформа, 2-3 капли разбавленной H2SO4 и затем по каплям, при энергичном взбалтывании 2-3 капли хлорной воды. Наблюдают окрашивание слоя хлороформа в красновато-фиолетовый цвет. В другую пробирку наливают 1 каплю раствора KI, 1 каплю хлорной воды и 2 капли раствора крахмала. Наблюдают изменение окраски.
3) Хлорид железа (III), конц. H2SO4 и некоторые другие окислители окисляют ион I — до свободного йода; например:
2 FeCl3 + 2 KI = 2 FeCl2 + 2 KCl + I2
Реакция является фармакопейной.
Т.В.: На фильтровальную бумагу в одном месте последовательно по 1 капле наносят растворы KI, HCl, FeCl3. Наблюдают появление бурого пятна, синеющего от капли крахмала.
г) На йод молекулярный → действие крахмала → синее окрашивание.
Выводы: а) на хлорид-ион – действие раствора нитрата серебра → образуется белый творожистый осадок хлорида серебра:
Осадок нерастворим в азотной кислоте, но легко растворим в аммиаке с образованием комплексного соединения:
хлорид диаммин серебра
При прибавлении к раствору хлорида диаммина серебра концентрированной серной кислоты осадок снова выделяется:
Реакция является фармакопейной.
AgCl – также растворим в тиосульфате натрия.
Т.В.: к 2 каплям раствора NaCl прибавляют 2 капли раствора AgNO3.
К раствору с выпавшим осадком прибавляют концентрированный раствор аммиака до полного растворения осадка. Полученный раствор подкисляют концентрированной азотной кислотой и наблюдают выпадение осадка.
1) действие нитрата серебра → желтовато-белый осадок бромида серебра:
Осадок не растворяется в HNO3, плохо растворим в аммиаке в отличие от хлорида серебра и хорошо растворяется в растворе тиосульфата натрия.
Реакция является фармакопейной.
Т.В.: К 4 каплям раствора NaBr прибавляют 4 капли раствора AgNO3. Раствор с осадком делят на две части. К одной части прибавляют раствор тиосульфата натрия, а к другой – концентрированный раствор аммиака и сравнивают растворение осадка AgBr в этих реактивах.
2) с хлорной водой
Хлорная вода, прибавленная к раствору бромида, выделяет из него свободный бром, который растворяется в сероуглероде или хлороформе, окрашивая слой растворителя в оранжевый цвет:
Cl2 + 2 NaBr = 2 NaCl + Br2
При большом избытке хлорной воды окраска исчезает вследствие образования BrCl, имеющего более светлую окраску.
Т.В. К 5 каплям раствора NaBr прибавляют 1 мл хлороформа, 1-2 капли разбавленной H2SO4 и затем по каплям, при энергичном встряхивании 2-3 капли хлорной воды. Наблюдается окрашивание слоя хлороформа.
1) нитрат серебра выделяет из иодидов светло-желтый творожистый осадок серебра:
Осадок не растворяется в азотной кислоте и растворе аммиака и плохо растворяется в растворе тиосульфата натрия.
Реакция является фармакопейной.
Т.В.: К раствору KI прибавляют немного раствора AgNO3. Проверяют растворение выпавшего осадка в растворе натрия тиосульфата.
2) Хлорная вода выделяет из растворов иодидов свободный йод, который окрашивает сероуглерод или хлороформ в красновато-фиолетовый цвет, а раствор крахмала – в синий.
Т.В.: К 5 каплям раствора NI (KI) прибавить 1 мл хлороформа, 2-3 капли разбавленной H2SO4 и затем по каплям, при энергичном взбалтывании 2-3 капли хлорной воды. Наблюдают окрашивание слоя хлороформа в красновато-фиолетовый цвет. В другую пробирку наливают 1 каплю раствора KI, 1 каплю хлорной воды и 2 капли раствора крахмала. Наблюдают изменение окраски.
3) Хлорид железа (III), конц. H2SO4 и некоторые другие окислители окисляют ион I — до свободного йода; например:
2 FeCl3 + 2 KI = 2 FeCl2 + 2 KCl + I2
Реакция является фармакопейной.
Т.В.: На фильтровальную бумагу в одном месте последовательно по 1 капле наносят растворы KI, HCl, FeCl3. Наблюдают появление бурого пятна, синеющего от капли крахмала.
г) На йод молекулярный → действие крахмала → синее окрашивание.
а)на хлорид-ион – действие раствора нитрата серебра → образуется белый творожистый осадок хлорида серебра;осадок нерастворим в азотной кислоте, но легко растворим в аммиаке с образованием комплексного соединения хлориддиаммин серебра.
При прибавлении к раствору хлориддиаммина серебра концентрированной серной кислоты осадок снова выделяется:
Реакция является фармакопейной.
1) действие нитрата серебра → желтовато-белый осадок бромида серебра;осадок не растворяется в HNO3, плохо растворим в аммиаке в отличие от хлорида серебра и хорошо растворяется в растворе тиосульфата натрия.
Реакция является фармакопейной.
2) с хлорной водой
Хлорная вода, прибавленная к раствору бромида, выделяет из него свободный бром, который растворяется в сероуглероде или хлороформе, окрашивая слой растворителя в оранжевый цвет.
1) нитрат серебра выделяет из иодидов светло-желтый творожистый осадок серебра.
Осадок не растворяется в азотной кислоте и растворе аммиака и плохо растворяется в растворе тиосульфата натрия.
Реакция является фармакопейной.
2) Хлорная вода выделяет из растворов иодидов свободный йод, который окрашивает сероуглерод или хлороформ в красновато-фиолетовый цвет, а раствор крахмала – в синий.
3) Хлорид железа (III) окисляет ион I — до свободного йода;
Реакция является фармакопейной.
г) На йод молекулярный → действие крахмала → синее окрашивание.
Качественная реакция с йодом уравнение
Крахмал – ценный питательный продукт. Он входит в состав хлеба, картофеля, круп и наряду с сахарозой является важнейшим источником углеводов в человеческом организме.
Химическая формула крахмала (С6(Н2О)5) n .
Строение крахмала
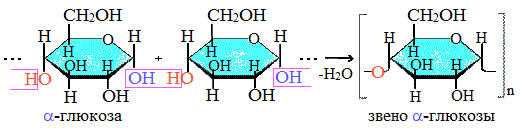
Крахмал состоит из 2 полисахаридов, построенных из остатков циклической a-глюкозы.
Как видно, соединение молекул глюкозы происходит с участием наиболее реакционноспособных гидроксильных групп, а исчезновение последних исключает возможность образования альдегидных групп, и они в молекуле крахмала отсутствуют. Поэтому крахмал не дает реакцию «серебряного зеркала».
Крахмал состоит не только из линейных молекул, но и из молекул разветвленной структуры. Этим объясняется зернистое строение крахмала.
В состав крахмала входят:
- амилоза (внутренняя часть крахмального зерна) — 10-20%;
- амилопектин (оболочка крахмального зерна) — 80-90%.
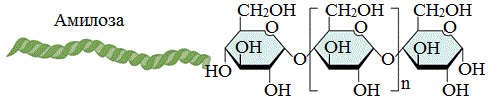
Амилоза
Амилоза растворима в воде и представляет собой линейный полимер, в котором остатки α–глюкозы связаны друг с другом через первый и четвертый атомы углерода (α-1,4-гликозидными связями).
Цепь амилозы включает 200 — 1000 остатков a-глюкозы (средняя мол. масса 160 000) .
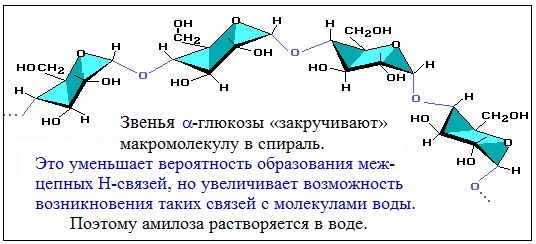
Макромолекула амилозы представляет собой спираль, каждый виток которой состоит из 6 звеньев a-глюкозы.
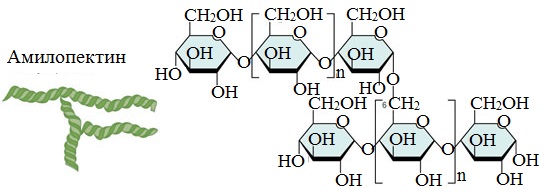
Амилопектин
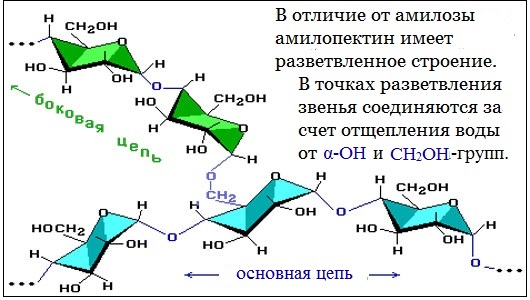
В отличие от амилозы, амилопектин не растворим в воде, и имеет разветвленное строение.
Подавляющее большинство глюкозных остатков в амилопектине связаны, как и в амилозе α-1,4-гликозидными связями. Однако в точках разветвлений цепи имеются α-1,6-гликозидные связи.
Молекулярная масса амилопектина достигает 1-6 млн.
Молекулы амилопектина также довольно компактны, так как имеют сферическую форму.
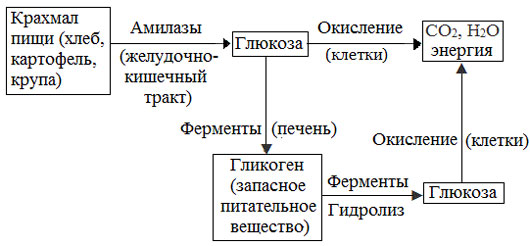
Биологическая роль крахмала. Гликоген
Крахмал – главное запасное питательное вещество растений, основной источник резервной энергии в растительных клетках.
Остатки глюкозы в молекулах крахмала соединены достаточно прочно и в то же время под действием ферментов легко могут отщепляться, как только возникает потребность в источнике энергии.
Амилоза и амилопектин гидролизуются под действием кислот или ферментов до глюкозы, которая служит непосредственным источником энергии для клеточных реакций, входит в состав крови и тканей, участвует в обменных процессах.
Гликоген (животный крахмал) – полисахарид, молекулы которого построены из большого числа остатков α–глюкозы. Он имеет сходное строение с амилопектином, но отличается от него большей разветвленностью цепей, а также большей молекулярной массой.
Содержится гликоген главным образом в печени и в мышцах.
Гликоген – белый аморфный порошок, хорошо растворяется даже в холодной воде, легко гидролизуется под действием кислот и ферментов, образуя в качестве промежуточных веществ декстрины, мальтозу и при полном гидролизе – глюкозу.
Превращение крахмала в организме человека и животных
Нахождение в природе
Крахмал широко распространен в природе. Он образуется в растениях в процессе фотосинтезе и накапливается в клубнях, корнях, семенах, а также в листьях и стеблях.
Крахмал содержится в растениях в виде крахмальных зерен. Наиболее богато крахмалом зерно злаков: риса (до 80%), пшеницы (до 70%), кукурузы (до 72%), а также клубни картофеля (до 25%). В клубнях картофеля крахмальные зерна плавают в клеточном соке, в злаках они плотно склеены белковым веществом клейковиной.
Физические свойства
Крахмал – белое аморфное вещество, без вкуса и запаха, нерастворимое в холодной воде, в горячей воде набухает и частично растворяется, образуя вязкий коллоидный раствор (крахмальный клейстер).
Крахмал существует в двух формах: амилоза – линейный полимер, растворимый в горячей воде, амилопектин – разветвлённый полимер, не растворимый в воде, лишь набухает.
Химические свойства крахмала
Химические свойства крахмала объясняются его строением.
Крахмал не дает реакцию «серебряного зеркала», однако ее дают продукты его гидролиза.
1. Гидролиз крахмала
При нагревании в кислой среде крахмал гидролизуется с разрывом связей между остатками α-глюкозы. При этом образуется ряд промежуточных продуктов, в частности мальтоза. Конечным продуктом гидролиза является глюкоза:
Процесс гидролиза протекает ступенчато, схематически его можно изобразить так:
Видеоопыт «Кислотный гидролиз крахмала»
Реакцию превращения крахмала в глюкозу при каталитическом действии серной кислоты открыл в 1811 г. русский ученый К.Кирхгоф (реакция Кирхгофа).
2. Качественная реакция на крахмал
Так как молекула амилозы представляет собой спираль, то при взаимодействии амилозы с йодом в водном растворе молекулы йода входят во внутренний канал спирали, образуя так называемое соединение включения.
Раствор иода окрашивает крахмал в синий цвет. При нагревании окрашивание исчезает (комплекс разрушается), при охлаждении появляется вновь.
Крахмал + J2 – синее окрашивание
Видеоопыт «Реакция крахмала с йодом»
Данная реакция используется в аналитических целях для обнаружения, как крахмала, так и йода (йодкрахмальная проба)
3. Большинство глюкозных остатков в молекулах крахмала имеют по 3 свободных гидроксила (у 2,3,6-го атомов углерода), в точках разветвления – у 2-го и 3-го атомов углерода.
Следовательно, для крахмала возможны реакции, характерные для многоатомных спиртов, в частности образование простых и сложных эфиров. Однако эфиры крахмала большого практического значения не имеют.
Качественную реакцию на многоатомные спирты крахмал не дает, так как плохо растворяется в воде.
Получение крахмала
Из растений извлекают крахмал, разрушая клетки и отмывая его водой. В промышленном масштабе его получают главным образом из клубней картофеля (в виде картофельной муки), а также кукурузы, в меньшей степени – из риса, пшеницы и других растений.
Получение крахмала из картофеля
Картофель моют, измельчают и промывают водой и перекачивают в большие сосуды, где происходит отстаивание. Вода извлекает из измельченного сырья крахмальные зерна, образуя так называемое «крахмальное молоко».
Полученный крахмал ещё раз промывают водой, отстаивают и сушат в струе теплого воздуха.
Получение крахмала из кукурузы
Зерна кукурузы замачивают в теплой воде разбавленной сернистой кислоты с целью размягчения зерна и удаления из него основной части растворимых веществ.
Набухшее зерно дробят для удаления ростков.
Ростки, после всплывания на поверхность воды, отделяют и используют в дальнейшем для получения кукурузного масла.
Кукурузную массу повторно измельчают, обрабатывают водой для вымывания крахмала, затем отделяют отстаиванием или с помощью центрифуги.
Применение крахмала
Крахмал широко применяется в различных отраслях промышленности (пищевой, фармацевтической, текстильной, бумажной и т.п.).
Он является основным углеводом пищи человека – хлеба, круп, картофеля.
В значительных количествах перерабатывается на декстрины, патоку и глюкозу, используемые в кондитерском производстве.
Из крахмала, содержащегося в картофеле и зерне злаков, получают этиловый, н-бутиловый спирты, ацетон, лимонную кислоту, глицерин.
Крахмал используется как клеящее средство, применяется для отделки тканей, крахмаления белья.
В медицине на основе крахмала готовятся мази, присыпки и т.д.
Химия, Биология, подготовка к ГИА и ЕГЭ
Простое вещество йод — при нормальных условиях — кристаллы чёрно-серого цвета с фиолетовым металлическим блеском, легко образует фиолетовые пары, обладающие резким запахом. Молекула вещества двухатомна (формула I2).
С греческого «йод» — означает «фиалковый».
В начале XIX века химики, смешивая при нагревании золу морских водорослей с серной кислотой, наблюдали выделение паров фиолетового цвета — пары йода:
Интересно, что элемент йод есть практически везде:
- природные минералы — например, лаутарит — йодат кальция — Ca(IO3)2 и майерсит — смешанная соль — CuI·4AgI:
- в живых организмах: у высших животных его содержание регулирует эндокринная щитовидная железа (гормон тироксин), довольно много его в наземных растениях и в водорослях (ламинария — в быту ее называют морской капустой)
- в морской и океанической воде есть йод;
- В.И.Вернадский предполагал получать йод из губок — эти организмы — природные фильтры, так что некоторые виды они содержат его в большом количестве;
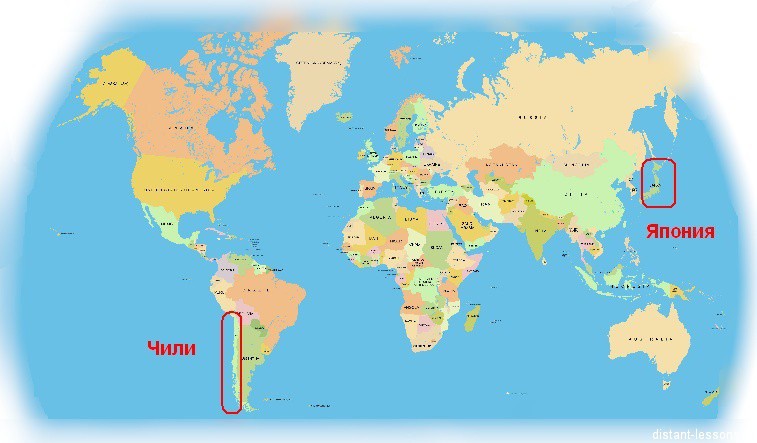
При этом элемент считается редким и рассеянным. Интенсивная добыча минералов, содержащих йод ведется в к Чили и Японии — всего две страны:
Физические свойства йода
твердое вещество чёрно-серого цвета,
при 25 ° цвет немного другой — темно-фиолетовые кристаллы
- металлический блеск (проявление периодичности свойств в группе) и довольно специфический запах — вещество легко возгоняется. При охлаждении пары тут же кристаллизуются — минуя жидкое агрегатное состояние;
- только один изотоп — I-127;
- практически нерастворим в воде, но в спирте образует коричневый раствор:
Качественная реакция на простое вещество — йод — посинение крахмала:
Биологические свойства йода
- считается, что суточная доза йода для человека — 0.125 мг; подробно о значении йода в организме человека можно почитать ЗДЕСЬ…
- еще одно очень важное свойство йода — противомикробное действие:
Растворы йода широко применяют для обработки ран, подготовки операционного поля и т. п.; Йод денатурирует белки микрорганизма и тем самым вызывает его гибель, однако при нанесении на кожу нужно использовать небольшие количества препарата — на слизистые оболочки он оказывает раздражающее действие.
некоторые гормоны содержат в своем составе йод — такие гормоны регулируют обмен веществ в организмах, способствуют расщеплению биополимеров (например, холестерина); регулируют работу иммунной системы
Химические свойства йода
J относится к элементам группы галогенов — неметаллам.
- с металлами образует соли: J2 + 2Na = 2NaJ (йодит натрия)
вытесняется из солей вышестоящими в группе галогенами:
- кислота HJ — йодоводородная кислота- считается сильной кислотой;
http://himija-online.ru/organicheskaya-ximiya/uglevody/kraxmal.html
http://distant-lessons.ru/svojstva-joda.html