Соли аммония: получение и химические свойства
Соли аммония
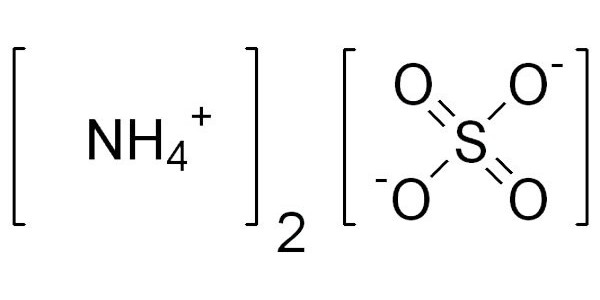
Соли аммония – это соли, состоящие из катиона аммония и аниона кислотного остатка .
Способы получения солей аммония
1. Соли аммония можно получить взаимодействием аммиака с кислотами . Реакции подробно описаны выше.
2. Соли аммония также получают в обменных реакциях между солями аммония и другими солями.
Например , хлорид аммония реагирует с нитратом серебра:
3. Средние соли аммония можно получить из кислых солей аммония . При добавлении аммиака кислая соль переходит в среднюю.
Например , гидрокарбонат аммония реагирует с аммиаком с образованием карбоната аммония:
Химические свойства солей аммония
1. Все соли аммония – сильные электролиты , почти полностью диссоциируют на ионы в водных растворах:
NH4Cl ⇄ NH4 + + Cl –
2. Соли аммония проявляют свойства обычных растворимых солей –вступают в реакции обмена с щелочами, кислотами и растворимыми солями , если в продуктах образуется газ, осадок или образуется слабый электролит.
Например , карбонат аммония реагирует с соляной кислотой. При этом выделяется углекислый газ:
Соли аммония реагируют с щелочами с образованием аммиака.
Например , хлорид аммония реагирует с гидроксидом калия:
NH4Cl + KOH → KCl + NH3 + H2O
Взаимодействие с щелочами — качественная реакция на ионы аммония. Выделяющийся аммиак можно обнаружить по характерному резкому запаху и посинению лакмусовой бумажки.
3. Соли аммония подвергаются гидролизу по катиону , т.к. гидроксид аммония — слабое основание:
4. При нагревании соли аммония разлагаются . При этом если соль не содержит анион-окислителя, то разложение проходит без изменения степени окисления атома азота. Так разлагаются хлорид, карбонат, сульфат, сульфид и фосфат аммония:
Если соль содержит анион-окислитель, то разложение сопровождается изменением степени окисления атома азота иона аммония. Так протекает разложение нитрата, нитрита и дихромата аммония:
При температуре 250 – 300°C:
При температуре выше 300°C:
Разложение бихромата аммония («вулканчик»). Оранжевые кристаллы дихромата аммония под действием горящей лучинки бурно реагируют. Дихромат аммония – особенная соль, в ее составе – окислитель и восстановитель. Поэтому «внутри» этой соли может пройти окислительно-восстановительная реакция (внутримолекулярная ОВР):
Окислитель – хром (VI) превращается в хром (III), образуется зеленый оксид хрома. Восстановитель – азот, входящий в состав иона аммония, превращается в газообразный азот. Итак, дихромат аммония превращается в зеленый оксид хрома, газообразный азот и воду. Реакция начинается от горящей лучинки, но не прекращается, если лучинку убрать, а становится еще интенсивней, так как в процессе реакции выделяется теплота, и, начавшись от лучинки, процесс лавинообразно развивается. Оксид хрома (III) – очень твердое, тугоплавкое вещество зеленого цвета, его используют как абразив. Температура плавления – почти 2300 градусов. Оксид хрома – очень устойчивое вещество, не растворяется даже в кислотах. Благодаря устойчивости и интенсивной окраске окись хрома используется при изготовлении масляных красок.
Видеоопыт разложения дихромата аммония можно посмотреть здесь.
Acetyl
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH — | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | — | — | Н | Н | Н | |
| F — | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | — | Н | Р | Р |
| Cl — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | — | — | — | Н | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | — | Н | ? | Н | Н | ? | М | М | — | Н | ? | ? |
| HSO3 — | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Р | Р |
| HSO4 — | Р | Р | Р | Р | Р | Р | Р | Р | — | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р |
| NO2 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO — | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | Р | — | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
| Растворимые (>1%) | Нерастворимые ( Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую: 8(906)72 3-11-5 2 Скопируйте эту ссылку, чтобы разместить результат запроса » » на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Если вы считаете, что результат запроса » » содержит ошибку, нажмите на кнопку «Отправить». Этим вы поможете сделать сайт лучше. К сожалению, регистрация на сайте пока недоступна. На сайте есть сноски двух типов: Подсказки — помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация — такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Здесь вы можете выбрать параметры отображения органических соединений. Сульфат аммония: формула, состав, получение и применениеДля подкормки сельскохозяйственных растений в основном используются азотные удобрения, выпускаемые в разных формах, одной из которых является сульфат аммония. В нем этот макроэлемент находится в легкодоступном для растений виде. Помимо этого, в состав удобрения входит сера, способствующая лучшему усвоению различных иных элементов. ПрименениеПомимо использования в качестве удобрения, сульфат аммония задействован в производстве вискозного волокна. При переосаждении им производят очистку белков. Также он используется как пищевая добавка Е517. Она применяется для повышения активности дрожжей, увеличению объема хлебобулочных изделий и улучшения структуры теста. Применяется в хлорировании воды с аммонизацией путем введения в нее за несколько секунд до хлора с целью связывания последнего, являющегося свободным, что сокращает его расход, коррозию металла и отрицательное действие на здоровье человека. Также используется для получения марганца в процессе электролиза. В пожарном деле применяется как антипирен. Помимо этого, используется при производстве строительных изоляционных материалов, выделке кож и рыболовстве. СвойстваСернокислый аммоний не имеет запаха, хорошо растворяется не только в воде, но и в кислотах, при этом не растворим в ацетоне, эфире и спирте. Кислые соли можно получить при его нагревании до 250 градусов, при которой наблюдается потеря аммиака. При более высокой температуре продукт распадается на воду, азот, диоксид серы и аммиак. По некоторым данным, вещество способно снижать концентрирование радионуклидов в растениях, что позволяет его выращивать на территориях, подвергшихся загрязнению в результате аварии на Чернобыльской АЭС. Основные способы полученияК ним относятся:
Использование при получении хлорида аммонияПоследний используется для производства удобрений, в фармацевтической промышленности, металлургии. Его можно получить из сульфата аммония. Хлорид аммония получается при реакции последнего с поваренной солью. На промежуточной стадии образуются соляная кислота, аммиак и сульфат натрия. Последний в получении хлорида аммония не участвует. На второй стадии реакции аммиак вступает во взаимодействие с соляной кислотой с выделением белого дыма. При повышении температуры хлористый аммоний происходит обратная реакция. Сульфат аммония не образуется, формируются продукты, которые ранее вступали в реакцию. Характерной особенностью первого является то, что он может взаимодействовать с различными солями. Уравнения сульфата аммония с ними приведены ниже: Краткая характеристика удобренияВ своем составе тук содержит 24% серы и 21% азота. По химическим свойствам представляет собой кристаллическую соль, имеющую белый цвет. Растворимость в воде хорошая, гигроскопичность слабая, что обуславливает его хорошую сыпучесть и неслеживаемость. Сера и азот входят в состав аминокислот, являющихся мономерами для белков. Первый элемент способствует лучшему усвоению калия и фосфора. Сера необходима растениям для:
При недостатке серы наблюдаются следующие признаки:
Азот в соединении находится в аммиачной форме, которая более эффективно усваивается растениями по сравнению с нитратной. Удобрение применяют в жидком виде для внекорневых подкормок. Однако при этом необходимо учитывать некоторые особенности его использования:
Положительные моменты применения сульфата аммонияЭтот тук используют при наступлении следующих обстоятельств:
Все это говорит о нехватке азота. Сульфат аммония имеет ряд преимуществ перед другими азотными удобрениями:
Использование при выращивании различных культурЭто удобрение применяют на почвах, у которых нейтральная или слабощелочная реакция среды. Как и любой другой азотный тук, его применяют преимущественно, рано весной, для того чтобы дать толчок в развитии растений. Его вносят, в первую очередь, под следующие культуры:
Применение сернокислого аммония под картофель способствует увеличению урожая, массы клубней, а также массовой концентрации крахмала в них. Удобрение применяют в дозе 25-40 г/кв. м. За вегетацию обработку выполняют 2-3 раза. Такая частая подкормка азотом в форме рассматриваемого удобрения не способствует излишнему накоплению нитратов в клубнях. Полив раствором сульфата аммония выполняют и для моркови. Его применение способствует выпрямлению корнеплодов, поскольку за их правильный внешний вид ответственна сера. В них накапливается больше сахаров, морковь становится более сочной. Подкормки осуществляют вплоть до наступления 15-20 дней до уборки корнеплодов. При применении удобрения под саженцы и деревья его смешивают с коровяком. Происходит наращивание зеленой массы первыми и их ускорение роста. Плоды на деревьях становятся крупными и сочными. Под цветную и белокочанную капусты вносят 15-20 г/кв. м тука для предотвращения наращивания зеленой массы, которая будет забирать питательные элементы и мешать образованию кочанов или головок. Аммонийное удобрение применяется 1 раз до или после посадки. Зеленые растения активно реагируют на внесение этого азотного тука. Происходит наращивание урожая у петрушки, кинзы, сельдерея, мяты. Под цветочные растения можно применять отдельно от других азотогенов, а также в составе комплексного внесения удобрений. При этом доза составляет 20-30 г на 1 кв. м. Взаимодействие с почвойУдобрение относится к физиологически кислым. Поэтому при неоднократном его использовании почва начинает сдвигать реакцию среды в левую сторону. В связи с этим рекомендуется при использовании сернокислого аммония вносить известковые материалы в соотношении 1:1,3. На черноземных почвах подкисление происходит в течение длительного промежутка времени (10-15 лет), поскольку у них высокая буферность и хорошее содержание органического вещества. При обработке почвы аммиачная форма азота, характерная для рассматриваемой формы удобрения, переходит в нитратную. Ему способствует реакция почвы, степень аэрации, массовая доля влаги в почве, ее температурный режим. Ион аммония в почве удерживается на поверхности, благодаря чему поглощается растениями в течение длительного временного интервала. Условия храненияКак уже говорилось, удобрение не является гигроскопичным, поэтому специальных условий хранения не требует. Срок хранения теоретически не ограничен. Однако длительный период нахождения удобрения на складе способствует некоторой потере из него действующего вещества. Сульфат-нитрат аммонияСуществует патент на изобретение, относящийся к сельскому хозяйству, под №2483048. Его получают приготовлением водной пульпы, в которой содержатся сульфат и нитрат аммония с последующим гранулированием и сушкой в специальном аппарате. Это удобрение также характеризуется низкой слеживаемостью, малой гигроскопичностью, прочными гранулами. Содержание азота в нем составляет 26% при пониженной концентрации серы — 12-15%. В заключениеСульфат аммония — вещество, которое может быть получено в результате осуществления некоторых химических реакций. Используется в различных сферах народного хозяйства — от рыболовства до пищевой промышленности. В сельскохозяйственной практике может применяться как подкормка для различных культурных растений. Как удобрение не слеживается, хорошо растворяется в воде, мало гигроскопично, поэтому подходит для длительного хранения. Для тех культур, для которых нужна в большей мере не аммиачная, а нитратная форма азота, лучше использовать сульфат-нитрат аммония. источники: http://acetyl.ru/o/nn1h42s1o41.php http://www.syl.ru/article/379850/sulfat-ammoniya-formula-sostav-poluchenie-i-primenenie |