Химия, Биология, подготовка к ГИА и ЕГЭ
Получение бензола и его
Мы рассмотрим «классические» методы получения бензола — те, которые описаны в каждом учебнике по химии, и рассмотрим получение из разных классов органических соединений, т.к. цепочки реакций, которые предлагаются в ЕГЭ, подразумевают умение получать бензол «из всего» 🙂
«Классические» реакции
получения бензола
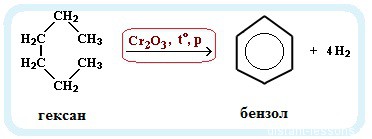
- Ароматизация нефти. Точнее, это реакция циклизации гексана. Называется метод «ароматизация нефти», т.к. из нее получают гексан:
С6H14 → C6H6 + 4H2
Обратите внимание на условия реакции — давление, температуру и катализатор. Они означают, что при обычных условиях гексан не вступит в такую реакцию. Алканы вообще довольно нереакционноспособные вещества.
С6H12 → C6H6 + 3H2
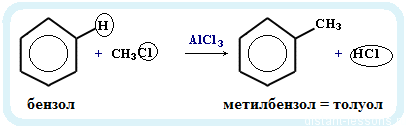
- Получение гомологов бензола: алкилирование бензола:
реакция проводится в присутствии катализатора — галогенидов алюминия, например, AlCl3:
C6H6 + CH3Cl → C6H5CH3 + HCl
Именная реакция — реакция Зелинского. Получение бензола из ацетилена:
3С2H2 → C6H6
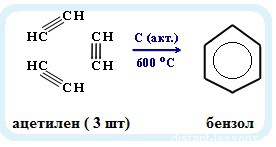
1. Получение бензола из неорганических веществ:
- 1 вариант:
Исходное вещество — карбид кальция СaC2:
CaC2 + 2H2O → Ca(OH)2 + C2H2 — ацетилен
дальше — реакция Зелинского : 3С2H2 → C6H6 Это самый короткий путь получения. - 2 вариант:
Исходное вещество — карбид алюминия Al4C3:
Al4C3 + 12H2O → 4Al(OH)3 + 3CH4 — метан
2СH4 (1500 °C) → C2H2 + 3H2
дальше — реакция Зелинского
2. Получение бензола и его гомологов из других неорганических веществ:
1) получение бензола из алканов:
СH4 (1500 °C) → C2H2 (С, 600ºС) → С6H6
2) получение бензола и его гомологов из алкенов:
С2H4 → C2H2 →C6H6
Схема: алкен → дибромалкан → циклоалкан → гомолог бензола
CH2=CH-(CH2)4-CH3 + HBr → CH3-CH( Br )-(CH2)4-CH3
CH3-CH(Br)-(CH2)4-CH3 + Br2 → CH3-CH( Br )-(CH2)4-CH2 Br
CH3-CH( Br )-(CH2)4-CH2 Br + Zn → C6H13-СH3 — метилциклогексан + ZnBr2
C6H13-СH3 → С6H5-CH3 + 4H2
Please wait.
We are checking your browser. gomolog.ru
Why do I have to complete a CAPTCHA?
Completing the CAPTCHA proves you are a human and gives you temporary access to the web property.
What can I do to prevent this in the future?
If you are on a personal connection, like at home, you can run an anti-virus scan on your device to make sure it is not infected with malware.
If you are at an office or shared network, you can ask the network administrator to run a scan across the network looking for misconfigured or infected devices.
Another way to prevent getting this page in the future is to use Privacy Pass. You may need to download version 2.0 now from the Chrome Web Store.
Cloudflare Ray ID: 6e13206f2ae1421e • Your IP : 85.95.188.35 • Performance & security by Cloudflare
Хлористый бензил: формула, свойства, получение
Хлористый бензил – важное органическое вещество, производные которого применяются в фармацевтической, косметической и химической отрасли. Получить его можно несколькими способами, основным из которых служит хлорирование толуола. Данное вещество является токсичным и вызывает раздражение слизистых и кожи, поэтому при работе с ним требуется осторожность.
Описание
Хлористый бензил (другие названия – бензилхлорид, хлорметилбензол, альфа-хлортоулол) – это хлорорганическое соединение, производное бензола. В химической промышленности используется для замещения бензильными группами в других веществах. В этой области находит широкое применение.

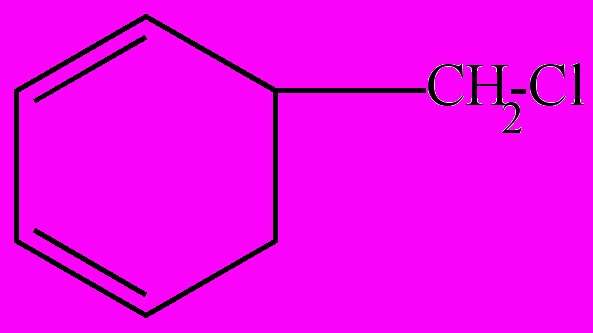
Химическая формула хлористого бензила имеет вид: C6H5CH2CI.
Структурное строение соединения показано на рисунке ниже.
Химические свойства
Вещество обладает следующими химическими свойствами:
- смешивается с органическими растворителями, спиртами;
- обладает высокой реакционной способностью;
- не растворимо в воде;
- реакция среды – нейтральная;
- в присутствии некоторых металлов (Fe, Zn, Sn, бронза, латунь) – осмоляется.

Гидролиз хлористого бензила с его нагревом приводит к образованию бензилового спирта. Этот процесс проводят в реакторе, куда добавляют 15%-ный водный раствор Na₂CO₃.
Для транспортировки вещество упаковывают в стеклянную или полиэтиленовую тару, освинцованные цистерны.
Физические характеристики
Для хлористого бензила характерны следующие свойства:
- легкая воспламеняемость;
- плотность (при 25 °C) – 1100 кг/м3;
- молярная масса – 126,58 г/моль;
- температура плавления – 234,2 К;
- температура кипения – 452,5 К;
- температура вспышки – 426,2 К;
- предел взрываемости паров – 1,1% (по объему).
У вещества имеется склонность к самоконденсации. Ее устраняют путем добавления углеводородов, смол и фенолов.
По внешнему виду это соединение представляет собой бесцветную жидкость.
Хлористый бензил: получение
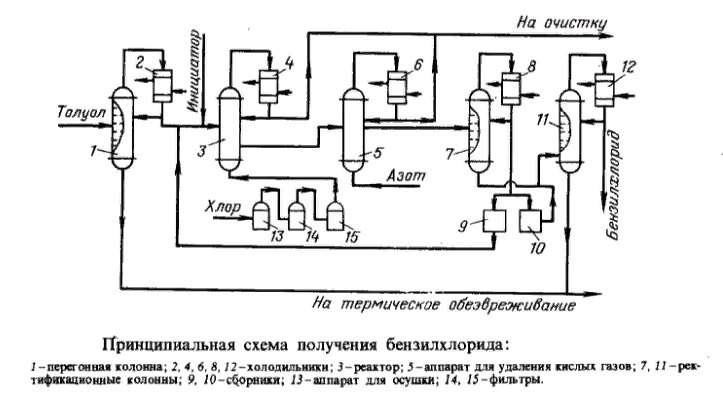
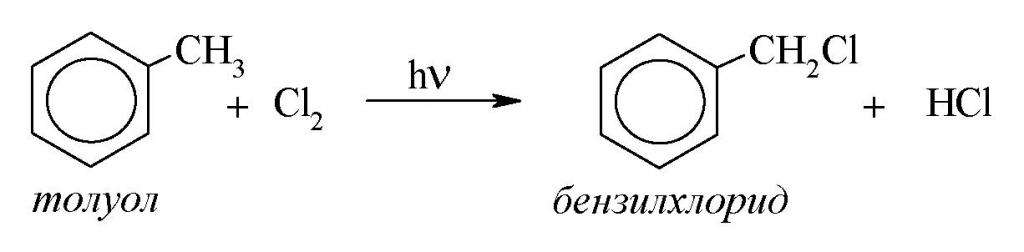
Основным промышленным способом синтеза данного вещества является хлорирование толуола при температуре 90-100 °C. Принципиальная технологическая схема этого процесса изображена на рисунке ниже.
Химизм реакции протекает следующим образом:
Технология состоит из 3 основных стадий:
- дистилляция толуола;
- его хлорирование;
- разделение многокомпонентного продукта реакции.
В качестве инициаторов, запускающих цепные радикальные процессы, применяют ультрафиолетовое облучение или C₈H₁₂N₄ (динитрил азобисизомасляной кислоты). В конечном продукте массовая доля хлористого бензила составляет не менее 98%. Побочными веществами в смеси являются полихлориды (бензилиденхлорид), хлортолуол и толуол.
Образование соединений первого типа обусловлено электрофильным замещением атома водорода ароматического ядра на атом хлора, катализатором которого является хлористое железо. Этому также способствует рост концентрации бензилхлорида в реакторе. По данной причине процесс хлорирования проводят не до конца. Количество исходного толуола в остатке составляет до 50%. В этом случае содержание полихлоридов не превышает 5% от массы хлористого бензила.
На процесс хлорирования толуола оказывает большое влияние также чистота реагентов. Так, при наличии примесей железа происходит хлорирование толуола в ядро, а пары воды приводят к быстрому разрушению металла технологического оборудования. Наиболее подходящими материалами для реакторов являются серебро и никель. Одним из перспективных способов снижения образования побочных продуктов служит использование аминов (диметиламин, диэтиламин, диэтаноламин), которые способны связывать хлорное железо в неактивные комплексы.
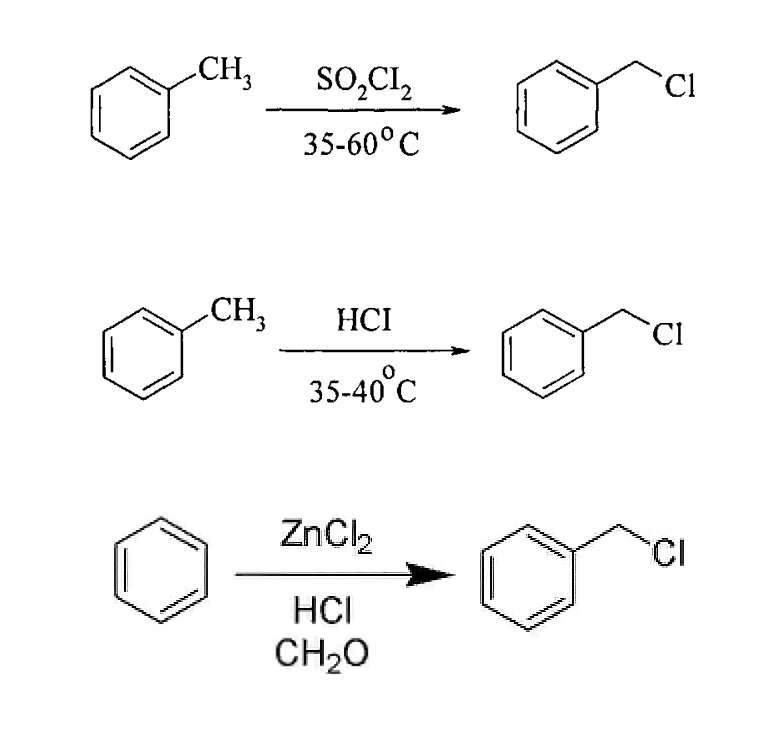
Применяются и другие способы получения этого соединения, указанные на рисунке ниже.
Применение
Хлористый бензил используется для производства следующих материалов:
- бензиловый спирт (ароматизатор в пищевой промышленности и парфюмерии, добавка в составе растворителей, антисептическая обработка маслянистых лекарств, вводимых внутримышечно);
- бензилцеллюлоза (изготовление кабелей, лакокрасочной продукции, «моющихся» обоев, прессовочных и литьевых композиций);
- сложные эфиры бензойной кислоты (анестезирующие средства в медицине);
- бензальдегид (синтез других веществ, изготовление красителей, парфюмерно-косметических продуктов);
- бензиламины (производство катионных красителей и лекарственных веществ);
- пластмассы;
- четвертичные аммониевые соли (изготовление ПАВ).
В органической химии это соединение используется также для защиты аминогрупп.
Синтез производных соединений
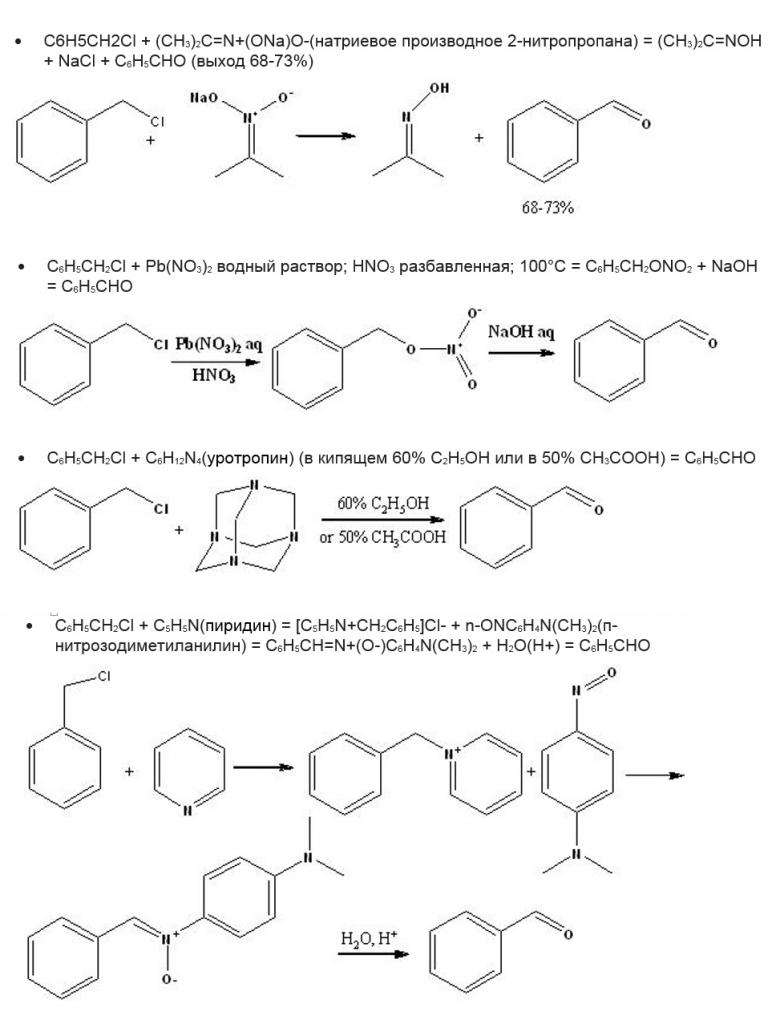
Получение бензальдегида из хлористого бензила производится несколькими способами, которые показаны на рисунке ниже.
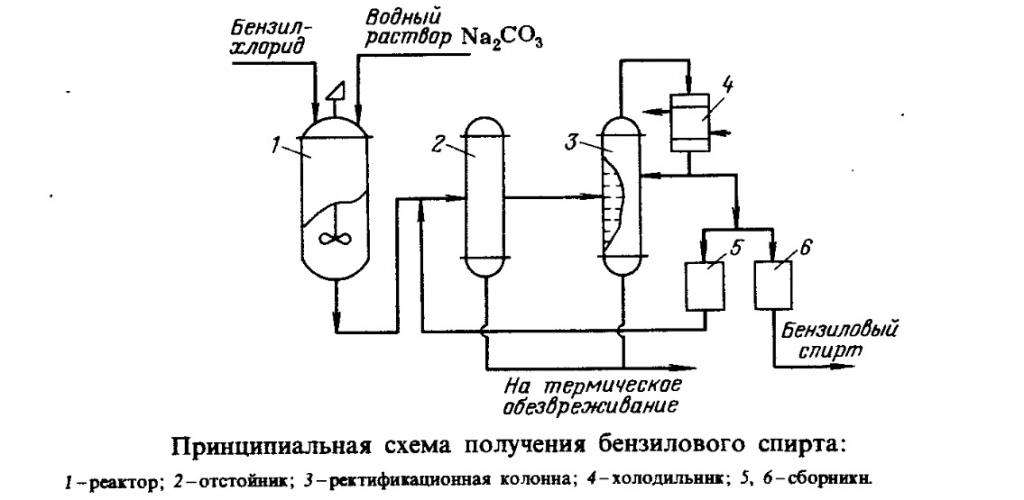
Бензиловый спирт синтезируют по технологической схеме, описанной на этом рисунке:
Данный процесс состоит из нескольких этапов:
- гидролиз водным раствором карбоната натрия;
- выделение спирта-сырца;
- его ректификация.
Бензиламины получают в промышленности аминированием жидкого хлористого бензила с помощью газообразного аммиака в водно-спиртовой среде. Реактор представляет собой стандартный эмалированный аппарат. Сначала загружают раствор спирта, затем насыщают его аммиаком. После этого смесь нагревают до 40 °C, вводят под давлением бензилхлорид с азотом. Температуру доводят до 60 °C, после выдержки смесь направляют в сборник, где отгоняют остатки аммиака и растворителя, которые затем возвращают в реактор для повторного аминирования.
Получение других важных производных происходит по следующим схемам:
- α-толуиловая кислота C6H5CH2Cl+ NaCN→ C6H5CH2CN → C6H5CH2COOH;
- аммониевые соли NR3 + C6H5CH2Cl → C6H5CH2NR3+Cl−;
- бензойная кислота C6H5CH2Cl + 2 KOH + 2 [O] → C6H5COOK + KCl + H2O.
Влияние на живые организмы
Хлористый бензил является взрыво- и пожароопасным соединением. Его предельно допустимая концентрация в воздухе составляет 0,5 мг/м3. Вещество оказывает следующее негативное влияние на организм человека:
- раздражение слизистых оболочек глаз и носа;
- спазм век и сильное слезотечение;
- возникновение воспалительного процесса при попадании на кожные покровы;
- общее токсическое воздействие при высоких концентрациях.
Это вещество является достаточно летучим при нормальных условиях. Лабораторные работы с его использованием должны проводиться в шкафу, оснащенном вытяжкой. Требуется также применение индивидуальных средств защиты. Бензилхлорид способен вызывать изменение наследственных свойств, а также является канцерогеном.
http://gomolog.ru/reshebniki/10-klass/rudzitis-i-feldman-2019/16/zadanie-3.html
http://1ku.ru/obrazovanie/32030-hloristyj-benzil-formula-svojstva-poluchenie/