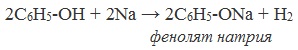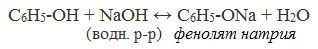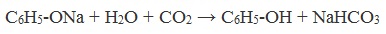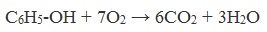Как из фенола получить пикриновую кислоту уравнение реакции
Химические свойства фенолов определяются наличием в молекуле гидроксильной группы и бензольного кольца.
I. Реакции с участием гидроксильной группы
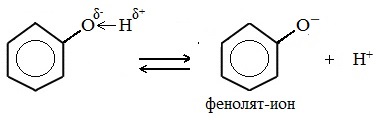
Фенолы являются более сильными кислотами, чем спирты и вода, т.к. за счет участия неподеленной электронной пары кислорода в сопряжении с π-электронной системой бензольного кольца полярность связи О–Н увеличивается.
Фенолы в водных растворах диссоциируются по кислотному типу: на фенолят-ионы и ионы водорода:
Фенол диссоциирует обратимо, это слабая кислота. Однако его силы кислотных свойств достаточно, чтобы изменять окраску индикатора, имеющего в нейтральной среде фиолетовый цвет. В растворе фенола лакмус краснеет.
1) Взаимодействие с активными металлами с образованием фенолятов (сходство со спиртами)
Видеоопыт «Взаимодействие фенола с металлическим натрием»
2) Взаимодействие со щелочами с образованием фенолятов (отличие от спиртов)
Видеоопыт «Взаимодействие фенола с раствором щелочи»
Образующиеся в результате реакций феноляты легко разлагаются при действии кислот. Даже такая слабая кислота, как угольная, вытесняет фенол из фенолятов. Следовательно, !Феноляты – соли слабой карболовой кислоты, разлагаются угольной кислотой:
По кислотным свойствам фенол превосходит этанол в 10 6 раз. При этом во столько же раз уступает уксусной кислоте. В отличие от карбоновых кислот, фенол не может вытеснить угольную кислоту из её солей
C6H5-OH + NaHCO3 = реакция не идёт – прекрасно растворяясь в водных растворах щелочей, он фактически не растворяется в водном растворе гидрокарбоната натрия.
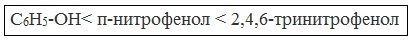
Кислотные свойства фенола усиливаются под влиянием связанных с бензольным кольцом электроноакцепторных групп (NO2 — , Br — )
2,4,6-тринитрофенол или пикриновая кислота сильнее угольной.
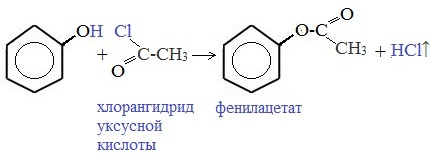
3) Образование сложных и простых эфиров
Как и спирты, фенолы могут образовывать простые и сложные эфиры. Фенолы не образуют сложные эфиры в реакциях с кислотами. Сложные эфиры образуются при взаимодействии фенола с ангидридами или хлорангидридами карбоновых кислот:
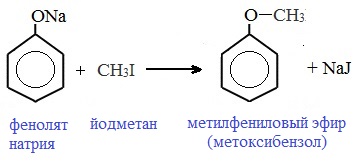
Простые эфиры образуются при взаимодействии фенолятов с алкилгалогенидами:
II . Реакции, с участием бензольного кольца
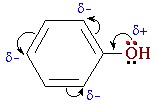
Взаимное влияние атомов в молекуле фенола проявляется не только в особенностях поведения гидроксигруппы, но и в большей реакционной способности бензольного ядра. Гидроксильная группа повышает электронную плотность в бензольном кольце, особенно, в орто- и пара- положениях (+ М -эффект ОН-группы):
Поэтому фенол значительно активнее бензола вступает в реакции электрофильного замещения в ароматическом кольце.
Реакции замещения
1) Нитрование
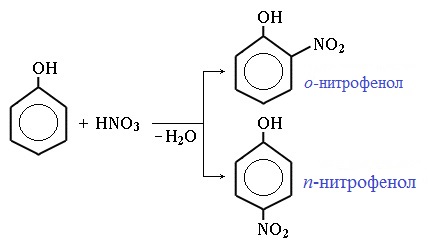
Под действием 20% азотной кислоты HNO3 фенол легко превращается в смесь орто- и пара- нитрофенолов:
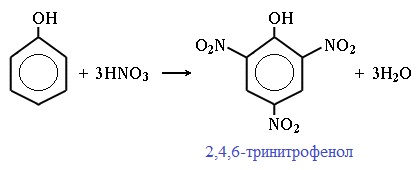
При использовании концентрированной HNO3 образуется 2,4,6-тринитрофенол (пикриновая кислота):
У нее кислотные свойства выражены сильнее, чем у фенола, т.к. нитрогруппы оттягивают электронную плотность от бензольного кольца и делают связь О-Н еще более полярной.
Пикриновая кислоты является взрывчатым веществом, в чистом виде представляет собой желтые кристаллы.
2) Галогенирование
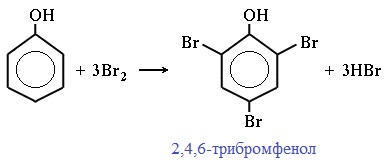
Фенол легко при комнатной температуре взаимодействует с бромной водой с образованием белого осадка 2,4,6-трибромфенола ( качественная реакция на фенол! ):
Образуется белый осадок трибромфенола.
Видеоопыт «Взаимодействие фенола с бромной водой»
3) Сульфирование
Соотношение о- и п-изомеров определяется температурой реакции: при комнатной температуре в основном образуется о-фенолсульфокислота, при t=1000С – пара-изомер: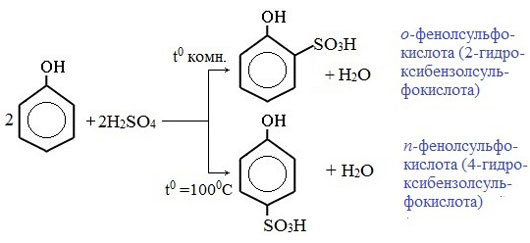
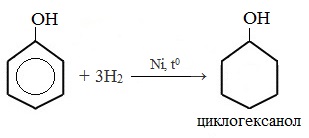
1) Гидрирование фенола
Эта реакция идет с разрушением ароматического кольца. Продукт реакции циклический одноатомный спирт — циклогексиловый спирт (циклогексанол).
2) Конденсация с альдегидами
При нагревании фенола с формальдегидом в присутствии кислотных или основных катализаторов происходит реакция поликонденсации и образуется фенолформальдегидная смола.
Данная реакция имеет большое практическое значение и используется при получении фенолформальдегидных смол.
III. Реакция окисления
Фенолы легко окисляются даже под действием кислорода воздуха. При стоянии на воздухе фенол постепенно окрашивается в розовато-красный цвет.
1) Горение (полное окисление)
Фенолы, как и большинство органических веществ, сгорают до углекислого газа и воды.
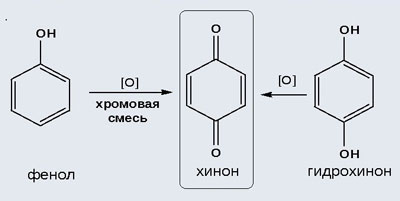
2) Окисление хромовой смесью
При энергичном окислении фенола хромовой смесью основным продуктом окисления является хинон. Двухатомные фенолы окисляются еще легче. При окислении гидрохинона также образуется хинон:
IV. Качественная реакция! — обнаружение фенола
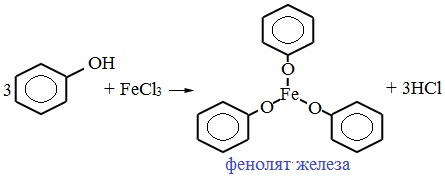
Для обнаружения фенолов используется качественная реакция с хлоридом железа (III). Одноатомные фенолы дают устойчивое сине-фиолетовое окрашивание, что связано с образованием комплексных соединений железа.
Видеоопыт «Качественная реакция на фенол»
Образование фиолетового окрашивания при добавлении раствора FeCl3 служит качественной реакцией на фенол:
Для фенолов реакции по связям С-О не характерны, поскольку атом кислорода прочно связан с атомом углерода бензольного кольца за счет участия своей неподеленной электронной пары в системе сопряжения.
Фенолы
Гидроксисоединения – это органические вещества, молекулы которых содержат, помимо углеводородной цепи, одну или несколько гидроксильных групп ОН.
Гидроксисоединения делят на спирты и фенолы.
| Спирты – это гидроксисоединения, в которых группа ОН соединена с алифатическим углеводородным радикалом R-OH. Если гидроксогруппа ОН соединена с бензольным кольцом, то вещество относится к фенолам. |
Общая формула предельных нециклических спиртов: CnH2n+2Om, где m ≤ n.
Классификация фенолов
По числу гидроксильных групп:
- фенолы с одной группой ОН — содержат одну группу -ОН. Общая формула CnH2n-7OH или CnH2n-6O.
- фенолы с двумя группами ОН — содержат две группы ОН. Общая формула CnH2n-8(OH)2 или CnH2n-6O2.
| Соединения, в которых группа ОН отделена от бензольного кольца углеродными атомами – это не фенолы, а ароматические спирты: |
Строение фенолов
В фенолах одна из неподеленных электронных пар кислорода участвует в сопряжении с π–системой бензольного кольца, это является главной причиной отличия свойств фенола от спиртов.
Химические свойства фенолов
| Сходство и отличие фенола и спиртов. |
Сходство: как фенол, так и спирты реагируют с щелочными металлами с выделением водорода.
Отличия:
- фенол не реагирует с галогеноводородами: ОН- группа очень прочно связана с бензольным кольцом, её нельзя заместить;
- фенол не вступает в реакцию этерификации, эфиры фенола получают косвенным путем;
- фенол не вступает в реакции дегидратации.
- фенол обладает более сильными кислотными свойствами и вступает в реакцию со щелочами.
1. Кислотные свойства фенолов
| Фенолы являются более сильными кислотами, чем спирты и вода, т. к. за счет участия неподеленной электронной пары кислорода в сопряжении с π-электронной системой бензольного кольца полярность связи О–Н увеличивается. |
Раствор фенола в воде называют «карболовой кислотой», он является слабым электролитом.
1.1. Взаимодействие с раствором щелочей
В отличие от спиртов, фенолы реагируют с гидроксидами щелочных и щелочноземельных металлов, образуя соли – феноляты.
| Например, фенол реагирует с гидроксидом натрия с образованием фенолята натрия |
Так как фенол – более слабая кислота, чем соляная и даже угольная, его можно получить из фенолята, вытесняя соляной или угольной кислотой:
1.2. Взаимодействие с металлами (щелочными и щелочноземельными)
Фенолы взаимодействуют с активными металлами (щелочными и щелочноземельными). При этом образуются феноляты. При взаимодействии с металлами фенолы ведут себя, как кислоты.
| Например, фенол взаимодействует с натрием с образованием фенолята натрия и водорода . |
2. Реакции фенола по бензольному кольцу
| Наличие ОН-группы в бензольном кольце (ориентант первого рода) приводит к тому, что фенол гораздо легче бензола вступает в реакции замещения в ароматическом кольце. |
2.1. Галогенирование
| Фенол легко при комнатной температуре (без всякого катализатора) взаимодействует с бромной водой с образованием белого осадка 2,4,6-трибромфенола (качественная реакция на фенол). |
2.2. Нитрование
Под действием 20% азотной кислоты HNO3 фенол легко превращается в смесь орто- и пара-нитрофенолов.
| Например, при нитровании фенола избытком концентрированной HNO3 образуется 2,4,6-тринитрофенол (пикриновая кислота): |
3. Поликонденсация фенола с формальдегидом
С формальдегидом фенол образует фенолоформальдегидные смолы.
4. Взаимодействие с хлоридом железа (III)
При взаимодействии фенола с хлоридом железа (III) образуются комплексные соединения железа, которые окрашивают раствор в сине-фиолетовый цвет. Это качественная реакция на фенол.
5. Гидрирование (восстановление) фенола
Присоединение водорода к ароматическому кольцу.
Продукт реакции – циклогексанол, вторичный циклический спирт.
Получение фенолов
1. Взаимодействие хлорбензола с щелочами
При взаимодействии обработке хлорбензола избытком щелочи при высокой температуре и давлении образуется водный раствор фенолята натрия.
При пропускании углекислого газа (или другой более сильной кислоты) через раствор фенолята образуется фенол.
2. Кумольный способ
Фенол в промышленности получают из каталитическим окислением кумола.
Первый этап процесса – получение кумола алкилированием бензола пропеном в присутствии фосфорной кислоты:
Второй этап – окисление кумола кислородом. Процесс протекает через образование гидропероксида изопропилбензола:
Суммарное уравнение реакции:
3. Замещение сульфогруппы в бензол-сульфокислоте
Бензол-сульфокислота реагирует с гидроксидом натрия с образованием фенолята натрия:
Получается фенолят натрия, из которого затем выделяют фенол:
Пикриновая кислота: структура, синтез, свойства и применение
Пикриновая кислота: структура, синтез, свойства и применение — Наука
Содержание:
В пикриновая кислота представляет собой сильно нитрованное органическое химическое соединение, название которого по ИЮПАК — 2,4,6-тринитрофенол. Его молекулярная формула C6ЧАС2(НЕТ2)3ОЙ. Это очень кислый фенол, его можно найти в виде пикрата натрия, аммония или калия; то есть в ионной форме C6ЧАС2(НЕТ2)3На.
Это твердое вещество с сильным горьким вкусом, отсюда и свое название от греческого слова «прикос», что означает горький. Обнаружен в виде влажных желтых кристаллов. Его высыхание или обезвоживание опасно, поскольку увеличивает нестабильные свойства, делающие его взрывоопасным.
Молекула пикриновой кислоты показана выше. На изображении сложно распознать связи и атомы, потому что это соответствует изображению его ван-дер-ваальсовой поверхности. В следующем разделе молекулярная структура обсуждается более подробно.
Из пикриновой кислоты синтезируются некоторые промежуточные соединения, различные пикратные соли и комплексы пикриновой кислоты.
Пикриновая кислота используется в качестве основы для синтеза стойких желтых красителей. Некоторые патологи и исследователи используют его для фиксации или окрашивания срезов тканей и других иммуногистохимических процессов.
Это очень полезно при производстве фармацевтических продуктов. Кроме того, он используется при производстве спичек или спичек и взрывчатки. Он также используется для травления металлов, изготовления цветного стекла и для колориметрического определения биологических параметров, таких как креатинин.
С другой стороны, пикриновая кислота является раздражителем при попадании на кожу, слизистую оболочку дыхательных путей, глаз и пищеварительного тракта. Помимо повреждения кожи, он может серьезно повлиять на почки, кровь, печень и другие органы.
Состав
На изображении выше более подробно показаны все связи и сама структура молекулы пикриновой кислоты. Он состоит из фенола с тремя нитрозаместителями.
Видно, что в группах NO2 атом азота имеет положительный частичный заряд и поэтому требует электронной плотности своего окружения. Но ароматическое кольцо также притягивает к себе электроны, и до трех NO2 в конечном итоге он отказывается от части своей электронной плотности.
Как следствие этого, кислород группы ОН имеет тенденцию больше делить одну из своих свободных электронных пар, чтобы восполнить электронный дефицит, которым страдает кольцо; и при этом образуется связь C = O + -ЧАС. Этот частичный положительный заряд кислорода ослабляет связь O-H и увеличивает кислотность; то есть он будет выделяться в виде иона водорода H + .
Кислый фенол
По этой причине это соединение является исключительно сильной (и реактивной) кислотой, даже в большей степени, чем сама уксусная кислота. Однако на самом деле это соединение представляет собой фенол, кислотность которого превышает кислотность других фенолов; из-за, как уже упоминалось, заместителей NO2.
Следовательно, поскольку это фенол, группа ОН имеет приоритет и направляет нумерацию в структуре. Три НЕТ2 они расположены у атомов углерода 2, 4 и 6 ароматического кольца по отношению к ОН. Отсюда номенклатура этого соединения IUPAC: 2,4,6-тринитрофенол (TNP).
Если бы групп не было2, или если бы их было меньшее количество в кольце, связь O-H ослаблялась бы меньше, и, следовательно, соединение имело бы меньшую кислотность.
Кристальная структура
Молекулы пикриновой кислоты расположены таким образом, чтобы способствовать их межмолекулярным взаимодействиям; либо для образования водородных связей между группами OH и NO2, диполь-дипольные силы или электростатическое отталкивание между электронно-дефицитными областями.
Можно ожидать, что группы НЕ будут2 они отталкиваются друг от друга и ориентируются в направлении соседних ароматических колец. Кроме того, кольца не могли выровняться одно на другое из-за повышенного электростатического отталкивания.
Продукт всех этих взаимодействий пикриновой кислоте удается сформировать трехмерную сеть, которая определяет кристалл; элементарная ячейка которого соответствует кристаллической системе орторомбического типа.
Синтез
Первоначально он был синтезирован из природных соединений, таких как производные рога животных, природные смолы и другие. Начиная с 1841 года фенол использовался в качестве предшественника пикриновой кислоты различными способами или различными химическими методами.
Как уже было сказано, это один из самых кислых фенолов. Для его синтеза фенол сначала проходит процесс сульфирования, а затем процесс нитрования.
Сульфирование безводного фенола осуществляется обработкой фенола дымящей серной кислотой с получением электрофильных ароматических замещений H сульфонатными группами, SO3H в положении -орто и -пара по отношению к группе ОН.
Этот продукт, 2,4-фенолдисульфоновая кислота, проходит процесс нитрования, обрабатывая его концентрированной азотной кислотой. При этом две группы SO3H замещены нитрогруппами, NO2, а третий входит в другую нитро-позицию. Следующее химическое уравнение иллюстрирует это:
Прямое нитрование фенола
Процесс нитрования фенола не может быть осуществлен напрямую, так как образуются высокомолекулярные смолы. Этот метод синтеза требует очень тщательного контроля температуры, поскольку он очень экзотермичен:
Пикриновая кислота может быть получена путем прямого нитрования 2,4-динитрофенола азотной кислотой.
Другой способ синтеза — обработка бензола азотной кислотой и нитратом ртути.
Физические и химические свойства
Молекулярный вес
Внешность
Желтая масса или взвесь влажных кристаллов.
http://chemege.ru/fenoly/
http://ru1.warbletoncouncil.org/acido-picrico-7146