Этан: способы получения и свойства
Этан C2H6 – это предельный углеводород, содержащий два атома углерода в углеродной цепи. Бесцветный газ без вкуса и запаха, нерастворим в воде и не смешивается с ней.
Гомологический ряд этана
Все алканы — вещества, схожие по физическим и химическим свойствам, и отличающиеся на одну или несколько групп –СН2– друг от друга. Такие вещества называются гомологами, а ряд веществ, являющихся гомологами, называют гомологическим рядом.
Самый первый представитель гомологического ряда алканов – метан CH4. , или Н–СH2–H.
Продолжить гомологический ряд можно, последовательно добавляя группу –СН2– в углеводородную цепь алкана.
| Название алкана | Формула алкана |
| Метан | CH4 |
| Этан | C2H6 |
| Пропан | C3H8 |
| Бутан | C4H10 |
| Пентан | C5H12 |
| Гексан | C6H14 |
| Гептан | C7H16 |
| Октан | C8H18 |
| Нонан | C9H20 |
| Декан | C10H22 |
Общая формула гомологического ряда алканов CnH2n+2.
Первые четыре члена гомологического ряда алканов – газы, C5–C17 – жидкости, начиная с C18 – твердые вещества.
Строение этана
В молекулах алканов встречаются химические связи C–H и С–С.
Связь C–H ковалентная слабополярная, связь С–С – ковалентная неполярная. Это одинарные σ-связи. Атомы углерода в алканах образуют по четыре σ-связи. Следовательно, гибридизация атомов углерода в молекулах алканов – sp 3 :
При образовании связи С–С происходит перекрывание sp 3 -гибридных орбиталей атомов углерода:
При образовании связи С–H происходит перекрывание sp 3 -гибридной орбитали атома углерода и s-орбитали атома водорода:
Четыре sp 3 -гибридные орбитали атома углерода взаимно отталкиваются, и располагаются в пространстве так, чтобы угол между орбиталями был максимально возможным.
Поэтому четыре гибридные орбитали углерода в алканах направлены в пространстве под углом 109 о 28′ друг к другу:
Это соответствует тетраэдрическому строению молекулы.
| Например, в молекуле этана C2H6 атомы водорода располагаются в пространстве в вершинах двух тетраэдров, центрами которых являются атомы углерода |
Изомерия этана
Для этана не характерно наличие изомеров – ни структурных (изомерия углеродного скелета, положения заместителей), ни пространственных.
Химические свойства этана
Этан – предельный углеводород, поэтому он не может вступать в реакции присоединения.
Для метана характерны реакции:
Разрыв слабо-полярных связей С – Н протекает только по гомолитическому механизму с образованием свободных радикалов.
Поэтому для этана характерны радикальные реакции.
Этан устойчив к действию сильных окислителей (KMnO4, K2Cr2O7 и др.), не реагирует с концентрированными кислотами, щелочами, бромной водой.
1. Реакции замещения
В молекулах алканов связи С–Н более доступны для атаки другими частицами, чем менее прочные связи С–С.
1.1. Галогенирование
Этан реагирует с хлором и бромом на свету или при нагревании.
При хлорировании этана сначала образуется хлорэтан:
Хлорэтан может взаимодействовать с хлором и дальше с образованием дихлорэтана, трихлорэтана, тетрахлорметана и т.д.
1.2. Нитрование этана
Этан взаимодействует с разбавленной азотной кислотой по радикальному механизму, при нагревании и под давлением. Атом водорода в этане замещается на нитрогруппу NO2.
Например. При нитровании этана образуется преимущественно нитроэтан:2. Дегидрирование этанаДегидрирование – это реакция отщепления атомов водорода. В качестве катализаторов дегидрирования используют никель Ni, платину Pt, палладий Pd, оксиды хрома (III), железа (III), цинка и др. При дегидрировании алканов, содержащих от 2 до 4 атомов углерода в молекуле, разрываются связи С–Н у соседних атомов углерода и образуются двойные и тройные связи.
3. Окисление этанаЭтан – слабополярное соединение, поэтому при обычных условиях он не окисляется даже сильными окислителями (перманганат калия, хромат или дихромат калия и др.). 3.1. Полное окисление – горениеЭтан горит с образованием углекислого газа и воды. Реакция горения этана сопровождается выделением большого количества теплоты. Уравнение сгорания алканов в общем виде: При горении этана в недостатке кислорода может образоваться угарный газ СО или сажа С. Получение этана1. Взаимодействие галогеналканов с металлическим натрием (реакция Вюрца)Это один из лабораторных способов получения этана из хлорметана или бромметана. При этом происходит удвоение углеродного скелета.
|





















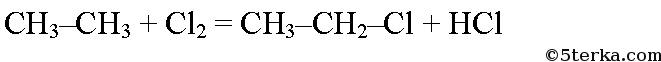













 Решебник по химии за 10 класс (Г.Е.Рудзитис, Ф.Г.Фельдман, 2000 год),
Решебник по химии за 10 класс (Г.Е.Рудзитис, Ф.Г.Фельдман, 2000 год),