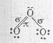Строение и химические свойства озона. Применение озона
Задача 837.
Описать электронное строение молекулы O3, сравнить химическую активность озона и молекулярного кислорода O2. Как получить озон из молекулярного кислорода?
Решение:
Электронное строение трёхатомной молекулы озона можно представить схемой:
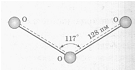
Установлено, что все связи центрального атома кислорода с двумя другими атомами кислорода одинаковы (равноценны) как по длине, так и по энергии. Значит σ- связь, образованная негибридизированными р-орбиталями, является трёхцентровой ковалентной, т.е. электронная — пара делокализована и принадлежит в равной степени всем трём атомам кислорода. Молекула О3 построена в форме равнобедренного треугольника, угол при вершине треугольника 117 0 , что указывает на то, что, центральный атом кислорода находится в состоянии sp 2 – гибридизации. Гибридная sp 2 – орбиталь, содержащая один электрон в центральном атоме, перекрывается с негибридной рх – орбиталью одного из крайних атомов кислорода, образуя σ — связь. Не участвующая в гибридизации рz – орбиталь центрального атома перекрывается с рz – орбиталью другого атома кислорода, образуя σ — связь. Наконец, выступая в качестве донора электронной пары центральный атом кислорода, образует с другим атомом кислорода σ — связь по донорно-акцепторному механизму. Структуру молекулы О3 можно представить схемой:
Рис.3. Структура молекулы О3
Озон как и кислород является сильнейшим окислителем. Он окисляет все металлы, кроме золота и платины. Озон переводит низшие оксиды в высшие, а сульфаты металлов – в их сульфиты. В ходе этих реакций молекула озона теряет один атом кислорода, переходит в молекулу кислорода.
Из раствора иодида калия озон выделяет йод (качественная реакция на О3):
Таким образом, озон более сильный окислитель, чем кислород.
Озон можно получить из молекулярного кислорода действием на последний тихих электрических разрядов:
В природе озон образуется под действием электрических разрядов.
Задача 838.
Может ли при комнатной температуре протекать реакция взаимодействия кислорода: а) с водородом; б) с азотом? Ответ мотивировать, используя табличные данные стандартных значений энергии Гиббса образования веществ, участвующих в процессах.
Решение:
Уравнение реакции взаимодействия водорода с кислородом имеет вид:
Реакция протекает с большим выделением теплоты. Энергия Гиббса образования Н2О имеет отрицательное значение (-228,8 кДж/моль),
ΔG 0 0 С реакция протекает со скоростью в несколько дней, а при 500 0 С кислород и водород полностью прореагируют за несколько часов, при 700 0 С происходит быстрый подъём температуры и реакция заканчивается взрывом. Поэтому, чтобы вызвать взрыв смеси водорода с кислородом, нужно подогреть её хотя бы в одном месте до 700 0 С.
б) При обычных условиях кислород и азот не реагируют друг с другом. Объяснить это можно тем, что энергия Гиббса всех оксидов азота имеет положительное значение, ΔG 0 > 0. Из табличных данных следует, что энтальпия образования всех оксидов азота тоже положительна, т. е. данные реакции являются эндотермическими. Малая скорость взаимодействия кислорода с азотом объясняется высокой энергией активации этих процессов. Молекулы кислорода и азота очень прочны, поэтому чтобы сделать кинетическую энергию сталкивающихся молекул большой необходимо очень сильно повысить температуру системы. И только при достаточно высокой температуре некоторые соударения молекул кислорода и азота становятся эффективными и приводят к образованию активных центров. Так кислород и азот взаимодействуют при температуре электрической дуги (3000 – 4000 0 С):
N2 + O2 
Это эндотермическая реакция, поэтому наблюдается тенденция к уменьшению внутренней энергии, что способствует протеканию данного процесса в обратном направлении, а тенденция к увеличению вероятности состояния вызывает её частичное протекание в прямом направлении. Поэтому, чтобы система N2 + O2 = 2NO достигла наиболее вероятного состояния, необходима высокая температура. Поэтому все оксиды азота получают косвенным путём.
Задача 839.
После озонирования при постоянной температуре некоторого объема кислорода установлено, что объем газа, приведенный к исходному давлению, уменьшился на 500 мл. Какой объем озона образовался? Какое количество теплоты поглотилось при его образовании, если для озона ΔН 0 298о = 144,2 кДж/моль?
Решение:
Уравнение реакции:
Из уравнения реакции следует, что из 3 моль кислорода образуется 2 моль озона, т.е. объём системы уменьшается на 1 моль. Можно записать соотношение, показывающее зависимость от образовавшегося объёма озона и уменьшением объёма системы, получим:
2 : 1 = х : 0,5; х = (2 . 0,5)/1 = 1л.
Находим ΔН 0 реакции:
ΔН 0 х.р. = 2 ΔН 0 (O3) — 3 ΔН 0 (O2) = (2 . 144,2) – 3 . 0 = 288,4 кДж.
Количество теплоты рассчитаем из пропорции:
2 : 22,4 : 288,4 = 1 : х; х = (288,4 . 1)/ (2 . 22,4) = 6,44 кДж.
Ответ: 1л О3; 6,44 кДж.
Озон (получение применение)
Озон — аллотропное состояние кислорода состоящий из трёхатомных молекул О3, на цвет голубоватый, образуется в атмосфере при электрических разрядах, в лабораторных условиях может быть получен пропусканием т ихих электрических разрядов на кислород.
Основное применение в органическом синтезе других веществ, а также рассматривается как вариант использования жидкого озона для окисления топлива в космических ракетах.
Что такое озон
Это аллотропное состояние кислорода, образование озона наблюдается во всех химических процессах, в результате которого выделяется атомарный кислород.
В лабораторных условиях озон можно получить не только пропусканием разрядов через кислород, но действием быстрых электронов и протонов, рентгеновских и ультрафиолетовых лучей.
При пропускании электрических искр через кислород или воздух появляется характерный запах, знакомый каждому, кто имел дело с электростатической машиной или индукционной катушкой. Причиной этого запаха является образование нового газообразного вещества — озона.
Так как озон может быть получен из совершенно чистого сухого кислорода при действии электрических искр, то отсюда следует, что озон состоит только и кислорода и представляет собой особое видоизменение этого элемента.
Физические свойства, получение озона

Таким образом, кислород в свободном состоянии может существовать в виде двух аллотропических видоизменений: обыкновенного кислорода О2 и озона.
Для получения озона пользуются действием тихих электрических разрядов на кислород. Приборы, служащие для этой цели,, носят название озонаторов. На рис. 2 изображен озонатор состоящий в основном из двух стеклянных трубок, вставленных одна в другую.
Кислород медленно просасывается между трубками. Во внутреннюю трубку наливают разбавленный раствор серной кислоты, и весь прибор помещают в стакан с тем же раствором. В растворы погружают провода от индукционной катушки.
Таким образом, растворы являются электродами и в тоже время служат для охлаждения газа. При работе катушки в пространстве между стенками трубок происходит тихий электрический разряд. Выходящий из прибора кислород содержит несколько процентов озона. Чем ниже температура, тем больше получается озона.
Озон что это
Озон можно отделить от кислорода сильным охлаждением, причем озон сгущается в синюю жидкость, кипящую при —112°. Жидкий озон легко взрывается.
Растворимость озона в воде значительно больше, чем растворимость кислорода: 100 объемов воды при 0° растворяют 49 объемов озона.
При обыкновенной температуре озон довольно устойчив, но. при нагревании легко разлагается, снова превращаясь в кислород. Распад озона сопровождается выделением тепла и увеличением объема в полтора раза, так как из каждых двух молекул озона получаются три молекулы кислорода:
В химическом отношении озон отличается от кислорода более сильной окислительной способностью: при действии озона блестящая серебряная пластинка быстро чернеет, покрываясь слоем перекиси серебра Ag2O2, сернистые соединения металлов окисляются в соли серной кислоты.
Бумага, смоченная скипидаром, воспламеняется; многие красящие вещества обесцвечиваются. При этом молекула озона теряет один атом кислорода и озон переходит в обыкновенный кислород.
Из раствора йодистого калия озон выделяет иод:
Если поместить в воздух, содержащий озон, бумажку, смоченную раствором йодистого калия и крахмальным клейстером, то она тотчас же синеет. Этой реакцией пользуются для открытия озона.
Как сильный окислитель, озон убивает бактерии и потому применяется для обеззараживания воды и для дезинфекции воздуха.
Озон постоянно образуется в небольших количествах при электрических разрядах в атмосфере. Образование озона может происходить также при различных процессах окисления, например при окислении влажного фосфора, скипидара, смолистых веществ и т. п.
Последним обстоятельством объясняется присутствие озона в воздухе хвойных лесов; этот воздух является особенно полезным для здоровья, так как не содержит бактерий.
Открытие озона
Озон был обнаружен в 1785 физиком из Голландии Мартином ван Марумом, благодаря проведению серии экспериментов, которые проводились в области воздействия электрических разрядов на кислород. В этих результатах ученый пытался исследовать странное на то время явление так называемое «электрическая материя».
В 1850 г. параллельно основной работе, он выяснил, что озон может реагировать с органическими веществами проявляя себя как окислитель.
Благодаря своим дезинфицирующим свойства был применен в 1898 году в Франции. В небольшом на то время городке Бон Вояж был построен завод для дезинфекции воды реки Вазюби.
На территории России завод по озонированию был запущен в Санкт-Петербурге в 1911 году.
Большое применение озона получил в годы Первой мировой войны как антисептическое средство.
В настоящее время с появлением надежных энергосберегающих генераторов озона возросло применение для очистки воды, что хорошо применяется на территории США и по всей Европе.
Химические свойства озона
Образование озона проходит по обратимой реакции:
3O2 + 68kcal/mol(285kJ/mol) → 2О3
Молекула О3 неустойчива и при достаточных концентрациях в воздухе при нормальных условиях самопроизвольно за несколько десятков минут превращается в O2 с выделением тепла.
Повышение температуры и понижение давления увеличивают скорость перехода в двухатомное состояние. При больших концентрациях переход может носить взрывной характер.
Контакт озона даже с малыми количествами органических веществ, некоторых металлов или их окислов резко ускоряет превращение.
В присутствии небольших количеств азотной кислоты озон стабилизируется, а в герметичных сосудах из стекла, некоторых пластмасс или чистых металлов озон при низких температурах (−78 °С) практически не разлагается.
Озон — очень сильный окислитель, намного более реакционноспособный, чем двухатомный кислород. Окисляет почти все металлы (за исключением золота, платины и иридия) до их высших степеней окисления (после некоторого поверхностного окисления довольно хорошо противостоят действию озона Ni, Cu, Sn). Озон окисляет многие неметаллы. Продуктом реакции в основном является кислород.
Озон повышает степень окисления оксидов:
Эта реакция сопровождается хемилюминесценцией. Диоксид азота может быть окислен до азотного ангидрида:
Не реагирует с молекулярным азотом при комнатной температуре, но при 295°С озон вступает с ним в реакцию:
Озон реагирует с углеродом при нормальной температуре с образованием диоксида углерода:
Озон не реагирует с аммониевыми солями, но реагирует с аммиаком с образованием нитрата аммония:
Озон реагирует с водородом с образованием воды и кислорода:
Озон реагирует с сульфидами с образованием сульфатов:
С помощью озона можно получить серную кислоту как из элементарной серы, так и из диоксида серы и сероводорода:
В газовой фазе озон взаимодействует с сероводородом с образованием диоксида серы:
В водном растворе проходят две конкурирующие реакции с сероводородом, одна с образованием элементарной серы, другая с образованием серной кислоты:
Все три атома кислорода в озоне могут реагировать по отдельности в реакции хлорида олова с соляной кислотой и озоном:
Обработкой озоном раствора иода в холодной безводной хлорной кислоте может быть получен перхлорат иода(III):
Твёрдый перхлорат нитрония может быть получен реакцией газообразных NO2, ClO2 и O3:
Озон может участвовать в реакциях горения, при этом температуры горения выше, чем с двухатомным кислородом:
Озон может вступать в химические реакции и при низких температурах. При 77 K (−196 °C, температура кипения жидкого азота), атомарный водород взаимодействует с озоном с образованием гидропероксидного радикала с димеризацией последнего:
Озон может образовывать неорганические озониды, содержащие анион O3 − . Эти соединения взрывоопасны и могут храниться только при низких температурах. Известны озониды всех щелочных металлов (кроме франция). KO3, RbO3 и CsO3 могут быть получены из соответствующих супероксидов:
Озонид калия может быть получен и другим путём из гидроксида калия[13]:
NaO3 и LiO3 могут быть получены действием CsO3 в жидком аммиаке NH3 на ионообменные смолы, содержащие ионы Na + или Li + :
Обработка озоном раствора кальция в аммиаке приводит к образованию озонида аммония, а не кальция:
Озон может быть использован для удаления железа и марганца из воды с образованием осадка (соответственно гидроксида железа(III) и диоксигидрата марганца), который может быть отделён фильтрованием:
В кислых средах окисление марганца может идти до перманганата.
Озон превращает токсичные цианиды в менее опасные цианаты:
Озон может полностью разлагать мочевину:
Взаимодействие озона с органическими соединениями с активированным или третичным атомом углерода при низких температурах приводит к соответствующим гидротриоксидам.
Реакция озона с непредельными соединениями с образованием органических озонидов находит применение в анализе органических веществ.
Реакции озона с другими веществами
Озон реагирует в водном растворе с сероводородом образуя серную кислоту
и элементарной серы
Реагирует с углеродом при нормальных условиях
Озон применение для чего нужен
Давно рассматривается применение озона в качестве высокоэнергетического и вместе с тем экологически чистого окислителя в ракетной технике. Общая химическая энергия, освобождающаяся при реакции сгорания с участием озона, больше, чем для простого кислорода, примерно на одну четверть 719 ккал/кг).
Больше будет, соответственно, и удельный импульс. У жидкого озона большая плотность, чем у жидкого кислорода (1,35 и 1,14 г/см³ соответственно), а его температура кипения выше (−112 °C и −183 °C соответственно), поэтому в этом отношении преимущество в качестве окислителя в ракетной технике больше у жидкого озона.
Однако препятствием является химическая неустойчивость и взрывоопасность жидкого озона с разложением его на O и O2, при котором возникает движущаяся со скоростью около 2 км/с детонационная волна и развивается разрушающее детонационное давление более 3·10 7 дин/см² (3 МПа), что делает применение жидкого озона невозможным при нынешнем уровне техники, за исключением использования устойчивых кислород-озоновых смесей (до 24 % озона).
Преимуществом подобной смеси также является больший удельный импульс для водородных двигателей, по сравнению с озон-водородными. На сегодняшний день такие высокоэффективные двигатели, как РД-170, РД-180, РД-191.
Также разгонные вакуумные двигатели вышли по УИ на близкие к предельным параметры, и для повышения удельного импульса необходимо найти возможность перейти на новые виды топлива.
Жидкий озон при низких температурах (в жидком азоте) также иногда применяется в органическом синтезе для мягкого разрыва двойной углерод-углеродной связи.
Что мы узнали о озоне?
Как пахнет озон?
Запах — резкий, специфический «металлический» (по Менделееву — «запах раков»). При больших концентрациях напоминает запах хлора. Запах ощутим даже при разбавлении 1:100000.
Как образуется озон?
Озон образуется во многих процессах, сопровождающихся выделением атомарного кислорода, например при разложении перекисей, окислении фосфора и т. п.
Какая плотность озона?
Сколько атомов кислорода содержится в молекуле озона?
В молекуле озона — три атома кислорода, а в молекуле кислорода — два атома кислорода.
Вы читаете, статья на тему Озон
Похожие страницы:
Понравилась статья поделись ей
Leave a Comment
Для отправки комментария вам необходимо авторизоваться.
Как из кислорода получить озон уравнение реакции
Содержание:
Озон (от др.-греч. ὄζω — пахну) — состоящая из трёхатомных молекул O3 аллотропная модификация кислорода. При нормальных условиях — голубой ядовитый газ. Запах — резкий специфический. При сжижении превращается в жидкость цвета индиго.
На странице -> решение задач по химии собраны решения задач и заданий с решёнными примерами по всем темам химии.
Кислород в природе встречается в виде двух простых веществ: кислорода 

Явление образования нескольких простых веществ одним элементом
называется аллотропией (рис. 37). Разные простые вещества, образованные одним и тем же химическим элементом, называются аллотропными видоизменениями (модификациями).
Формула озона 
температура плавления – 193°C, в жидком состоянии цвет темно-синий, а в твердом –
от синего до темно-фиолетового. Этот газ был впервые обнаружен голландским химиком Мартином фон Меррумом (1785).
Химические свойства озона
Озон химически более активен, чем кислород, и может окислять благородные металлы: золото, серебро, платину:
Активность озона обусловлена его разложением на молекулярный и атомарный кислород:
Этим же объясняется свежесть воздуха после грозы в сосновом бору. Атомарный кислород – более сильный окислитель, чем молекулярный. Данное свойство применяется при обеззараживании питьевой воды и при отбеливании ткани, бумаги, соломы и т. д. Применение озона при обеззараживании вместо хлора экологически более выгодно. Озон, окисляя примеси сточных вод, превращается в кислород.
В верхних слоях атмосферы на высоте 25 км над землей (в стратосфере) образуется тонкий слой озона , который защищает Землю от чрезмерной дозы ультрафиолетовых лучей (УФО) Солнца (рис. 38). Этот слой разрушается под воздействием различных факторов («озоновые дыры»). Например, при запуске ракетоносителя космического корабля, а также двигатели самолетов выбрасывают в верхние слои атмосферы определенную массу оксидов азота (II).
Оксид азота (II) вступает в реакцию с озоном:
Это приводит к всевозможным природным катаклизмам (глобальное потепление, таяние ледников и айсбергов, цунами, тайфуны, сели, торнадо и т. д.).
Практическая работа №3
Получение кислорода и изучение его свойств
Цель: учащиеся самостоятельно проводят работу, изучают свойства кислорода. Знать свойства кислорода как окислителя.
Ход работы
1. Соберите прибор по рис. 30 (с. 88).
2. В колбу наберите немного раствора пероксида водорода с помощью капельной воронки.
3. Всыпьте в колбу заранее приготовленный диоксид марганца. Затем колбу закройте пробкой с газоотводной трубкой. Что наблюдаете?
4. Соберите выделившийся кислород в большие пробирки.
5. В железную ложку положите небольшой кусочек серы, зажгите его в пламени спиртовки и внесите в сосуд с кислородом, постепенно опуская ложечку.
6. После сжигания серы влейте в сосуд немного воды, закройте сосуд и хорошо взболтайте, затем подействуйте индикатором – метилоранжем.
Услуги по химии:
Лекции по химии:
Лекции по неорганической химии:
Лекции по органической химии:
Присылайте задания в любое время дня и ночи в ➔
Официальный сайт Брильёновой Натальи Валерьевны преподавателя кафедры информатики и электроники Екатеринбургского государственного института.
Все авторские права на размещённые материалы сохранены за правообладателями этих материалов. Любое коммерческое и/или иное использование кроме предварительного ознакомления материалов сайта natalibrilenova.ru запрещено. Публикация и распространение размещённых материалов не преследует за собой коммерческой и/или любой другой выгоды.
Сайт предназначен для облегчения образовательного путешествия студентам очникам и заочникам по вопросам обучения . Наталья Брильёнова не предлагает и не оказывает товары и услуги.
http://znaesh-kak.com/x/x/%D0%BE%D0%B7%D0%BE%D0%BD
http://natalibrilenova.ru/ozon/