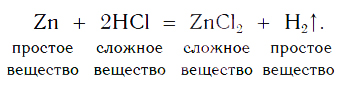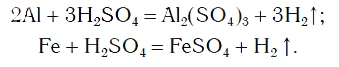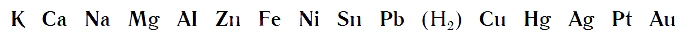Урок 24. Выделение водорода в реакциях кислот с металлами
В уроке 24 «Выделение водорода в реакциях кислот с металлами» из курса «Химия для чайников» познакомимся с рядом активности металлов, а также больше узнаем о кислотах в химических реакциях.
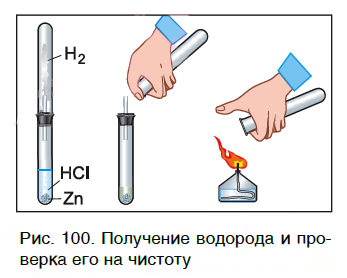
Характерное химическое свойство кислот — выделение из них водорода в реакциях с некоторыми металлами. Атомы металлов замещают атомы водорода в молекулах кислот, в результате чего водород выделяется в виде газа. В пробирку с хлороводородной кислотой опустим кусочек цинка. На поверхности металла образуются, а затем выделяются из раствора пузырьки газа. Соберем этот газ в пробирку и поднесем ее к пламени спиртовки (рис. 100). Мы услышим хлопок. Это свидетельствует о наличии в пробирке водорода.
Каплю образовавшегося раствора поместим на стеклянную пластинку и подогреем ее в пламени спиртовки. После испарения воды на пластинке остается вещество белого цвета. Опытным путем можно установить, что состав этого вещества выражается формулой ZnCl2.
Теперь мы можем записать уравнение реакции цинка с кислотой:
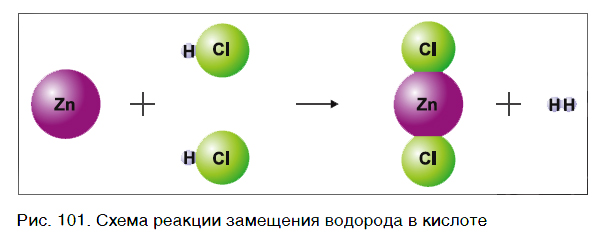
На рисунке 101 дана схема этой реакции. Из уравнения и поясняющей его схемы видим, что атомы цинка замещают атомы водорода в кислоте. В результате из простого вещества цинка и сложного вещества хлороводородной кислоты образуются два новых: сложное вещество ZnCl2 и простое вещество водород Н2.
Так же протекают реакции алюминия, железа, других металлов и с раствором серной кислоты:
Эти химические реакции подтверждают, что кислоты являются сложными веществами, состоящими из атомов водорода,
способных замещаться на атомы металла, и кислотных остатков.
Вытеснительный ряд металлов
При проведении опыта вы убедились, что алюминий энергично вытесняет водород из раствора хлороводородной кислоты. С железом реакция вытеснения водорода протекает менее энергично, а с медью вовсе не идет.
По интенсивности вытеснения водорода из кислот металлы можно разместить в ряд:
Его называют рядом активности или вытеснительным рядом металлов.
Чем левее расположен металл в вытеснительном ряду до водорода (Н2), тем активнее он вытесняет водород из кислот. Металлы, стоящие в ряду правее водорода, из кислот водород не вытесняют.
Зная расположение металлов в вытеснительном ряду, заранее можно предсказать:
- Будут ли реагировать металлы с кислотами с выделением водорода;
- Насколько активно будут протекать эти реакции.
Для получения водорода из кислот в лаборатории или школьном кабинете химии необходимо брать металлы, которые в вытеснительном ряду стоят до водорода. Но не каждый металл подходит для этих целей. Активные металлы натрий и калий реагируют с кислотами со взрывом, а реакции кислот с оловом и свинцом протекают медленно. Наиболее подходящими металлами для практического получения водорода являются цинк и алюминий. Как вы убедились, при проведении реакций этих металлов с раствором хлороводородной кислоты они протекают спокойно и достаточно быстро.
Краткие выводы урока:
- Кислоты — сложные вещества, состоящие из атомов водорода, способных замещаться на атомы металлов, и кислотных остатков.
- Металлы, стоящие в вытеснительном ряду до водорода, вытесняют его из кислот.
- В лаборатории водород получают в реакции металлов с кислотами.
Надеюсь урок 24 «Выделение водорода в реакциях кислот с металлами» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Водород – рождающий воду
Содержание
При горении водорода в кислороде образуется чистое, некоптящее и не имеющее четких границ пламя температурой до 2800°С.
Теоретически для полного сгорания 1 мг водорода требуется 0,5 мг кислорода. Практически в горелку на 1 мг водорода подается 0,25 мг кислорода.
История открытия водорода
Доподлино установить кто открыл водорода невозможно, поскольку он известен с XVI века. Алхимики заметили, что при взаимодействии железных опилок с соляной или серной кислотой выделяется «горючий воздух», или «искусственный воздух». Однако его все-таки считали воздухом, получившим почему-то способность гореть.
Но вот сторонник точных измерений Генри Кавендиш (Henry Cavendish) выделил водород из серной и соляной кислот железом, цинком, оловом. Он собирал его в газометре и узнал, что при горении «горючего воздуха» образуется чистая вода. Поэтому считается, что лавры открытия водорода принадлежат именно ему.
Однако окончательное суждение о «горючем газе», так же как и о кислороде, принадлежит Антуану Лорану Лавуазье (Antoine Laurent de Lavoisier). Он повторил опыт Кавендиша, поставил новые опыты и доказал, что «горючий воздух» — это простое вещество, что вода не простое тело, а химическое соединение двух элементов — водорода и кислорода. Лавуазье дал имя «горючему воздуху» hydrogene (от греч. «рождающий воду») .
Интересны первые русские наименования водорода: «водотворный газ», «водотвор». Легкость водорода, пожалуй, поразила первых наблюдателей больше, чем остальные его свойства. Думали даже, что он и есть тот таинственный с «отрицательным весом» флогистон, который, проникая в тела, сообщает им способность гореть.
В 1794 г. к водороду возник чисто военный интерес. В то время уже были изобретены воздушные шары, наполненные горячим воздухом, — монгольфьеры Их называли так в честь братьев французов Монгольфье, совершивших первый полет на таком аэростате в 1783 г.
Преимущества водорода перед нагретым воздухом были очевидны. Нагретый воздух обладал подъемной силой, пока он не остывал до температуры окружающего воздуха. Следовательно, чтобы совершить более или менее длительный полет, надо было под отверстием аэростата в гондоле пилота поддерживать огонь, подогревать воздух. Конечно, это было опасно и приводило к трагическим катастрофам. А водород всегда будет легче воздуха более чем в 14 раз. И его не надо нагревать, наоборот — беречь от огня.
Лавуазье разработал промышленный способ получения водорода, названный «железо-паровым». Заключался он в следующем. Пары воды из котла поступали в железные трубы, наполненные железными стружками. Трубы накалялись в жаровнях — протекала химическая реакция вытеснения водорода железом из воды с образованием железной окалины:
Избыток водяных паров, непрерывно поступающих в трубу, проходил через холодильник, а водород по трубам направлялся в аэростат и надувал его.
Когда железо израсходуется, его опять можно получить из накаленной окалины, если через трубу пропустить светильный газ. Уравнение показывает, что 3?56=168 г железа могут вытеснить 8 г водорода, или 4?22,4=89,6 л водорода.
Аэростаты, наполненные водородом, применили впервые революционные войска Франции в битве при Флёрюсе в 1794 г.
В войнах 1904-1905 и 1914-1918 гг. привязанные канатами аэростаты служили главным образом для наблюдения за прицельностью артиллерийского огня, за передвижением войск. Во время Великой Отечественной войны 1941-1945 гг. они защищали военные объекты от авиации противника. Летчики, опасаясь столкновений с аэростатом и канатами, летали на большой высоте, поэтому их бомбовые удары в значительной мере теряли прицельность.
Первый в мире полет на аэростате с научной целью совершил ученый Захаров Яков Дмитриевич в 1804 г. А в 1887 г. для наблюдения солнечного затмения и изучения воздуха поднялся в воздух Менделеев Дмитрий Иванович.
Получение водорода
В промышленности технический водород получают:
- электролизом воды;
- методом глубокого охлаждения газовых смесей, содержащих водород;
- железо-паровым способом;
- из водяного газа путем окисления содержащейся в нем окиси углерода водяным паром в присутствии катализатора;
- в специальных водородных генераторах воздействием серной кислоты на железную стружку и цинк.
Получение водорода из кислот
На первых порах источником для получения водорода служили кислоты. Так и в наше время в лабораториях часто получают его средневековым способом — действием цинка на серную кислоту. Реакция протекает по уравнению:
Вместо цинка можно взять железо в виде стружек или алюминий. Водород получается, загрязненный побочными продуктами разложения серной кислоты, и, если это требуется, его приходится очищать.
Добыча водорода из промышленных газов
Огромные количества водорода, необходимые современной промышленности, получают сейчас электролизом раствора щелочи и извлекают из промышленных газов — коксовальных печей, газов, получаемых при переработке нефти и др.
При переработке каменного угля на кокс дополнительно получается деготь и коксовый газ. В состав газа входит до 50-60% водорода (H2), 20-25% метана (СН4), окись углерода (СО), азот (N) и др.
В статье о свойствах гелия и способах его производства описан процесс получения гелия методом фракционной конденсации. Так же поступают и с коксовым газом. Но чтобы отделить водород от других составных частей, требуется очень глубокое охлаждение из-за низкой критической температуры водорода.
Производство водорода из воды
Наиболее широко распространенным способом производства водорода является — электролиз дистиллированной воды. В результате чего получают водород, кислород и некоторые примеси.
Единственным исходным сырьем для добычи водорода электролитическим методом служит вода. Чистая, дистиллированная вода обладает огромным сопротивлением и почти совершенно не проводит электрический ток. Вот почему для того чтобы сделать воду электропроводной, в ней нужно растворить какую-нибудь соль, кислоту или основание, которые дают ионы.
Через водный раствор щелочи (например: каустическая сода) пропускают постоянный электрический ток. При этом вода разлагается, и на отрицательном электроде (катоде) выделяется водород, а на положительном электроде (аноде) — кислород, также являющийся важным промышленным продуктом.
В результате получения 2 м 3 водорода, как побочный продукт получается 1 м 3 кислорода.
Большой расход электроэнергии является главным недостатком данного способа, поэтому применение водорода полученного при помощи электролиза целесообразно при одновременном использовании вместе с кислородом. В связи с этим в последнее время портативные водородные сварочные аппараты для газовой сварки и пайки пользуются все большей популярностью.
Применение водорода
Основными направлениями применения водорода являются:
- химическая промышленность – синтез аммиака, метанола, углеводородов;
- пищевая промышленность – получение пищевых белков;
- нефтехимия – нефтепереработка (гидрогенезационная очистка нефтепродуктов);
- автотранспорт – автомобили на газообразном и жидком водороде;
- машиностроение – для сварки и резки металлов.
Применение водорода в сварке
Водород использовался в качестве защитного газа еще при первых попытках защиты дугового пространства от воздуха. Однако водород может оказать в ряде случаев вредное воздействие. Это объясняется тем, что при применении водорода в металле сварных швов образуются дефекты в виде пор, а также является одним из главных факторов образования холодных трещин. С увеличением толщины свариваемых элементов пористость в металле сварных швов становится значительной. Поэтому его использование в дальнейшем было значительно ограничено. В чистом виде (и в виде водородно-азотных смесей, получаемых при диссоциации аммиака) он в настоящее время применяется при атомно-водородной сварке (хотя и сам этот способ заменен теперь другими, в частности сваркой неплавящимся электродом).
Если струю водорода пропускать через пламя вольтовой дуги, то водород диссоциирует на атомы с поглощением значительного количество тепла (103,6 ккал/моль) что приводит к значительному увеличению напряжения дуги. Она становится устойчивой только при повышении напряжения источника тока. Так, например, при режимах атомно-водородной сварки наиболее эффективной «звенящей» дугой при вольфрамовых электродах и силе тока 10-20 А напряжение дуги составляет около 100 А, напряжение холостого хода питающего источника должно быть не менее 200-220 В (обычно около 300 В). В этом случае водород является не только защитным газом, но и переносит тепловую энергию из дуги на поверхность не включенного в цепь тока изделия.
Образовавшийся атомный водород направляют на твердую свариваемую поверхность, где происходит нагревание и расплавление металла за счет поглощения тепла, которое выделяется при рекомбинации атомов до молекулярного водорода. Ассоциация атомарного водорода на холодной поверхности металла (в том числе и расплавленной, так как температура плавления большинства металлов ниже температуры возможного существования заметных количеств атомарного водорода) приводит к выделению тепла, потребленного в дуге на диссоциацию. За счет выделяющегося тепла температура свариваемой поверхности металла повышается до 3528-4028°С. Такая атомно-водородная сварка позволяет обрабатывать и сваривать самые тугоплавкие металлы, высококачественные стали, коррозионно-устойчивые материалы, цветные металлы.
Несмотря на то, что атмосфера, окружающая металл, при атомно-водородной сварке представляет собой смесь молекулярного и атомарного водорода, при отсутствии на металле значительного количества окислов швы получаются достаточно плотными и применительно к низкоуглеродистой стали не имеют большого количества диффузионно-подвижного и остаточного водорода.
При струйной защите иногда используется водяной пар. Однако в этом случае получается значительно меньшая стабильность качества сварных швов, чем при сварке с защитой дуги углекислым газом. В связи с этим такой процесс широкого распространения не получил.
При TIG сварке аустенитной нержавеющей стали с целью увеличения напряжения дуги, увеличения теплоэффективности и снижения оксидирования используют аргоно-водородные смеси газов (15% Н2). Более высокая температуру и сжатие дуги, в свою очередь увеличивает глубину проплавления металла. Однако при этом необходимо учитывать возможность вредного влияния растворяющегося в металле водорода. Более широко водород применяют в специальных областях сварки и металлургии, например в порошковой металлургии при спекании изделий из порошковых материалов.
В других случаях применение водорода и водородосодержащих газов, как защитных при дуговой сварке, нецелесообразно.
Применяют водород для составления плазмообразующих смесей при плазменной сварке и резке. Так, для защиты сварочной ванны от окисления при плазменной сварке легированной стали, меди, никеля и сплавов на его основе используют смесь аргона с 5-8% водорода.
Аргоно-водородную смесь, имеющую до 20% Н2, применяют при микроплазменной сварке. Наличие водорода в смеси обеспечивает сжатие столба плазмы, делает его более сконцентрированным. Кроме того, водород создает необходимую в ряде случаев восстановительную атмосферу.
Взрывоопасность водорода
При работе с водородом особое внимание следует обращать на герметичность аппаратуры и газовых коммуникаций, так как водород способен проникать через мельчайшие неплотности, образовывать с воздухом взрывоопасные концентрации. В смеси с кислородом (2:1) образует взрывчатую смесь, называемую гремучим газом.
- с воздухом 4-75 %
- с кислородом 4-96%
Температура самовоспламенения 510°С. Водород физиологически инертен, при высоких концентрациях вызывает удушье. При высоком давлении проявляется наркотическое действие. При работе в среде водорода необходимо пользоваться изолирующим противогазом (кислородным или шланговым).
Хранение и транспортировка водорода
Водород технический поставляют по ГОСТ 3022. Хранят и транспортируют водород в стальных баллонах вместимостью 40 и 50 дм 3 по ГОСТ 949 под давлением 15 МПа. Баллон окрашивается в темно-зеленый цвет с красной надписью «ВОДОРОД».
Характеристика водорода
Характеристики H2 представлены в таблицах ниже:
Коэффициенты перевода объема и массы H2 при Т=15°С и Р=0,1 МПа
| Масса, кг | Объем | |
|---|---|---|
| Газ, м 3 | Жидкость, л | |
| 0,0841 | 1 | 1,188 |
| 0,0708 | 0,842 | 1 |
| 1 | 11,891 | 14,126 |
Коэффициенты перевода объема и массы H2 при Т=0°С и Р=0,1 МПа
| Масса, кг | Объем | |
|---|---|---|
| Газ, м 3 | Жидкость, л | |
| 0,09 | 1 | 1,258 |
| 0,0708 | 0,975 | 1 |
| 1 | 11,124 | 14,126 |
Водород в баллоне
| Наименование | Объем баллона, л | Масса газа в баллоне, кг | Объем газа (м 3 ) при Т=15°С, Р=0,1 МПа |
|---|---|---|---|
| H2 | 40 | 0,54 | 6,0 |
Благодаря этой таблице теперь можно легко дать ответы на вопросы, которые очень часто задают сварщики:
- Сколько кубов (м 3 ) водорода в 40 литровом баллоне?
Ответ: 6,0 м 3 - Сколько кг водорода в баллоне?
Ответ: 0,54 кг - Сколько весит баллон с водородом?
Ответ:
58,5 кг — масса пустого баллона из углеродистой стали согласно ГОСТ 949;
0,54 — кг масса водорода в баллоне;
Итого: 58,5 + 0,54 = 58,94 кг вес баллона с водородом.
Рекомендуем к просмотру видео об открытии водорода, его характеристиках и производстве.
Получение водорода и изучение его свойств
Этот видеоурок доступен по абонементу
У вас уже есть абонемент? Войти
Данный урок является практическим занятием в рамках изучения темы «Вещества и их свойства». В ходе занятия проводятся опыты по получению водорода и проверке его на чистоту, а также рассматривается реакция горения водорода и его взаимодействие с оксидом меди (II).
http://weldering.com/vodorod-rozhdayushchiy-vodu
http://interneturok.ru/lesson/chemistry/8-klass/bvewestva-i-ih-prevraweniyab/poluchenie-vodoroda-i-izuchenie-ego-svoystv