Оксид углерода (II)
Оксид углерода (II)
Строение молекулы и физические свойства
Оксид углерода (II) («угарный газ») – это газ без цвета и запаха. Сильный яд. Небольшая концентрация угарного газа в воздухе может вызвать сонливость и головокружение. Большие концентрации угарного газа вызывают удушье.
Строение молекулы оксида углерода (II) – линейное. Между атомами углерода и кислорода образуется тройная связь, за счет дополнительной донорно-акцепторной связи:
Способы получения
В лаборатории угарный газ можно получить действием концентрированной серной кислоты на муравьиную или щавелевую кислоты:
НСООН → CO + H2O
В промышленности угарный газ получают в газогенераторах при пропускании воздуха через раскаленный уголь:
CO2 + C → 2CO
Еще один важный промышленный способ получения угарного газа — паровая конверсия метана. При взаимодействии перегретого водяного пара с метаном образуется угарный газ и водород:
Также возможна паровая конверсия угля:
C 0 + H2 + O → C +2 O + H2 0
Угарный газ в промышленности также можно получать неполным окислением метана:
Химические свойства
Оксид углерода (II) – несолеобразующий оксид . За счет углерода со степенью окисления +2 проявляет восстановительные свойства.
1. Угарный газ горит в атмосфере кислорода . Пламя окрашено в синий цвет:
2. Оксид углерода (II) окисляется хлором в присутствии катализатора или под действием света с образованием фосгена. Фосген – ядовитый газ.
3. Угарный газ взаимодействует с водородом при повышенном давлении . Смесь угарного газа и водорода называется синтез-газ. В зависимости от условий из синтез-газа можно получить метанол, метан, или другие углеводороды.
Например , под давлением больше 20 атмосфер, при температуре 350°C и под действием катализатора угарный газ реагирует с водородом с образованием метанола:
4. Под давлением оксид углерода (II) реагирует с щелочами. При этом образуется формиат – соль муравьиной кислоты.
Например , угарный газ реагирует с гидроксидом натрия с образованием формиата натрия:
CO + NaOH → HCOONa
5. Оксид углерода (II) восстанавливает металлы из оксидов .
Например , оксид углерода (II) реагирует с оксидом железа (III) с образованием железа и углекислого газа:
Оксиды меди (II) и никеля (II) также восстанавливаются угарным газом:
СО + CuO → Cu + CO2
СО + NiO → Ni + CO2
6. Угарный газ окисляется и другими сильными окислителями до углекислого газа или карбонатов.
Например , пероксидом натрия:
Способы получения углекислого газа
Углекислый газ не является редким и получают его как побочный продукт, что положительно сказывается на его стоимости. Поэтому он является самым дешевым газом, применяемым для защиты, металла сварного шва в процессе сварки. Кратко о способах производства углекислоты говорилось в статье о свойствах углекислого газа и теперь настало время рассмотреть их более подробно.
Содержание
В промышленном масштабе углекислый газ получают следующими способами:
- из известняка, в котором содержится до 40% СО2, кокса или антрацита до 18% CO2 путем их обжига в специальных печах;
- на установках, работающих по сернокислому методу за счет реакций взаимодействия серной кислоты с эмульсией мела;
- из газов, образующихся при брожении спирта, пива, расщепления жиров;
- из дымовых газов промышленных котельных, сжигающих уголь, природный газ и другое топливо. Дымовой газ содержит 12-20% СО2;
- из отходящих газов химических производств, в первую очередь синтетического аммиака и метанола. Отходящие газы содержат примерно 90% СО2.
На данный момент наиболее распространенным способом производства углекислоты является – получение из газов при брожении.
Получение углекислого газа из газов при брожении
Отходящий газ при брожении представляет собой почти чистый углекислый газ и является дешевым побочным продуктом производства.
На гидролизных заводах при брожении дрожжей с опилками выделяются газы, содержащие 99% CO2.
1 — бродильный чан; 2 — газгольдер; 3 — промывочная башня; 4 — предварительный компрессор; 5 — трубчатый холодильник; 6 — маслоотделитель; 7 — башня; 8 — башня; 9 — двухступенчатый компрессор; 10 — холодильник; 11 — маслоотделитель; 12 — цистерна.
Схема получения углекислого газа на гидролизных заводах
Газ из бродильного чана 1 подается насосами, а при наличии достаточного давления поступает самостоятельно в газгольдер 2, где происходит отделение от него твердых частиц. Затем газ поступает в промывочную башню 3, заполненную коксом или керамическими кольцами, где он омывается встречным потоком воды и окончательно освобождается от твердых частиц и растворимых в воде примесей. После промывки газ поступает в предварительный компрессор 4, где он сжимается до давления 400-550 кПа.
Так как при сжатии температура углекислого газа повышается до 90-100°С, то после компрессора газ поступает в трубчатый холодильник 5, где охлаждается до 15°С. Затем углекислота направляется в маслоотделитель 6, где отделяется масло, попавшее в газ при сжатии. После этого углекислый газ подвергается очистке водными растворами окислителей (KMnO4, K2Cr2P7, гипохромитом) в башне 7, а затем осушке активированным углем или силикагелем в башне 8.
После очистки и осушки углекислота поступает в двухступенчатый компрессор 9. На ступени I происходит сжатие его до 1-1,2 МПа. Затем углекислый газ поступает в холодильник 10, где охлаждается со 100 до 15°C, проходит маслоотделитель 11 и поступает на II ступень компрессора, где сжимается до 6-7 МПа, превращается в жидкую двуокись углерода и собирается в цистерну 12, из которой производится заправка стандартных баллонов или других емкостей (танков).
Принципиально процесс производства углекислого газа другими методами ничем не отличается от вышеуказанного: сначала газ очищается, потом производят осушку, а на последнем этапе охлаждение и сжатие для превращения в жидкость, поскольку в данном виде его удобно хранить и транспортировать.
Оксид углерода CO(II) — угарный газ
Оксид углерода CO(II) или монооксид углерода — бесцветный газ, не имеющий запаха, плохо растворимый в воде.
Оксид углерода CO(II) рядовому обывателю более известен, как угарный газ, который стал причиной трагических смертей десятков тысяч людей.
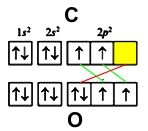
В молекуле оксида углерода (II) атомы кислорода и углерода соединены тройной связью.
- кислорода — 1s 2 2s 2 2p 4
- углерода — 1s 2 2s 2 2p 2
У обоих элементов имеется по два неспаренных электрона на внешнем энергетическом уровне, которые и образуют две ковалентные связи (обозначены зеленым цветом). Третья связь образуется по донорно-акцепторному принципу — атом углерода (акцептор) предоставляет свою свободную орбиталь (желтая ячейка), на которой размещается электронная пара кислорода (донор) (красный цвет).
В молекуле угарного газа атом углерода принимает валентность 3, но степень окисления +2. По этой причине, для оксида углерода CO(II) характерны реакции присоединения, в которых он играет роль восстановителя:
- на воздухе оксид углерода CO(II) горит, образуя углекислый газ:
2C +2 O+O2 0 = 2C +4 O2↑+Q - восстановительные свойства угарного газа нашли широкое применение в металлургических процессах получения металлов из их оксидов (руд):
CO+FeO = CO2↑+Fe
CO+CuO = CO2↑+Cu - в присутствии угля, который выполняет роль катализатора, на свету угарный газ взаимодействует с хлором с образованием отравляющего вещества фосген:
CO+Cl2 = COCl2
Поскольку монооксид углерода не образует солей, при н.у. угарный газ не взаимодействует с кислотами и щелочами.
В промышленных целях угарный газ получают взаимодействием углекислого газа с раскаленным углем:
CO2+C = 2CO
В лабораторных условиях CO получают действием концентрированной серной кислоты на муравьиную кислоту при высокой температуре:
HCOOH → CO↑ + H2O
Угарный газ также образуется в процессе неполного сгорания топлива:
CH4+1½O2 = CO+2H2O
Именно такие случаи приводят зачастую к непоправимым трагедиям, — люди «угорают», чаще всего в домах с печным отоплением, когда в целях сохранения тепла на ночь закрывается заслонка, препятствующая выходу продуктов горения в вытяжную трубу, но при этом дрова или уголь еще полностью не перегорели. В результате чего, образующийся угарный газ накапливается в помещении, и люди, вдыхая его во сне, умирают.
Второй, самый распространенный случай гибели людей от угарного газа — вдыхание выхлопных газов автомобиля с двигателем внутреннего сгорания в закрытом, плохо проветриваемом помещении. Сколько таких случаев было, когда водители грелись и погибали в закрытых гаражах.
Почему умирают от вдыхания угарного газа
Все дело в гемоглобине, который содержится в красных кровяных тельцах — эритроцитах. Гемоглобин — это белок, который транспортирует кислород от легких к тканям человека. Коварность угарного газа заключается в том, что CO легко преодолевает альвеолярно-капиллярную мембрану, после чего растворяется в плазме крови, и начинает «цепляться» к эритроцитам, вытесняя из гемоглобина кислород с образованием карбоксигемоглобина — в молекуле гемоглобина молекулы угарного газа соединяются с атомами железа, после чего кислород остается «не при делах». Данная реакция происходит по причине того, что монооксид углерода в 250(!) раз более активно вступает в реакцию с гемоглобином, нежели кислород. Таким образом, поступление кислорода к тканям организма нарушается, и в течение короткого времени наступает смерть человека, который задыхается «изнутри».
Концентрация угарного газа 1,2% в воздухе является смертельной — достаточно всего нескольких вдохов, чтобы человек потерял сознание, смерть наступает в течение 2-3 минут.
Оксид углерода CO2(IV) — углекислый газ
Молекула углекислого газа имеет линейное строение (углерод имеет валентность 4, и степень окисления +4):
Атомы углерода и кислорода связаны ковалентными полярными связями, но сама молекула неполярна.
Углекислый газ (диоксид углерода) также, как и угарный газ, не имеет цвета, запаха, плохо растворим в воде, но, растворяется лучше, чем CO. При низких температурах углекислота переходит в жидкое, а затем в твердое состояние (сухой лед).
Углекислый газ реагирует со следующими веществами:
- при растворении в воде образует угольную кислоту:
CO2+H2O = H2CO3 - с основными оксидами и основаниями CO2 взаимодействует, как кислотный оксид, образуя соли, которые называются карбонатами:
Na2O+CO2 = Na2CO3 - при высоких температурах углекислый газ проявляется свойства окислителя — активные металлы могут гореть в среде углекислого газа, отнимая у него кислород:
CO2+C = 2CO
CO2+2Mg = 2MgO+C
Получение и применение углекислого газа
- в промышленности — обжигом известняка:
CaCO3 = CaO+CO2↑ - в лаборатории — действием кислоты на соли угольной кислоты:
Na2CO3+2HCl = 2NaCl+H2O+CO2↑ - в природе углекислый газ выделяется при гниении и горении органических веществ:
C+O2 = CO2↑
Углекислый газ нашел широкое применение в пищевой промышленности, в качестве основного компонента газированных напитков. Сухой лед применяется в качестве охладителя. Углекислотные огнетушители применяются при тушении похара, если температура горения не превышает 1000°C.
Если вам понравился сайт, будем благодарны за его популяризацию 🙂 Расскажите о нас друзьям на форуме, в блоге, сообществе. Это наша кнопочка:
Код кнопки: 
Политика конфиденциальности Об авторе
http://weldering.com/sposoby-polucheniya-uglekislogo-gaza
http://prosto-o-slognom.ru/chimia/506_oksid_ugleroda_CO.html