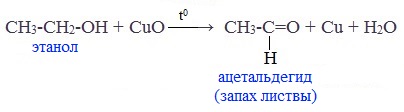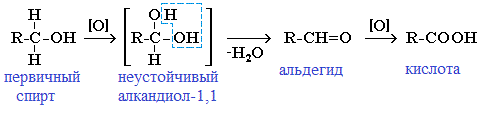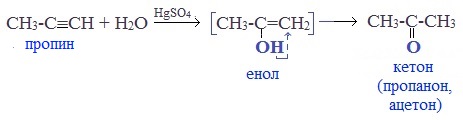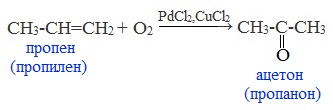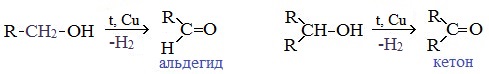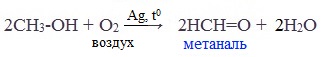Как можно получить альдегиды и кетоны уравнения
1. Окисление спиртов
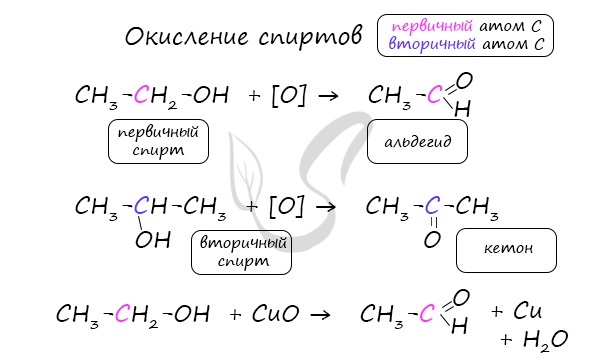
В лаборатории карбонильные соединения получают окислением спиртов в жестких условиях в присутствии сильных окислителей (дихромата калия К2Cr2O7 или перманганата калия КМnО4) в серной кислоте Н2SO4. В качестве окислителя можно использовать оксид меди (II) при нагревании.
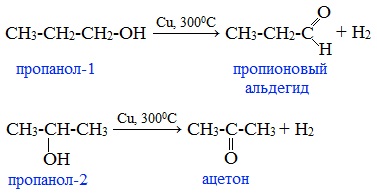
При окислении первичных спиртов образуются альдегиды:
Видеоопыт «Окисление этилового спирта оксидом меди (II)»
Первичные спирты при окислении образуют альдегиды, которые затем легко окисляются до карбоновых кислот:
Чтобы предотвратить превращение альдегида в кислоту, его отгоняют в ходе реакции (tкип альдегида, не образующего межмолекулярные водородные связи, ниже tкип спирта и кислоты).
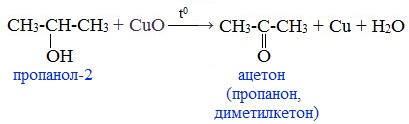
При окислении вторичных спиртов образуются кетоны:
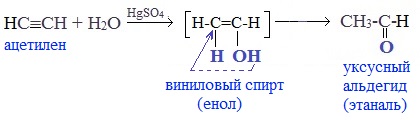
Присоединение воды к ацетилену происходит в присутствии катализатора соли ртути (II) и идет через образование неустойчивого непредельного спирта (енола), который изомеризуется в уксусный альдегид (в случае ацетилена):
Кетоны получают при гидратации других гомологов ряда алкинов:
Раньше это был промышленный способ получения карбонильных соединений. В настоящее время этот способ находит ограниченное применение из-за загрязнения получаемых продуктов токсичными солями ртути и относительной дороговизны.
3. Каталитическое окисление алкенов кислородом воздуха
Этим способом в промышленности получают уксусный альдегид — окислением этилена кислородом воздуха (Вакер-процесс).
Эта реакция протекает в присутствии катализатора – смеси PdCl2 и CuCl2 и температуре 100 0 С:
Этим экономичным способом получают низшие альдегиды и кетоны.
Этот промышленный способ более перспективен, чем гидратация алкинов, при которой используются токсичные ртутные катализаторы.
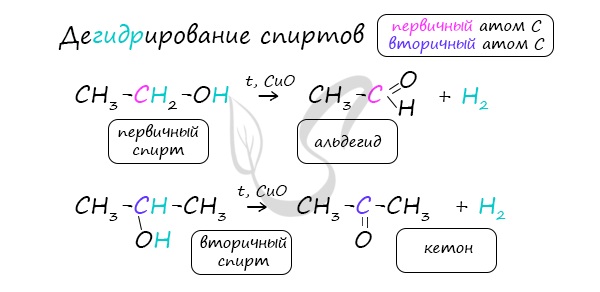
4. Каталитическое дегидрирование спиртов
В промышленности альдегиды и кетоны получают дегидрированием спиртов, пропуская пары спирта над нагретым катализатором (Cu, соединения Ag, Cr или Zn).
Первичные спирты окисляются до альдегидов, а вторичные – до кетонов.
Этот способ получения объясняет суть названия «альдегид» (от лат. alconol dehydrogenatum – спирт, от которого «отняли» водород).
Этот способ позволяет получать карбонильные соединения, в особенности альдегиды, без побочных продуктов окисления.
В 1835 г. немецкий химик Ю. Либих выделил индивидуальное вещество, молекула которого содержала на два атома водорода меньше, чем этанол. Ученый установил состав этого соединения – С2Н4О и назвал его альдегидом (от лат. al conol dehyd rogenatum — т.е. дегидрированный спирт, «спирт, лишенный водорода»).
В 1867 г. немецкий химик-органик А. Гофман, пропуская пары метилового спирта над раскаленной платиновой спиралью, получил газообразное вещество состава СН2О, молекула которого отличается от открытого Либихом альдегида на группу -СН2— . Именно это соединение (муравьиный альдегид) открывает гомологический ряд альдегидов.
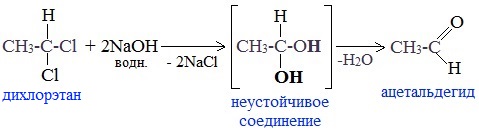
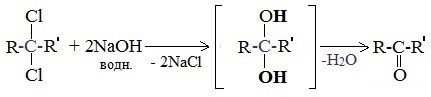
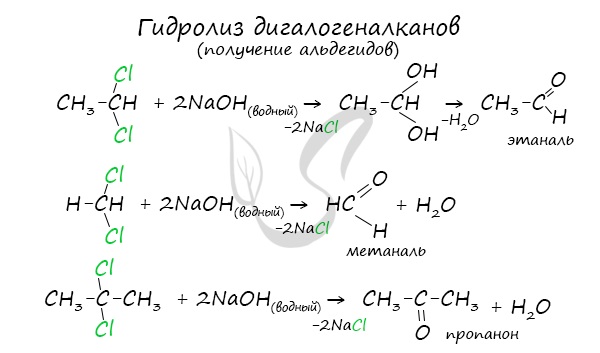
5. Щелочной гидролиз дигалогеналканов
Реакция протекает при действии водных растворов щелочей на дигалогензамещенные углеводороды, содержащие два атома галогена у одного и того же атома углерода.
При щелочном гидролизе дигалогеналканов образуются двухатомные спирты, в которых две группы ОН соединены с одним атомом углерода. Эти вещества неустойчивы и при отщеплении воды, превращаются в карбонильные соединения.
Если два атома галогена связаны с первичным атомом углерода, то образуются альдегиды:
При гидролизе дигалогеналканов, содержащих атомы галогена у вторичного атома углерода, образуются кетоны:
Это лабораторный способ получения карбонильных соединений.
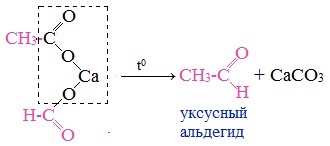
6. Пиролиз солей карбоновых кислот
При пиролизе (термическое разложение) кальциевых, бариевых солей карбоновых кислот образуются соответствующие карбонильные соединения. Из смешанной соли муравьиной и другой карбоновой кислоты получают альдегиды, а в остальных случаях образуются кетоны.
Это лабораторный способ получения карбонильных соединений.
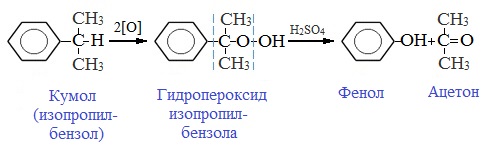
7. Кумольный способ получения ацетона (наряду с фенолом)
Простейший кетон – ацетон – получают кумольным методом вместе с фенолом:
Это промышленный способ получения ацетона.
Преимущества метода: безотходная технология (выход полезных продуктов > 99%) и экономичность. В настоящее время кумольный способ используется как основной в мировом производстве фенола.
Получение формальдегида
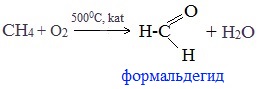
1. Окисление метана
Формальдегид в промышленности можно получить окислением метана кислородом воздуха при высоких температурах с использованием катализатора:
2. Окисление метанола
Основной промышленный способ получения формальдегида – окисление метанола с использованием серебряного катализатора при температуре 650 0 С и атмосферном давлении:
Реакция происходит на раскаленной серебряной сетке, через которую проходят пары ментола, смешанные с воздухом. Реакция настолько экзотермична, что выделяющейся в ходе ее теплоты достаточно для того, чтобы поддерживать сетку в раскаленном состоянии.
В настоящее время разработан перспективный способ высокотемпературного окисления метанола с использованием железомолибденовых катализаторов:
Альдегиды
Альдегиды — летучие жидкости органического состава, являющиеся продуктом неполного окисления спиртов. Карбонильная группа в молекулах альдегидов связана с одним атомом водорода и одной группой R.
Не часто встречаются в природе в отдельном виде, но, несомненно, играют важную роль в физиологических процессах растений и животных. Общая формула альдегидов CnH2nO.
Многие альдегиды имеют специфический запах. Высшие альдегиды, в особенности непредельные, используются в пищевой промышленности и парфюмерии.
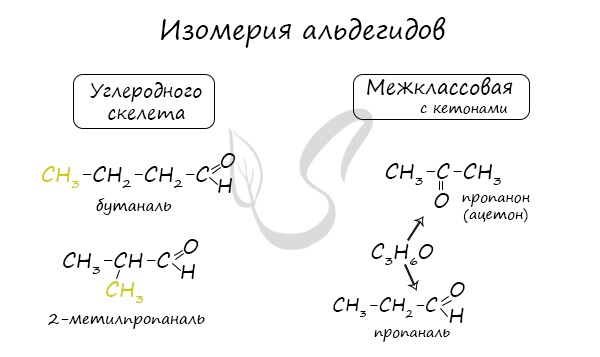
Номенклатура и изомерия альдегидов
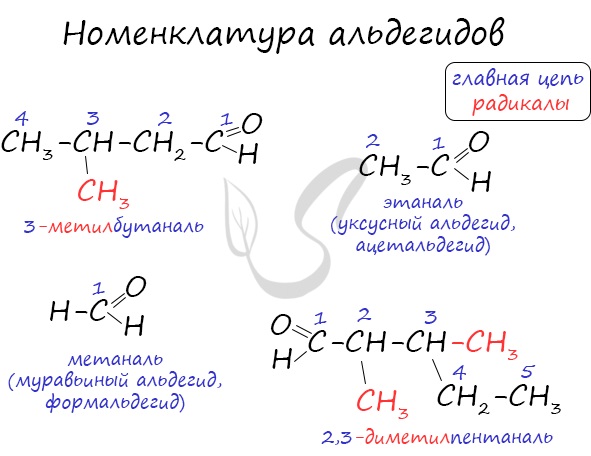
Названия альдегидов формируются путем добавления суффикса «аль» к названию алкана с соответствующим числом атомов углерода: метаналь, этаналь, пропаналь, бутаналь, пентаналь и т.д.
Вы можете встретить их молекулярные формулы, где группа OH записана наоборот — HO. Например: метаналь — HCHO, этаналь — CH3CHO, пропаналь — C2H5CHO. Это делают специально для того, чтобы их было легче отличить от спиртов.
Многие альдегиды имеют тривиальные названия. Наиболее известные: метаналь — формальдегид, этаналь — ацетальдегид. Замечу, что формалином называется 40% раствор формальдегида.
Для альдегидов характерна структурная изомерия: углеродного скелета, межклассовая изомерия с кетонами.
Получение альдегидов и кетонов
- Окисление спиртов
Важно заметить, что при окислении первичных спиртов образуются альдегиды, при окислении вторичных спиртов — кетоны. Окисление с помощью оксида меди относится к лабораторным способам получения альдегидов.
Этот способ также просто осуществить в лабораторных условиях. При пиролизе (нагревании без доступа кислорода) кальциевых или бариевых солей карбоновых кислот возможно получение кетонов.
В присутствии катализатора и при нагревании спиртов от гидроксогруппы и прилежащего к ней атома углерода отщепляется по атому водорода. В результате образуется карбонильная группа.
Реакцией Кучерова называют гидратацию алкинов в присутствии солей двухвалентной ртути.
В результате такой реакции ацетилен превращается в уксусный альдегид. Все остальные его гомологи: пропин, бутин, пентин и т.д. превращаются в соответствующие кетоны.
Для получения альдегида два атома галогена должны находиться у первичного атома углерода, для получения кетонов — у вторичного.
В результате такого гидролиза образуются двухатомные спирты, в которых две OH-группы прилежат к одному атому углерода. Такие соединения неустойчивы и распадаются на карбонильное соединение (альдегид или кетон) и воду.
В промышленности окислением метана при температуре 500 °C и в присутствии катализатора получают формальдегид.
В прошлой теме, посвященной фенолам, мы касались данного способа. В результате такой реакции образуется не только фенол, но и ацетон.
Химические свойства альдегидов и кетонов
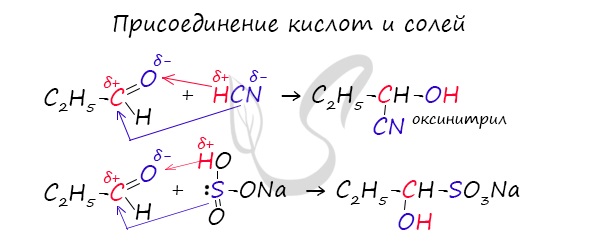
Запомните, что для альдегидов и кетонов характерны реакции присоединения по карбонильной группе. Это является важным отличием альдегидов от карбоновых кислот, для которых реакции присоединения не характерны.
Для понимания механизма реакции важно вспомнить об электроотрицательности. В карбонильной группе кислорд, как более электроотрицательный элемент, тянет электронную плотность на себя от углерода. На атоме кислорода возникает частичный отрицательный заряд (δ-), а на атоме углерода частичный положительный (δ+).
Основы школьного курса физики подсказывают, что отрицательный заряд притягивает положительный: именно так и будет происходить при присоединении различных молекул к карбонильной группе альдегидов и кетонов.
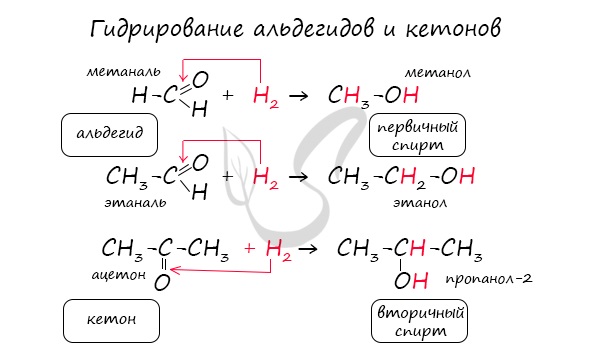
Реакция гидрирования альдегидов происходит по типу присоединения, сопровождается разрывом двойной связи в карбонильной группе. Гидрирование альдегидов приводит к образованию первичных, а гидрирование кетонов — вторичных спиртов.
В результате полного окисления, горения, образуется углекислый газ и вода.
Альдегиды легко окисляются до карбоновых кислот в лабораторных условиях. Это осуществляется с помощью известной реакции серебряного зеркала. Данная реакция является качественной для альдегидов.
Кетоны, в отличие от альдегидов, в реакции окисления не вступают.
Обратите особое внимание, что при написании реакции с аммиачным раствором серебра в полном виде, правильнее будет указать не кислоту, а ее аммиачную соль. Это связано с тем, что выделяющийся аммиак, который обладает основными свойствами, реагирует с кислотой с образованием соли
Важно заметить, что при окислении метаналя, образовавшаяся муравьиная кислота тут же окисляется до угольной кислоты, которая распадается на углекислый газ и воду. Это связано с интересным фактом — наличием альдегидной группы у муравьиной кислоты.
Окисление также возможно другим реагентом — гидроксидом меди II. Эта реакция также относится к качественным для альдегидов, в результате образуется кирпично-красный осадок оксида меди I.
© Беллевич Юрий Сергеевич 2018-2022
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Химия
План урока:
Приятный цветочный запах духов, аромат ванильных булочек, корицы и фруктов кроются в альдегидах и кетонах. Жидкость для снятия лака и строительные растворители также производят из карбонильных соединений. Без альдегидов и кетонов невозможно представить жизнь человека.
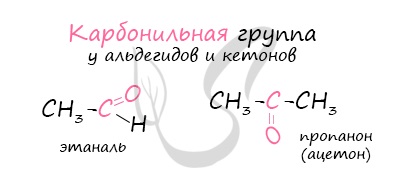
Карбонильные соединения – молекулы, содержащие карбонильную группу С=О. Они состоят из двух классов– альдегидов (R-CHO) и кетонов (R-CO-R’).
Общая формула гомологического ряд карбонильных соединений: CnH2nO.
Строение альдегидов и кетонов
Для карбонильных (входящих в состав функциональной группы альдегидов или кетонов)углеродных атомов характерна sp 2 -гибридизация. Все σ-связи располагаются под углом 120˚.
Кислородный атом более электроотрицателен, поэтому связь С=О поляризована. Он стягивает на себя электронную плотность, поэтому на кислороде образуется частично отрицательный заряд δ — , а на углероде из функциональной группы – частично положительный заряд δ + .
Классификация альдегидов и кетонов
В классификации заключено отличительное строение молекулы. В основе одной из классификаций лежит строение радикала.
Также альдегиды и кетоны можно классифицировать по количеству карбонильных групп.
Номенклатура альдегидов и кетонов
В соответствии с систематической номенклатурой в альдегидах добавляется суффикс «-аль» (например, метанАЛЬ), а в кетонах –«-он» (например, метанОН).
Алгоритм составления названия
- Нахождение главной углеродной цепи.
- Нумерация главной цепи, начиная с углеродного атома функциональной группы.
- Название углеводородного радикала.
- Если в молекуле присутствует альдегидная группа, то к названию прибавляется суффикс -аль. Если в соединении есть одна кетонная группа, то к названию прибавляется суффикс -он, а есть кетонных группы две, то к названию прибавляется суффикс -дион.
Гомологический ряд альдегидов и кетонов
Ряд альдегидов начинается с соединения с одним углеродным атомом – с метаналя. Он содержится во многих природных объектах, например, в деревьях. Характерный запах новой мебели – это запах метаналя, который при больших концентрациях опасен для здоровья человека и животных.
Гомологический ряд кетонов начинается с пропанона. Это соединение широко известен как хороший растворитель. Ацетон характеризуется резким характерным запахом.
Изомерия карбонильных соединений
Для карбонильных соединений свойственна как структурная, так и пространственная изомерия. Пространственная изомерия включает оптическую и цис-транс. Оптическая изомерия возможна при наличии ассиметричного атома углерода в молекуле, а цис-транс-изомерия – при наличии кратной связи.
Оптическая изомерия альдегида.
Структурная изомерия альдегидов
Структурная изомерия кетонов
Способы получения альдегидов и кетонов
Карбонильные соединения можно получить несколькими способами.
Окисление спиртов
Окисление протекает при нагревании. Альдегиды получают с помощью реакций окисления первичных спиртов, а кетоны – вторичных.
Дегидрирование спиртов
Реакция заключается в пропускании спиртовых паров над медью.
Взаимодействие алкинов с водой, или реакция Кучерова
Для проведения реакции необходим катализатор в виде соли ртути (II).
Гидролиз дигалогенпроизводных алканов
В ходе щелочного гидролиза образуется диол, содержащий две гидроксильные группы –ОН у одного атома углерода. Эта структура неустойчива, поэтому быстро образуется в альдегид или кетон.
Пиролиз солей карбоновых кислот
Для проведения данной реакции необходимо нагревание и наличие двухвалентных металлов. В результате образуются кетоны и карбонаты.
Кумольный метод получения пропанона
В промышленности пропанон, или более известный как ацетон, получают с помощью каталитического окисления кумола. Синтез пропанона проходит в два этапа.
Физические свойства альдегидов и кетонов
У соединений этого класса атомы не могут формировать водородные связи. Эта особенность отражается в низких температурах плавления и кипения, по сравнению со спиртами. У кетонов температура плавления и кипения немного выше, чем у альдегидов.
Существование в виде характерно только для формальдегида. Альдегиды с двумя-пятью и кетоны с тремя-четырьмя углеродными атомами – жидкости. Агрегатное состояние высших соединений – твердое. Низшие карбонильные молекулы растворимы в воде, а по мере увеличения углеродной цепи эта способность падает. Все альдегиды и кетоны хорошо растворимы в органических растворителях.
Особенность представителей класса заключается в особенных ароматах. Низшие альдегиды и кетоны отличаются резким запахом, средние имеют неприятный запах, а высшие обладают цветочными ароматами. Альдегиды опасны при вдыхании, т.к. поражают слизистые, а также оказывают негативное влияние на нервную систему.
Формальдегид – опасный для здоровья бесцветный газ. Его можно отличить по резкому запаху. Формальдегид относится к группе веществ раздражающего или слезоточивого действия. Водный раствор 40-% формальдегида – формалин, который обладает дезинфицирующим эффектом и используется для хранения биологических объектов.
Ацетальдегид – бесцветная жидкость с низкой температурой кипения в 21˚С. Обладает запахом зеленой листвы. Негативно влияет на организм человека и животных.
Некоторые альдегиды люди используют как источник витаминов. Например, в пиродоксале содержится витамин В6.
Некоторые насекомые в качестве защиты используют сильные запахи, в состав которых входят альдегиды. Эти соединения оказывают раздражающее действие.
Химические свойства альдегидов и кетонов
Реакции определяются наличием группы С=О, которая создает активное вещество. Для альдегидов свойственна большая реакционная способность по сравнению с кетонами.
Реакции присоединения
Данные реакции проходят по двойной связи.
- Взаимодействие с водородом
Гидрирование альдегидов приводит к образованию первичных спиртов, а кетонов – вторичных.
Гидратация возможна только для формальдегида и уксусного альдегида. В результате гидратации формальдегида синтезируется гидратная форма, которая существует только при низких температурах.
При взаимодействии спиртов и альдегидов образуются полуацетали, которые существуют только при низких температурах. Реакции протекает при участии катализатора – кислоты или щелочи.
При реакции полуацеталя с еще одной молекулы спирта в присутствии протона Н + полуацетальный гидроксил замещается на алкоксильную группу и образуется ацеталь.
- Присоединение циановодородной кислоты
Окисление
Альдегиды легко поддаются окислению. Кетоны окисляются только при участии сильных окислителей и при высоких температурах.
- Окисление гидроксидом меди (II)
Для данной реакции требуется свежеприготовленный гидроксид меди (II). Характерная черта реакции – образование краснокирпичного осадка оксида меди (I)Cu2O.
- Окисление аммиачным раствором оксида серебра
Особенность данной реакции заключается в том, что на стенках пробирки образуется небольшой слой металлического серебра («серебряное зеркало»).
Упрощенная форма уравнения:
Окислителями могут быть перманганаты и соединения хрома (VI).
Кетоны подвергаются окислению только под действием перманганатов и дихроматов при нагревании.
Реакции замещения
При взаимодействии с галогенами образуется галогензамещенный (у ближайшего к функциональной группе атома углерода) альдегид или кетон.
Поликонденсация
Формальдегид может реагировать с фенолом при наличии катализатора – кислоты или щелочи.
Полимеризация
Реакция полимеризации возможна для легких альдегидов.
Применение альдегидов и кетонов
Карбонильные соединения широко применяются во многих отраслях. Им характерна высокая реакционная активность.
Формальдегид применяется для получения пластмасс, формальдегидных смол, а также в производстве лекарств и продуктов органического синтеза и в обработке кож в кожевенной промышленности. При взаимодействии формальдегида и аммиака образуется уротропин – мочегонный препарат. Иногда прессованный уротропин используют как сухое горючее.
Ацетальдегид используется в получении уксусной кислоты, уксусного ангидрида, этилацетата и др.
Ацетон применяется в лакокрасочной промышленности, в производстве ацетатного шелка, пироксилина (бездымного пороха), киноплёнки.
Метаналь в основном используют для получения формальдегидной смолы, которая применяется в производстве пластмасс, клея, лаков.
Ванилин – альдегид, который используют в пищевой промышленности (в особенности при изготовлении выпечки) и парфюмерии. Он имеет характерный сладкий запах.
Цитраль – альдегид с цитрусовым ароматом. Его применяют в качестве отдушки моющих средств и косметики. Цитраль также входит в состав организмов муравьев. Он используется в медицине для понижения давления, а также для изготовления препаратов улучшающих зрение, антисептиков и антибактериальных средств.
Бензальдегид содержится в эфирных маслах и обладает запахом горького миндаля. Он в виде гликозида содержится в семенах миндаля, косточках вишни, абрикоса и персика.
http://studarium.ru/article/189
http://100urokov.ru/predmety/aldegidy-i-ketony