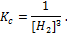Как написать кинетическое уравнение для гетерогенной реакции
 [ Ответ на тему ] [ Ответ на тему ] |

 |
| Автор | Тема: Гетерогенные хим реакции. Нельзя не помочь! | ||||
| DARvolok Пользователь Ранг: 18 |  11.11.2012 // 20:12:51 Напишите кинетическое уравнение для гетерогенной реакции 11.11.2012 // 20:12:51 Напишите кинетическое уравнение для гетерогенной реакцииесли известно, что при увеличении концентрации вещества К в 2,4 раза скорость реакции возрастает в 1, 55 раза. Как изменится скорость реакции при увеличении общего давления в системе в 4 раза? Если поможете, Вы прямо не знаю на сколько я буду вам благодарен. | ||||
| ANCHEM.RU Администрация Ранг: 246 |  | ||||
| AndRay Пользователь Ранг: 16 |  11.11.2012 // 23:00:20 11.11.2012 // 23:00:20
если известно, что при увеличении концентрации вещества К в 2,4 раза скорость реакции возрастает в 1, 55 раза. Как изменится скорость реакции при увеличении общего давления в системе в 4 раза? Если поможете, Вы прямо не знаю на сколько я буду вам благодарен. К стенке поставят, что ли, если решение не предоставишь? Записываем уравнения скорости до и после конца света: v1 = K*[K1]^x — до изменения концентрации в-ва K так как v2 / v1 = 1.55 и [K2] / [K1] = 2.4, то получаем такую штуку: 2,4^x = 1.55 х = lg 1.55 / lg 2.4 = 0,5 Тогда кинетическое уравнение этой долбаной реакции: Так как p = CRT, то для парциальных давлений уравнение скорости будет подобным: v = K*[K]^0.5 = K*(p(K)/(RT))^0.5 = (K/(RT)^0.5)*p(K)^0.5 = Kp*p(K)^0.5, то есть: Pобщ = p(K)*N(K), где N(K) — мольная доля К N(K) после увелич Pобщ (общее давление) не меняется, тогда: P2 общ / P1 общ = p2(K)*N / p1(K)*N P2 общ / P1 общ = p2(K) / p1(K) P2 общ / P1 общ = 4 p2(K) =4*p1(K) — парциальн давл К после увелич общ давл в 4 раза тоже увелич в 4 раза. Ну по скорости реакций: v1 = Kp*p1(K)^0.5 все | ||||
| DARvolok Пользователь Ранг: 18 |  12.11.2012 // 18:18:00 12.11.2012 // 18:18:00
Записываем уравнения скорости до и после конца света: Хах) Неплохое начало))) Особенности кинетики гетерогенных реакцийГетерогенные реакции идут на поверхности раздела фаз, поэтому особенностью кинетики этих реакций является влияние площади реакционной поверхности (S) на скорость реакции. Если в реакции участвуют твердые или жидкие вещества (не растворы), то их концентрация в кинетическом уравнении, как и в законе действующих масс для равновесия, не учитывается, а константа скорости равна Например, для реакции кинетическое уравнение имеет вид: Гетерогенные реакции являются многостадийными: 1. подвод реагентов к границе раздела; 2. адсорбция на поверхности; 3. химическое взаимодействие (может протекать в несколько элементарных стадий); 4. десорбция продуктов реакции; 5. отвод продуктов реакции от поверхностираздела фаз (диффузия) в объем системы. Скорость процесса определяется самой медленной стадией. Сказать, какая из стадий будет самой медленной заранее невозможно, так как законы происходящих процессов сильно отличаются друг от друга и их нельзя свести к одному уравнению (виду). В качестве типичного примера гетерогенной реакции рассмотрим лабораторный метод получения водорода из металлического цинка и разбавленной серной кислоты: Рис. 3.6Реакции взаимодействия одной крупной или нескольких мелких гранул цинка с серной кислотой. Цинк в виде гранул (кусочки металла неправильной формы и разной величины) помещают в разбавленный раствор серной кислоты и собирают выделяющийся газообразный водород. В пробирке с одной крупной гранулой реакция идет заметно медленнее (рис. 3.6). При одинаковой массе цинка в пробирках количество выделившегося водорода в обоих опытах будет одинаковым, но в пробирке с мелкими гранулами реакция закончится быстрее. Причина в том, что реакция между цинком и раствором серной кислоты идет только на поверхности контакта гранул с раствором (граница раздела фаз), а общая поверхность у нескольких мелких гранулбольше, чем у одной крупной гранулы той же массы. Цинк в виде порошка для этой реакции использовать просто опасно – реакция начинает идти настолько быстро, что смесь выплескивается из пробирки.Для такой гетерогенной реакции уже нельзя записать кинетическое уравнение вида: Один из членов этого уравнения – «молярная концентрация цинка» — не имеет смысла, поскольку цинк находится в твердой фазе. Из опыта мы видим, что на скорость гетерогенной реакции влияет степень раздробленности твердого вещества. В принципе, этот фактор может учитываться (чисто экспериментально) константой скорости реакции – тогда для реакций с одной крупной или несколькими мелкими гранулами численные значения k будут разными, а кинетическое уравнение реакции в общем случае примет вид: Но и такое уравнение не сможет достаточно хорошо описывать скорость данной реакции. Во-первых, в ходе реакции гранулы постепенно уменьшаются в размерах, площадь их поверхности меняется и константа скорости реакции k уже не может учитывать это изменение. Если использовать гранулы из очень чистого цинка, то к ним «прилипает» образующийся водород и площадь контакта реагентов меняется непредсказуемо. Во-вторых, на поверхности раздела фаз концентрация серной кислоты совсем не такая, как в верхних слоях раствора. В зоне реакции активно образуется раствор соли ZnSO4, который вытесняет раствор серной кислоты с поверхности гранул. Итак, в общем случае скорость гетерогенной реакции зависит от: а) скорости подвода реагентов к границе раздела фаз; б) скорости реакции на поверхности раздела фаз, которая зависит от площади этой поверхности; в) скорости отвода продуктов реакции от границы раздела фаз. Химическое равновесие Многие химические реакции не протекают до конца, то есть исходные реагенты не полностью превращаются в продукты. Такие реакции начинают протекать в одном направлении, затем за счет взаимодействия продуктов реакции идут в обратном направлении, то есть являются двусторонними. Их называют химически обратимыми. Химические реакции могут быть практически необратимыми и совершенно необратимыми. Например, реакция практически необратима; лишь при температурах в несколько тысяч градусов вода распадается на Н2 и О2. Примером совершенно необратимых реакций является разложение взрывчатых веществ, для которых DS> 0 при DH Химически обратимые реакции протекают одновременно как в прямом, так и в обратном направлении. В начальный момент времени,при смешении реагентов в смеси концентрация исходных веществ максимальна, а продуктов реакции нет, поэтому скорость прямой реакции имеет наиболее высокое значение, а скорость обратной реакции равна нулю. По мере протекания реакции, концентрация исходных веществ уменьшается, и скорость прямой реакции снижается, а продукты реакции накапливаются, и скорость обратной реакции постепенно возрастает. Обратимый процесс длится до тех пор, пока скорости прямой и обратной реакции не станут равны. Состояние, при котором скорости и прямой, и обратной реакции равны, называется химическим равновесием.
Рис. 3.7 Изменение скорости прямой и обратной реакций с течением времени. Любая реакция может протекать самопроизвольно только в направлении, которое приближает систему к состоянию равновесия, в котором силы, вызывающие процесс, уравновешиваются. Химическим равновесиемназывают не изменяющееся во времени при постоянном давлении, объеме и температуре состояние системы, содержащей вещества, способные к взаимодействию. При некоторой температуре энтальпийный и энтропийный факторы уравниваются, то есть DН = Т . DS. В этом случае DG = 0,что являетсятермодинамическим условием химического равновесия. Существуют различные виды равновесных состояний. Истинное(устойчивое, термодинамическое) равновесиесистемы характеризуется неизменностью во времени. При этом система изменяет состояние соответственно внешним воздействиям и его характеристики (например, концентрации) не зависят от того, с какой стороны система подходит к равновесию. Устойчивое равновесие является динамическим. Равновесное состояние сохраняется во времени не вследствие отсутствия или прекращения процесса, а вследствие протекания его одновременно в двух противоположных направлениях с одинаковой скоростью. Кажущееся(метастабильное, заторможенное)равновесиеотличается тем, что для него выполняется только один признак – неизменность во времени. Например, смесь Н2 и О2 может практически бесконечно находиться в неизменном, метастабильном состоянии. Однако это не истинное равновесие, так как, раз начавшись (от искры или действия платинового катализатора, который при этом химически не изменяется), процесс взаимодействия идет быстро и практически до конца с выделением тепла: Количественной характеристикой равновесного состояния является величина, называемая константой равновесия (К). В состоянии равновесия состав системы не меняется, то есть концентрации реагентов и продуктов реакции остаются постоянными (они называются равновесными и обозначаются квадратными скобками). В 1864 году норвежские ученые К. Гульдберг и П. Вааге сформулировали закон действующих масс:отношение произведения равновесных концентраций продуктов реакции к произведению равновесных концентраций исходных веществ (реагентов) с учетом стехиометрических коэффициентов реакции, при Т = const, является величиной постоянной.Например, для обратимой реакции закон действующих масс имеет вид: или, если вещества – газы: где [A], [В], [C] и [D] – равновесные концентрации веществ (моль/л); pA, pB, pC, pD – парциальные давления газов. Например, для реакции закон действующих масс имеет вид Если все реагенты газообразны и их поведение подчиняется законам идеальных газов, то связь между КР и КС можно выразить уравнением: где Δn- изменение числа молей газов в результате реакции; так что для рассматриваемой реакции и Константа равновесия обладает тем свойством, что она не зависит от концентрации реагентов и продуктов. Это значит, что увеличение концентрации одного из веществ приводит к такому изменению концентрации других веществ, что константа равновесия остается неизменной. Если увеличить [A], то [B] уменьшится, а [C] и [D] увеличатся. В то же время константа равновесия зависит от температуры: с увеличением температуры она увеличивается для эндотермических и уменьшается для экзотермических реакций. В выражение закона действующих масс включаются только концентрации растворов, концентрации или давления газов; конденсированные вещества в собственной фазе (Н2О(ж), КСl(т) и т.п.) в формулу не включаются. Например, для реакции Так как Fe2O3, Fe и H2O- конденсированные вещества, то равновесие реакции зависит только от концентрации Н2. Константа равновесия — важнейшая термодинамическая характеристика реакции. По величине константы равновесия (К) можно судить о степени протекания реакции. При очень большом значении К равновесие реакции сильно сдвинуто вправо (в сторону продуктов), а при очень низком значении К реакция протекает в очень незначительной степени и равновесная смесь содержит преимущественно реагенты. Кроме того, по величине К можно вычислять концентрации реагентов и продуктов при достижении равновесия и, как будет показано ниже, DG реакции. Химическая кинетика. Скорость химических реакцийТемы кодификатора ЕГЭ: Скорость реакции. Ее зависимость от разных факторов. Скорость химической реакции показывает, как быстро происходит та или иная реакция. Взаимодействие происходит при столкновении частиц в пространстве. При этом реакция происходит не при каждом столкновении, а только когда частица обладают соответствующей энергией. Скорость реакции – количество элементарных соударений взаимодействующих частиц, заканчивающихся химическим превращением, за единицу времени. Определение скорости химической реакции связано с условиями ее проведения. Если реакция гомогенная – т.е. продукты и реагенты находятся в одной фазе – то скорость химической реакции определяется, как изменение концентрации вещества в единицу времени: υ = ΔC / Δt Если реагенты, или продукты находятся в разных фазах, и столкновение частиц происходит только на границе раздела фаз, то реакция называется гетерогенной, и скорость ее определяется изменением количества вещества в единицу времени на единицу реакционной поверхности: υ = Δν / (S·Δt) Факторы, влияющие на скорость химической реакции1. ТемператураСамый простой способ изменить скорость реакции – изменить температуру . Как вам, должно быть, известно из курса физики, температура – это мера средней кинетической энергии движения частиц вещества. Если мы повышаем температуру, то частицы любого вещества начинают двигаться быстрее, а следовательно, сталкиваться чаще. Однако при повышении температуры скорость химических реакций увеличивается в основном благодаря тому, что увеличивается число эффективных соударений. При повышении температуры резко увеличивается число активных частиц, которые могут преодолеть энергетический барьер реакции. Если понижаем температуру – частицы начинают двигаться медленнее, число активных частиц уменьшается, и количество эффективных соударений в секунду уменьшается. Таким образом, при повышении температуры скорость химической реакции повышается, а при понижении температуры — уменьшается . Обратите внимание! Это правило работает одинаково для всех химических реакций (в том числе для экзотермических и эндотермических). Скорость реакции не зависит от теплового эффекта. Скорость экзотермических реакций при повышении температуры возрастает, а при понижении температуры – уменьшается. Скорость эндотермических реакций также возрастает при повышении температуры, и уменьшается при понижении температуры. Более того, еще в XIX веке голландский физик Вант-Гофф экспериментально установил, что скорость большинства реакций примерно одинаково изменяется (примерно в 2-4 раза) при изменении температуры на 10 о С. Правило Вант-Гоффа звучит так: повышение температуры на 10 о С приводит к увеличению скорости химической реакции в 2-4 раза (эту величину называют температурный коэффициент скорости химической реакции γ). Точное значение температурного коэффициента определяется для каждой реакции. здесь v2 — скорость реакции при температуре T2, v1 — скорость реакции при температуре T1, γ — температурный коэффициент скорости реакции, коэффициент Вант-Гоффа. В некоторых ситуациях повысить скорость реакции с помощью температуры не всегда удается, т.к. некоторые вещества разлагаются при повышении температуры, некоторые вещества или растворители испаряются при повышенной температуре, т.е. нарушаются условия проведения процесса. 2. КонцентрацияТакже изменить число эффективных соударений можно, изменив концентрацию реагирующих веществ . Понятие концентрации, как правило, используется для газов и жидкостей, т.к. в газах и жидкостях частицы быстро двигаются и активно перемешиваются. Чем больше концентрация реагирующих веществ (жидкостей, газов), тем больше число эффективных соударений, и тем выше скорость химической реакции. На основании большого числа экспериментов в 1867 году в работах норвежских ученых П. Гульденберга и П. Вааге и, независимо от них, в 1865 году русским ученым Н.И. Бекетовым был выведен основной закон химической кинетики, устанавливающий зависимость скорости химической реакции от концентрации реагирующих веществ: Скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ в степенях, равных их коэффициентам в уравнении химической реакции. Для химической реакции вида: aA + bB = cC + dD закон действующих масс записывается так: здесь v — скорость химической реакции, CA и CB — концентрации веществ А и В, соответственно, моль/л k – коэффициент пропорциональности, константа скорости реакции. Например , для реакции образования аммиака: закон действующих масс выглядит так: Константа скорости реакции k показывает, с какой скоростью будут реагировать вещества, если их концентрации равны 1 моль/л, или их произведение равно 1. Константа скорости химической реакции зависит от температуры и не зависит от концентрации реагирующих веществ. В законе действующих масс не учитываются концентрации твердых веществ, т.к. они реагируют, как правило, на поверхности, и количество реагирующих частиц на единицу поверхности при этом не меняется. В большинстве случаев химическая реакция состоит из нескольких простых этапов, в таком случае уравнение химической реакции показывает лишь суммарное или итоговое уравнение происходящих процессов. При этом скорость химической реакции сложным образом зависит (или не зависит) от концентрации реагирующих веществ, полупродуктов или катализатора, поэтому точная форма кинетического уравнения определяется экспериментально, или на основании анализа предполагаемого механизма реакции. Как правило, скорость сложной химической реакции определяется скоростью его самого медленного этапа (лимитирующей стадии). 3. ДавлениеКонцентрация газов напрямую зависит от давления . При повышении давления повышается концентрация газов. Математическое выражение этой зависимости (для идеального газа) — уравнение Менделеева-Клапейрона: pV = νRT Таким образом, если среди реагентов есть газообразное вещество, то при повышении давления скорость химической реакции увеличивается, при понижении давления — уменьшается . Например. Как изменится скорость реакции сплавления извести с оксидом кремния: при повышении давления? Правильным ответом будет – никак, т.к. среди реагентов нет газов, а карбонат кальция – твердая соль, нерастворимая в воде, оксид кремния – твердое вещество. Газом будет продукт – углекислый газ. Но продукты не влияют на скорость прямой реакции. 4. КатализаторЕще один способ увеличить скорость химической реакции – направить ее по другому пути, заменив прямое взаимодействие, например, веществ А и В серией последовательных реакций с третьим веществом К, которые требуют гораздо меньших затрат энергии (имеют более низкий активационный энергетический барьер) и протекают при данных условиях быстрее, чем прямая реакция. Это третье вещество называют катализатором . Катализаторы – это химические вещества, участвующие в химической реакции, изменяющие ее скорость и направление, но не расходующиеся в ходе реакции (по окончании реакции не изменяющиеся ни по количеству, ни по составу). Примерный механизм работы катализатора для реакции вида А + В можно представить так: A + K = AK AK + B = AB + K Процесс изменения скорости реакции при взаимодействии с катализатором называют катализом. Катализаторы широко применяют в промышленности, когда необходимо увеличить скорость реакции, либо направить ее по определенному пути. По фазовому состоянию катализатора различают гомогенный и гетерогенный катализ. Гомогенный катализ – это когда реагирующие вещества и катализатор находятся в одной фазе (газ, раствор). Типичные гомогенные катализаторы – кислоты и основания. органические амины и др. Гетерогенный катализ – это когда реагирующие вещества и катализатор находятся в разных фазах. Как правило, гетерогенные катализаторы – твердые вещества. Т.к. взаимодействие в таких катализаторах идет только на поверхности вещества, важным требованием для катализаторов является большая площадь поверхности. Гетерогенные катализаторы отличает высокая пористость, которая увеличивает площадь поверхности катализатора. Так, суммарная площадь поверхности некоторых катализаторов иногда достигает 500 квадратных метров на 1 г катализатора. Большая площадь и пористость обеспечивают эффективное взаимодействие с реагентами. К гетерогенным катализаторам относятся металлы, цеолиты — кристаллические минералы группы алюмосиликатов (соединений кремния и алюминия), и другие. Пример гетерогенного катализа – синтез аммиака: В качестве катализатора используется пористое железо с примесями Al2O3 и K2O. Сам катализатор не расходуется в ходе химической реакции, но на поверхности катализатора накапливаются другие вещества, связывающие активные центры катализатора и блокирующие его работу (каталитические яды). Их необходимо регулярно удалять, путем регенерации катализатора. В биохимических реакция очень эффективными оказываются катализаторы – ферменты. Ферментативные катализаторы действуют эффективно и избирательно, с избирательностью 100%. К сожалению, ферменты очень чувствительны к повышению температуры, кислотности среды и другим факторам, поэтому есть ряд ограничений для реализации в промышленных масштабах процессов с ферментативным катализом. Катализаторы не стоит путать с инициаторами процесса и ингибиторами. Например , для инициирования радикальной реакции хлорирования метана необходимо облучение ультрафиолетом. Это не катализатор. Некоторые радикальные реакции инициируются пероксидными радикалами. Это также не катализаторы. Ингибиторы – это вещества, которые замедляют химическую реакцию. Ингибиторы могут расходоваться и участвовать в химической реакции. При этом ингибиторы не являются катализаторами наоборот. Обратный катализ в принципе невозможен – реакция в любом случае будет пытаться идти по наиболее быстрому пути. 5. Площадь соприкосновения реагирующих веществДля гетерогенных реакций одним из способов увеличить число эффективных соударений является увеличение площади реакционной поверхности . Чем больше площадь поверхности контакта реагирующих фаз, тем больше скорость гетерогенной химической реакции. Порошковый цинк гораздо быстрее растворяется в кислоте, чем гранулированный цинк такой же массы. В промышленности для увеличения площади контактирующей поверхности реагирующих веществ используют метод «кипящего слоя». Например , при производстве серной кислоты методом «кипящего слоя» производят обжиг колчедана. 6. Природа реагирующих веществНа скорость химических реакций при прочих равных условиях также оказывают влияние химические свойства, т.е. природа реагирующих веществ. Менее активные вещества будут имеют более высокий активационный барьер, и вступают в реакции медленнее, чем более активные вещества. Более активные вещества имеют более низкую энергию активации, и значительно легче и чаще вступают в химические реакции. Более стабильные вещества — это, например, те вещества, которые окружают нас в быту, либо существуют в природе. Например , хлорид натрия NaCl (поваренная соль), или воды H2O, или металлическое железо Fe. Более активные вещества мы можем встретить в быту и природе сравнительно редко. Например , оксид натрия Na2O или сам натрий Na в быту и в природе не не встречаем, т.к. они активно реагируют с водой. При небольших значениях энергии активации (менее 40 кДж/моль) реакция проходит очень быстро и легко. Значительная часть столкновений между частицами заканчивается химическим превращением. Например, реакции ионного обмена происходят при обычных условиях очень быстро. При высоких значениях энергии активации (более 120 кДж/моль) лишь незначительное число столкновений заканчивается химическим превращением. Скорость таких реакций пренебрежимо мала. Например, азот с кислородом практически не взаимодействует при нормальных условиях. При средних значениях энергии активации (от 40 до 120 кДж/моль) скорость реакции будет средней. Такие реакции также идут при обычных условиях, но не очень быстро, так, что их можно наблюдать невооруженным глазом. К таким реакциям относятся взаимодействие натрия с водой, взаимодействие железа с соляной кислотой и др. Вещества, стабильные при нормальных условиях, как правило, имеют высокие значения энергии активации. источники: http://lektsii.org/12-7155.html http://chemege.ru/kinetika/ |




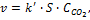

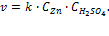








 .
.